-
土壤是一个复杂的多相体系,主要活跃的成分有矿物、有机质和微生物.土壤中矿物和微生物相互作用涉及到一系列物理、化学和生物学过程.土壤矿物与微生物相互作用的第一步是吸附.绝大多数的微生物包括微生物细胞或酶以及微生物在生长代谢或残体分解过程中释放出小分子有机酸和大分子物质,以吸附态的形式与土壤矿物作用,形成细菌-矿物复合体.土壤矿物与微生物的相互作用不仅会改变微生物的生化性质,同时也会改变土壤矿物表面的化学性质[1].例如矿物和吸附的细菌表面疏水性、带电性等都会发生改变,被吸附细菌的生物活性和生长代谢过程也会发生变化.从而对土壤中与生物相关的过程产生影响,例如土壤中元素的循环、矿物的溶解、沉淀和转化、土壤结构体的稳定性、土壤养分的循环及其有效性、土壤有机无机污染物质的迁移、转化和降解以及污染土壤的生物修复等[2].土壤结构体的稳定程度,对土壤肥力的高低、土壤抗侵蚀能力的强弱以及土壤生态环境等效应有极大的影响[3].随着人们对土壤矿物-微生物等相互作用及在土壤等环境中重要性的认识不断深化,矿物-微生物相互作用的研究成为土壤、环境和生态等科学日益关注的焦点[4].
微生物与矿物的相互作用涉及到多种作用力. DLVO理论是用来研究固体胶体颗粒间的总作用能随颗粒间距离变化的趋势.微生物细胞的大小一般是微米级,当微生物细胞游离在土壤溶液中,与土壤溶液中的矿物胶体形成菌胶体悬液,符合胶体动力学规律,可以用胶体科学理论对吸附过程中涉及到的相互作用力进行研究.
钾是继氮、磷元素之后限制作物产量和品质的第3种营养元素.在我国,每年农业需钾量达700万t以上.土壤是一个天然的钾库,钾质量分数在1.5%~2.5%,其中钾长石和云母等硅酸盐的矿物中含有90%~98%以上的钾素,这些钾素多为难溶性钾,不能被农作物利用.如何将难溶性土壤矿物钾转化为植物可利用钾一直是我国科技工作者的重要工作.硅酸盐细菌也称钾细菌,是一类可以分解土壤中含钾的硅酸盐类矿物的微生物[5].硅酸盐细菌可以分解如云母、长石等硅酸盐矿物,释放出钾元素;分解磷灰石释放磷元素,也具有固氮作用,可以改善土壤的营养状况,促进植物的生长[6].硅酸盐细菌与土壤矿物相互作用的研究,不仅有助于揭示土壤矿物中磷、钾、硅等营养元素的释放机理,而且还有利于研究硅酸盐矿物的风化分解作用.矿物与硅酸盐细菌的研究集中在硅酸盐细菌对矿物分解的现象及机理方面.
目前,硅酸盐细菌对含钾硅酸盐类矿物中钾的溶出效果方面的研究已有不少成果[7-8],但对硅酸盐细菌与含钾矿物颗粒间相互作用以及吸附方面的研究较少.本文选取硅酸盐矿物钾长石和硅酸盐细菌,通过DLVO理论和扩展DLVO理论分别计算钾长石体系和钾长石-钾细菌混合体系的相互作用力,探讨钾细菌对钾长石胶体颗粒间相互作用的影响,为深入理解矿物-微生物吸附机制的研究提供科学依据.
全文HTML
-
解钾细菌:胶质类芽孢杆菌(Paeibacillus mucilaginosus)[9];钾长石:实验所用钾长石经0.1 mol/L NH4Cl溶液清洗,阴干备用[9].
-
在超净工作台中进行菌种活化,具体操作步骤如下:吸取钾细菌菌液1~2滴,在缺钾培养基以划线法进行接种,接种培养基和空白培养基在30℃的培养箱中培养40~60h进行活化.活化后,挑取单菌落在液体培养基中,在30℃下摇床培养9~12h,4℃保存待用.
-
钾长石以及钾长石-钾细菌混合体系的比表面积测定采用亚甲基蓝吸附法,比表面积计算公式为
其中,S为需测定样品的比表面积(m2/g),Am为最大吸附量(mol/g),NA为摩尔常数6.02×1023,σ是一个亚甲蓝分子对应的面积0.55×10-18m2.
-
称取1g钾长石样品,加入125mL去离子水,充分混匀,制成钾长石悬液.取含有1 mg钾长石的悬液移入100 mL离心管中,再加入去离子水,用0.1 mol/L的KOH或HNO3调节pH为8.5,加入去离子水补充最终总体积为50 mL.分别加入2 mmol/L亚甲基蓝15,30,60,90,120,150和175 μL,使体系亚甲基蓝浓度梯度分别为0.6,1.2,2.4,3.6,4.8,6和7μmol/L,每个浓度梯度设置3个平行.将离心管平放在振荡器上,25 ℃,150 r/min振荡4 h后,12 000 r/min离心10 min,取上清液,于661 nm波长下比色.同时配制亚甲基蓝系列标准溶液,按上述步骤处理并测定吸光值.
-
移取含有1 mg钾长石胶体的悬液,加入一定量的菌液使每毫克矿物胶体含细菌7.5×107个,加入40 mL去离子水,充分混匀,静置30 min,使矿物胶体与细菌充分作用.步骤同钾长石比表面积测定.
-
称取1.000g样品,加入20mL 50%乙醇,磁力搅拌器搅拌3~5 min,离心后弃去上清液,加入NH4Cl-乙醇交换液50 mL,磁力搅拌器上搅拌30 min,离心后倾出上清液.用95%乙醇洗涤残渣和离心管内壁(约20 mL),将洗涤后的残渣移入锥形瓶中,加入CaCl2-甲醛混合液25mL,再加4滴酚酞指示剂,振荡1 min,用0.1 mol/L NaOH标准溶液滴定至粉红色3min不消失为终点.阳离子交换量公式计算为
其中,C为NaOH标准溶液的浓度(mol/L);V为滴定时消耗的NaOH标准溶液的体积(mL);m为样品的质量(g).
-
钾长石胶体体系和钾长石-钾细菌混合体系的水合斥力、静电作用力以及范德华力计算公式分别如下[10-11]:
其中,Ph为水合斥力(atm),d为相邻颗粒间的距离(dm);PE为静电作用力(atm),R为气体常数[J·(K·mol)],T为绝对温度(K),F为法拉第常数(C/mol),Zi为阳离子化合价,C0为本体平衡浓度(mol/L),
$ \varphi \left( {d/2} \right) $ 是相邻土壤颗粒扩散层重叠处中点d/2的电位(V),由公式(4) 计算式中,k是Debye参数,对于1:1型电解质类型
$ {\varphi _0} $ 是颗粒表面电位,通过公式(6) 计算其中,ε是介电常数[C2/(J·dm)],σ0是表面电荷密度(cmol·m2),CEC为阳离子交换量(cmol/kg),S为比表面积(m2/g). Pvdw是长程范德华力(atm),Aeff是有效Hamaker常数(J),由公式(7) 计算[12]
其中,Am,Aw和Ab分别为矿物颗粒、液相介质和细菌细胞的Hamaker常数.钾长石Am=8.6×10-20J,Aw=4.0×10-20J,Ab=6.1×10-20J,计算出钾长石Aeff=8.7×10-19J,钾长石-钾细菌混合体系Aeff=4.4×10-19J.
1.1. 材料
1.2. 菌种活化
1.3. 钾长石以及钾长石钾细菌混合体系比表面积的测定
1.3.1. 钾长石比表面积测定
1.3.2. 加入钾细菌后钾长石比表面积的测定
1.4. 钾长石阳离子交换量测定
1.5. 钾长石胶体体系和钾长石-钾细菌混合体系的相互作用力
-
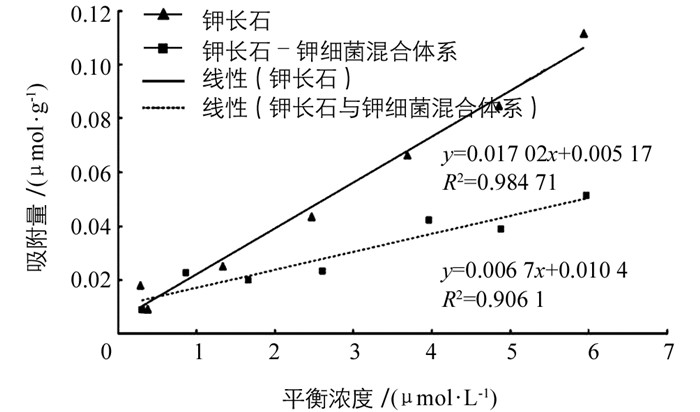
由图 1可知,当亚甲基蓝平衡浓度为0.3~0.4 μmol/L时,钾长石对亚甲基蓝的吸附量迅速增长;当平衡浓度大于0.4 μmol/L时,其吸附量趋于平稳并符合等温吸附曲线变化规律.然而,钾长石-钾细菌混合体系对亚甲基蓝的吸附量表现出不同的变化趋势.主要表现在吸附达到平衡时所需浓度的差异.在亚甲基蓝平衡浓度为0.9~2.6 μmol/L时,钾长石-钾细菌混合体系对亚甲基蓝的吸附量增长迅速;但当平衡浓度大于2.6 μmol/L时,其吸附量才趋于平稳并符合等温吸附曲线变化规律.由此表明:钾长石-钾细菌混合体系对亚甲基蓝的吸附达到平稳时所需的平衡浓度明显大于钾长石对亚甲基蓝的吸附达到平稳时所需的平衡浓度.
已有研究表明,对于均匀表面的单分子层物质的吸附,Langmuir方程可以表示为c/x=c/xm+1/kxm;其中,c为平衡浓度,x为吸附量,k是与能量项相关的常数,xm是最大吸附量.若这种物质的吸附方式符合Langmuir吸附模型,则以c/x对c作图所得应为一直线,从直线的斜率可以求出xm[13].
利用Langmuir方程对钾长石和钾长石-钾细菌混合体系对亚甲基蓝吸附进行拟合,拟合结果如图 2所示.拟合方程分别为
由拟合曲线计算得到:钾长石和钾长石-钾细菌混合体系对亚甲基蓝的最大吸附量分别为58.8 μmol/g和149.3 μmol/g.由此可见,钾长石-钾细菌混合体系对亚甲基蓝的吸附量明显大于钾长石对亚甲基蓝的最大吸附量.
-
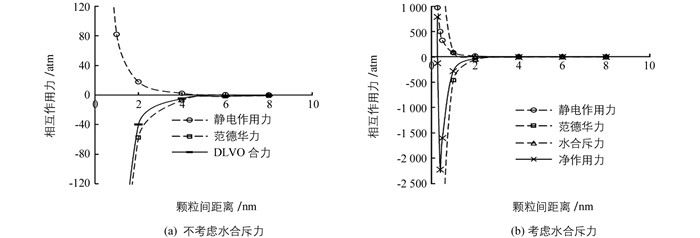
由计算得到钾长石的CEC为56.7 cmol/kg,结合比表面积结果,我们计算了钾长石胶体体系随胶体颗粒间距离变化而引发的颗粒间相互作用力的变化趋势,包括静电作用力、水合斥力和范德华力.
经典的DLVO理论认为胶体体系的稳定性由范德华力和静电作用力共同决定. 图 3(a)表示钾长石胶体颗粒间静电作用力、范德华力以及DLVO合力随颗粒间距离变化的趋势.静电作用力为正值,表现为斥力,通常静电斥力阻碍胶体颗粒间聚合.范德华力为负值,表现为吸引力,诱导聚合发生.静电斥力和范德华力随颗粒间距离的减小而增大,表现为颗粒间距小于2 nm时,这两种力迅速增大,2~4 nm时增长缓慢,大于6 nm后基本保持不变. DLVO的合力表现为吸引力.当钾长石胶体颗粒相互靠近时,在颗粒间距离6~10 nm时,吸引力较小;颗粒继续靠近达到4 nm后,吸引力迅速增强;当胶体颗粒间距离进一步减小,胶体颗粒达到稳定.
经典的DLVO理论无法解释胶体颗粒的分散,在范德华力和静电作用力外还有一个可以克服范德华吸引力的作用力—水合斥力. Pashley(1981) 和Ducker(1992) 等人发现,颗粒间距离在1.5~2 nm时,颗粒间产生强烈的水合斥力[14-15].胡斐南等(2015) 研究发现,水合斥力在团聚体的膨胀过程中起主要作用.当颗粒间距离大于1.5 nm后,水合斥力消失,静电斥力克服范德华吸引力,使颗粒彼此远离,团聚体破裂[11].扩展DLVO理论认为由范德华力、静电作用力和水合斥力三者合力即净作用力决定胶体的稳定性. 图 3(b)表示钾长石胶体颗粒间水合斥力和净作用力随颗粒间距离变化的趋势.水合斥力随颗粒间距离的减小而增大,小于2 nm时迅速增大,大于2 nm后基本保持不变.当颗粒间距离大于0.4 nm时,净作用力为吸引力;随着颗粒间距离的增大,净作用力逐渐减小;在无限远处趋向于0.颗粒间距为0.28~0.4 nm的范围时,净作用力随颗粒间距离的增大而增大;在颗粒间距达到0.4 nm时出现最大的吸引势阱,势能达到2226 atm.颗粒间距小于0.28 nm时,钾长石胶体颗粒间的作用力表现为排斥力;随着颗粒间距离的增大,排斥力迅速减弱;吸引力起主导作用并促进颗粒的进一步靠近,从而使得钾长石对亚甲基蓝的吸附增强.
-
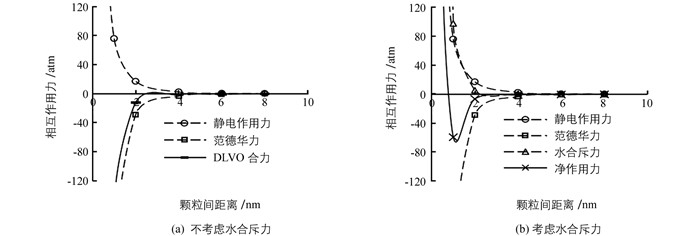
图 4(a)表示钾长石-钾细菌混合体系静电作用力、范德华力和DLVO合力随颗粒间距离变化的趋势.由此可见,静电作用力和范德华力随颗粒间距离的减小而增大.其主要表现为小于2 nm时迅速增大;2~4 nm时,增长缓慢;大于4 nm后基本保持不变;DLVO合力表现为吸引力.当钾长石-钾细菌混合体系颗粒相互靠近时,在颗粒间距离2~10 nm时,吸引力较小,逐渐靠近,在颗粒间距离达到2 nm后,吸引力迅速增强,胶体颗粒间距离进一步减小,胶体颗粒达到稳定.
图 4(b)表示钾长石-钾细菌混合体系颗粒间水合斥力和净作用力随颗粒间距离变化的趋势.水合斥力随颗粒间距的减小而增大,小于2 nm时迅速增大,大于2 nm后基本保持不变.当颗粒间距大于1 nm时,净作用力为吸引力.表现为吸引力随着颗粒间距离的增大而逐渐减小,在无限远处趋近于0;颗粒间距在0.55~1 nm的范围时,吸引力随着颗粒间距离的增大而增大;在颗粒间距小于0.55 nm时,钾长石-钾细菌混合体系颗粒间产生排斥力,阻碍了颗粒间的聚合.在颗粒间距1 nm时产生强烈的吸引力,达到了59 atm.
2.1. 钾长石以及钾长石-钾细菌混合体系对亚甲基蓝吸附量的差异分析
2.2. 钾长石-钾细菌混合体系和钾长石体系相互作用力分析
2.2.1. 钾长石胶体体系相互作用力
2.2.2. 钾长石-钾细菌混合体系相互作用力
-
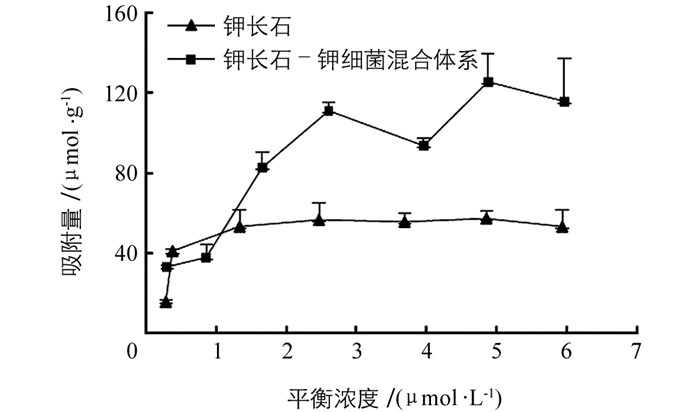
钾长石-钾细菌混合体系对亚甲基蓝的吸附量明显大于钾长石对亚甲基蓝的最大吸附量.其可能的主要原因在于钾长石-钾细菌混合体系比表面积大于钾长石比表面积.根据最大吸附量的结果,我们计算得到钾长石-钾细菌混合体系和钾长石的比表面积分别为49.4 m2/g和19.5 m2/g.钾长石胶体体系中加入细菌后,体系的比表面积增加,因而增加了胶体对亚甲基蓝的吸附量.张学文等的研究中,加入抗重金属细菌,褐土胶体、红壤胶体和高岭石体系的比表面积增加了3%~8.7%[16].细菌比表面积大,加入钾长石胶体中,形成的钾长石-钾细菌混合体系的比表面积增大,可能是对亚甲基蓝吸附量增加的主要原因.
DLVO理论由科学家Deijaguin和Landau以及Verwey和Overbeek提出的,是用来描述胶体体系的稳定性的理论,反应胶体颗粒间的作用力随胶体颗粒间距变化的趋势.微生物细胞大小一般在微米级,微生物细胞与土壤矿物胶体形成菌胶体悬液,符合胶体动力学规律,可以用胶体科学理论进行研究.目前为止,已经运用DLVO理论对于微生物的聚合和各种生物体系的附着行为进行解释[17]. Marshall等认为可以用DLVO理论解释电解质浓度对细菌最初吸附过程的影响,这也是第一次运用DLVO理论进行细菌与固相表面吸附的研究[18]. Sharma和Rao运用表面自由能热力学模型和扩展的DLVO理论研究多粘类芽孢杆菌在黄铜矿和黄铁矿表面的吸附情况,发现DVLO理论比表面自由能热力学模型能够更好地预测吸附行为,也更与实际情况吻合[19]. Hong等研究了枯草芽孢杆菌与高岭石、蒙脱石、针铁矿、水钠锰矿、石英和云母矿物表面的吸附行为的研究时,认为吸附可以通过扩展DLVO理论进行预测,在中性以及较小电解质条件下,静电斥力起主要作用[20].运用经典DLVO理论和扩展DLVO理论对微生物与矿物相互作用进行解释,可以得出矿物胶体与细菌间距离为d时相应的相互作用自由能与作用距离d的关系;也可以模拟在不同pH,不同离子强度,不同温度时相互作用势能随颗粒间距离变化的趋势.
矿物胶体颗粒带有大量的电荷,两个相邻的胶体颗粒彼此靠近,由于同性相互排斥,产生静电斥力.双电层中与胶体颗粒电荷相反的离子,对表面电荷产生屏蔽作用.钾长石-钾细菌混合体系较钾长石胶体体系比表面积增大,表面吸附阳离子的量增大,导致离子屏蔽静电场的能力增强,静电斥力减小,吸引力增大,从而提高了矿物-细菌混合体系的吸附强度.在颗粒间距离相同时,钾长石-钾细菌复合体的静电斥力较钾长石胶体弱,提高了吸附强度.相对于单一矿物体系,细菌加入后混合体系的比表面积增加了15%和13%,复合体对Mn(Ⅱ)的最大吸附量分别增加了24%和23%[21].细菌-矿物复合体吸附能力的增加,有利于其对酸根离子和其他离子的吸附,增强了细菌对矿物表面的溶蚀作用[22].
-
对亚甲基蓝的吸附量表现出,钾长石-钾细菌混合体系明显大于钾长石胶体单一体系.主要原因在于钾长石-钾细菌混合体系比表面积大于钾长石比表面积;比表面积的增加,导致钾长石-钾细菌混合体系吸附反离子的能力增大,屏蔽电场的强度增强,静电斥力减小,吸引力增加,从而提高了吸附强度.



 下载:
下载: