-
烟草是四川省的主要经济作物之一,全省常年种植面积达6.67万hm2.近些年来,由于种植结构的一些变化,蔬菜、花卉和果树行业迅速发展,这些植物成为烟草病毒新的宿主植物[1],使得烟草病毒病的发生日益加重. CMV和PVY由于其蚜传特性,因而在烟草生产上更容易引起病毒病的流行和爆发.黄瓜花叶病毒(Cucumber mosaic virus,CMV)属于雀麦花叶病毒科Bromoviridae,黄瓜花叶病毒属Cucumovir-us,可侵染67个科1 000多种植物. CMV包括基因组RNA1,RNA2,RNA3和亚基因租RNA4,RNA5,所以CMV易发生变异重组.根据血清学特征,将CMV分离物分为4个血清型和3个血清组. 4个血清型分别为S血清型、R血清型、DTL血清型、To血清型. 3个血清组分别为Co血清组、ToRS血清组、DTL血清组[2].其中,血清组DTL为亚组Ⅰ,血清组ToRS为亚组Ⅱ.在亚组Ⅰ内根据CMV RNA3的5'端,非编码区序列的比对结果,亚组Ⅰ又可以进一步分为IA和IB,并且推测,RNA3的5'端的非编码区的序列发生重排、插入、删除可能导致了CMV不同亚组的出现[3].
马铃薯Y病毒(Potato virus Y,PVY)属于马铃薯Y病毒科Potyviridae马铃薯Y病毒属Potyvirus. PVY分离物可以分为2个血清型,PVYO.C血清型和PVYN血清型. PVYO.C血清型包括PVYO,PVYC,PVYZ,PVYN:O. PVYN血清型(以后称之为PVYN/NTN),包括PVYN和PVYNTN[4-5].根据寄主的症状和蚜传特性,PVY可以划分为3个株系,分别为普通株系、脉坏死株系、点条纹株系.普通株系(PVYO)在马铃薯上引起皱缩或条纹落叶病,在烟草上则引起系统斑驳症状;脉坏死株系(PVYN)在马铃薯上引起轻微的斑驳症状,在烟草上则引起严重的系统脉坏死症状;点条纹株系(PVYC)在马铃薯一些品种上引起过敏反应,在另一些品种上引起花叶症状,而在烟草上则引起系统斑驳症状[6].近些年来,在欧洲和美洲地区出现 了一些新的PVY株系,例如PVYN:O,PVYNW,PVYNTN,PVYNA-NTN,这些株系都是PVYO和PVYN重组或突变而成的株系[7]. PVY Wilga最早是从波兰Wilga这个品种中分离得到的,之后被称为PVYN:O株系[8]. PVY的各种新株系致病力更强,并且因蚜虫传播迅速扩散.
到目前为止,RNA病毒是植物中最常见的病毒[9].病毒在自然界中会由于内外因素的影响发生重组和变异,将导致新毒株、新株系,甚至是新种类出现.序列分析已经成为研究病毒演化最重要的工具之一.由于CMV和PVY都是RNA病毒并且可以通过蚜虫传播,所以它们在自然条件下很容易远距离传播并发生突变和重组而形成致病力不同的新株系.本研究利用RT-PCR对四川省14个县、市,252份烟草样品的CMV和PVY病毒进行病害检测和株系鉴定,以期进一步了解四川烟草上CMV和PVY病毒的株系情况.
全文HTML
-
从四川省4个烟区采集252份烟草病毒样品.采集地为四川省广元市(张帽ZM、普安PA、元坝YB),达州市(天龙TL、红岩坝HYB、沙坝SB),西昌市(德昌DC、宁南NN、普基PJ、喜德XD、盐源YY),攀枝花市(米易MY、仁和RH、盐边YBb).
植物总RNA提取试剂盒、DNA凝胶回收试剂盒购自天根科技有限公司,大肠杆菌Escherichia coli感受态细胞DH5α购自北京全式金生物技术有限公司,载体pGEM-T Easy Vector购自Promaga公司,其他生物学试剂均购自TaKaRa公司.
-
病叶和健康烟叶总RNA的提取采用Trizol试剂盒,具体方法如下:① 管中加入500 μL RLT和50 μL PLANTaid备用;② 称取叶片0.1~0.2 g,液氮研磨至细粉转移至管中,56 ℃水浴3 min,13 000 r/min,离心10 min;③ 上清转移至新管,加入0.5体积的无水乙醇(一般为250~225 μL),13 000 r/min,离心2 min,弃废液;④ 加700 μL RW1,13 000 r/min,离心30 s,弃废液;⑤ 加500 μL RW,12 000 r/min,离心30 s,弃废液,重复1次;⑥ 吸附柱放入收集管,13 000 r/min,离心2 min,弃废液;⑦ 将吸附柱放入新管,加入30~50 μL RNase free water,1 200 r/min,离心1 min,弃吸附柱,收集样品RNA.
-
PCR引物根据GenBank上发表的CMV CP,PVY CP基因序列分别设计3对引物,由华大基因公司合成,经特异性检测确定最佳引物对(表 1).
-
以提取的总RNA为模板,反转录合成cDNA的第1条链,在10 μL的反应体系中加入RNase Free ddH2O 4.0 μL,5×Prime Script Buffer 2.0 μL,Oligo dT Primer 0.5 μL,Random 6 mers 0.5 μL,Prime Script RT Enzyme Mix 0.5 μL,RNA提取物2.5μL. 37 ℃反应15 min,85 ℃反应20 s.
PCR扩增,以1.0 μL DNA为模板,在25 μL的反应体系中加入10×Reaction buffer 2.5 μL,rTaq DNA聚合酶0.3 μL (1 U),10 mmoL/d NTPs 0.5 μL,上、下游引物各0.5 μL,剩余以灭菌ddH2O补足.扩增条件为95 ℃预变性3 min,95 ℃变性30 s,56 ℃退火50 s,72 ℃延伸110 s,进行30个循环,最后72 ℃延伸时间为10 min.用1%琼脂糖凝胶电泳检测PCR产物,在110 V下电泳25 min,经Goldview染色后观察电泳结果并拍照.
-
回收RT-PCR产物,与载体pGEM-T Easy Vector连接,转化到E.coli DH5α.克隆经过PCR鉴定呈阳性的菌液,由华大基因公司负责序列测定.对所得的核苷酸序列在GenBank上进行BLAST比对,并且用MEGA5(http://www.megasoftware.net/)、DNAMAN和DNAstar软件分析所得的序列,从NCBI上选取各株系的代表序列(表 2,表 3)与所得的序列进行核苷酸、氨基酸同源性比较,构建系统发育树.其中烟草花叶病毒(Tobacco mosaic virus,TMV,No. AF012917.1) 作为外群对照.
1.1. 材料
1.2. 样品总RNA提取
1.3. 引物的设计与合成
1.4. RT-PCR检测
1.5. 克隆、测序及序列分析
-
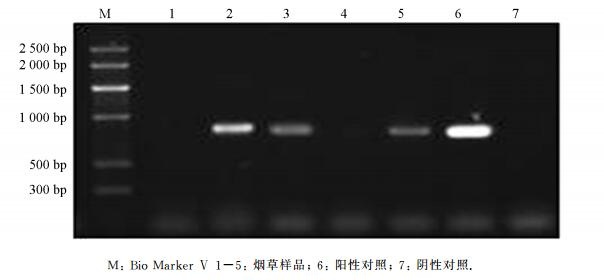
以采集样品烟草叶片总RNA的反转录产物为模版,利用引物CMV-R和CMV-F进行PCR扩增,PCR产物经过1%的凝胶琼脂电泳,可得到大小约657 bp的条带,与预期目标片段大小相符,测序结果证实为CMV CP序列,而从健康烟叶中未扩增出特异性条带(图 1),表明本研究设计的CMV CP特异性引物及建立的检测体系可以用于样品检测.
-
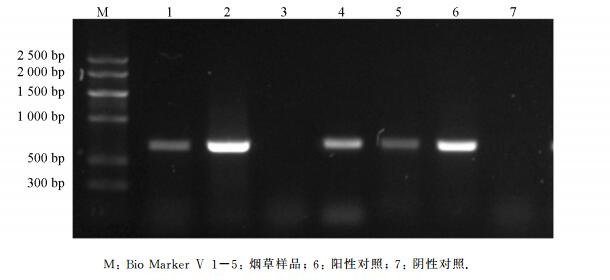
以采集样品烟草叶片总RNA的反转录产物为模版,利用引物PVY-R和PVY-F进行PCR扩增,PCR产物经过1%的凝胶琼脂电泳,可得到大小约759 bp的条带,与预期目标片段大小相符,测序结果证实为PVY CP序列,而从健康烟叶中未扩增出特异性条带(图 2),表明本研究设计的PVY CP特异性引物及建立的检测体系可以用于样品检测.
-
对四川广元市、达州市、西昌市、攀枝花市4个烟区CMV和PVY的发生情况进行调查,结果显示,在252份样品中CMV占84例,约为33.33%,PVY占87例,约为34.52%,两者复合侵染40例,约为15.87%.其中,达州地区病毒病的发生情况最为严重,CMV的发病率为66.67%,PVY为80%,两者复合侵染率超过了50%.相比之下,攀枝花的发病情况较轻,CMV为23.53%,PVY为17.65%,两者复合侵染率也最低,仅为5.88%(表 4).
-
随机选不同地区样品中的CMV CP克隆进行测序,结果表明SB2,SB3,SB4,YB6,ZM5,HYB1,HYB6,XD4,PJ4,PJ9,PJ11,NN4,TL5这些四川CMV分离物的CP基因序列长度均为657个核苷酸,编码219个氨基酸.所得序列上传至GenBank获得登录号分别为KJ746019,KJ746020,KJ746021,KJ746022,KJ746023,KJ746014,KJ746013,KJ746015,KJ746012,KJ746011,KJ746018,KJ746016,KM875631.四川CMV分离物间CP基因核苷酸序列的同源性为94.5%~99.5%,氨基酸的同源性为96.3%~99.8%,氨基酸序列的同源性比核苷酸序列的同源性略高.四川CMV分离物与各代表株系进行核苷酸同源性比较,结果显示CMV四川分离物与Ⅱ组分离物核苷酸序列的同源性仅为74.9%~78.8%,与IA亚组核苷酸序列的同源性为91.9%~94.1%,与IB亚组核苷酸序列的同源性为93.6%~97.6%.表明四川CMV分离物与IB亚组的同源性关系密切,结合系统发育树可以看出(图 3),四川CMV分离物应该归属于CMV IB亚组.
-
随机选不同地区样品中的PVY CP克隆进行测序,结果表明TL2,TL3,TL4,TL5,TL6,HYB2,HYB7,SB1,SB2,SB3,SB4,SB6,ZM3,ZM6,YB6,YY8,YY10,XD3这些四川PVY分离物的CP基因序列长度均为759个核苷酸,共编码253个氨基酸.所得序列上传至GenBank获得登录号分别为KJ599652,KJ599653,KJ605679,KJ605680,KJ605681,KJ599650,KJ599651,KJ868845,KJ868847,KJ543496,KJ868846,KJ868848,KJ634690,KJ634691,KJ634694,KJ634692,KJ634693,KJ746017.四川PVY分离物与各代表株系进行核苷酸同源性比较,分离物TL2,TL4,ZM3,ZM6,YY8,YY10,XD4,SB3与PVYN:O,PVYO,PVYN,PVYNTN株系的核苷酸同源性分别为99.1%~99.6%,94.4%~99.2%,87.5%~89.7%,88.9%~91.6%.分离物HYB2,HYB7,SB1,SB2,SB4,SB6,YB6与PVYN:O,PVYO,PVYN,PVYNTN株系的核苷酸同源性分别为97.2%~98.7%,97.4%~99.5%,87.5%~89.9%,89.1%~91.6%.分离物TL3,TL5,TL6与PVYN:O,PVYO,PVYN,PVYNTN株系的核苷酸同源性分别为87.6%~88.1%,87.0%~88.0%,93.3%~98.7%,为93.0%~94.7%.结合系统发育树可以看出(图 4),四川PVY分离物TL2,TL4,ZM3,ZM6,YY8,YY10,XD4,SB3属于PVYN:O株系,分离物HYB2,HYB7,SB1,SB2,SB4,SB6,YB6属于PVYO株系,分离物TL3,TL5,TL6属于PVYN株系.
2.1. 烟草样品的RT-PCR检测
2.1.1. CMV CP基因RT-PCR检测
2.1.2. PVY CP基因RT-PCR检测
2.2. 田间样品病毒种类的统计与分析
2.3. CP的序列分析
2.3.1. CMV CP的序列分析
2.3.2. PVY CP的序列分析
-
CMV亚组划分的依据主要是根据核酸组成、衣壳蛋白肽链图谱、核苷酸序列、血清学反应来划分.迄今为止,CMV基本上可以分为3个亚组,分别为亚组IA、亚组IB和亚组Ⅱ.我国已经报道的38个科120多种植物上分离得到的CMV,除了厦门报道的芭蕉和西番莲上面发现的CMV分离物为亚组Ⅱ外,其他CMV分离物多为亚组Ⅰ,这说明CMV亚组Ⅱ在我国很少发生[10].李凡等[11]2000年首次在烟草上面发现CMV亚组Ⅱ分离物.本研究对四川烟区烟草上的CMV分离物的CP基因进行了克隆测序并构建系统发育树,结果显示四川CMV分离物主要和来自印度和中国的IB亚组聚集在一大支,在进化上表现出一定的地域相关性,四川CMV分离物均属于IB亚组,并且与已报道的杂草及药用植物上的CMV分离物关系较近,可以推测烟草周围杂草及其他作物上的CMV可能是烟田CMV的主要毒源.从系统发育树可见,CMV主要聚集为两组,一组为广元和达州地区,一组为西昌地区.从地理位置上看,广元和达州地区主要分布在四川省的东北方向,且两个地区相近,而西昌则在西南方向,由此得出四川CMV分离物有一定的地域差异性.鉴于烟草上面主要以CMV亚组Ⅰ的危害为主,所以烟草的抗病育种应该以亚组Ⅰ分离物为主.
开展PVY株系鉴定具有重要的理论及实践意义[10].本研究PVY系统发育树显示,PVY可以分为两支,支点Ⅰ包括PVYO,PVYN:O和PVYC,支点Ⅱ包括PVYNTN和PVYN.四川PVY分离物与中国重庆、云南、宁夏、内蒙古这些地方的PVY分离物同源性很近.目前,我国在分子水平上对PVY株系已经开始研究.王秀芳等[12]研究证明了山东PVY分离物属于PVYO株系.石鹏君等[13]克隆并且表达了PVYN和PVYO株系的HC-Pro基因.陈士华等[14]研究表明,黑龙江PVY分离物为PVYNTN株系,贵州贵阳、山西临县分离物为PVYN:O株系.吴志明等[15]对河北PVY分离物进行鉴定,判断其为PVYO株系.核苷酸同源性比对结果并结合系统发育树可以看出,四川烟区PVY有着明显的株系分化现象,PVYN:O株系、PVYO株系、PVYN株系均有发生,PVYN:O是四川烟草上面的优势种群,这也是全球各地流行的PVY重组株系之一[16].四川PVY分离物显示出一定的地域差异,不同烟区采集的PVY在系统发育树上分属不同的支点.在PVYN:O株系中,西昌分离物YY10与美国分离物PB209和加拿大分离物N:O-Mb112的亲缘关系较近,达州分离物SB3与美国分离物Alt亲缘关系较近.在PVYO株系中,广元分离物YB6与加拿大分离物PVYO139的亲缘关系较近,而达州分离物HYB2,HYB7,SB1,SB2,SB4,SB6聚集为一支,并且与英国分离物SASA-110的亲缘关系较近.在PVYN株系中,达州分离物TL3,TL5,TL6与南非分离物TT138E-111-104处于一支,亲缘关系较近.四川烟区PVY株系的多样化给防治PVY引起的病毒病带来了一定的困难.不同株系在蚜虫传毒效率方面是否有一定的差异,值得进一步深入研究.



 下载:
下载: