-
简单序列重复区间(inter simple sequence repeat,ISSR)由ZIETKIEWICZ等人于1994年创立,是一种基于微卫星发展起来的分子标记方法,结合了SSR和RAPD的优点[1],近几年已广泛应用于桃、狗牙根和菊花[2-4]等植物研究中.越桔(Vaccinium vitis-idaea Linn.)俗称蓝莓,杜鹃花科(Ericaceae)越桔属(Vaccinium Linn.)灌木或小乔木,果实为蓝色浆果,富含多种维生素、黄酮和花青素等抗氧化活性物质,食用价值高[5].我国从1983年开始引种栽培,先后从美国、加拿大等地引入100余个品种[6],由于引种途径等原因,当前生产上广泛存在着同名异物、同物异名等现象[7],而越桔许多品种形态差异较小,用常规方法难以鉴别,因此分子标记能够为越桔种质资源的分析和品种亲缘关系的鉴定提供更准确的依据.
GARRIGA M等人利用ISSR与SSR技术对蓝丰、薄雾和奥尼尔等多个越桔品种进行分析,对比两种技术发现ISSR比SSR稳定性、灵敏度更高,更适合于越桔种质资源的鉴定;於虹[8]、宋杨[9]利用ISSR技术对南高丛、北高丛越桔及兔眼越桔进行亲缘关系鉴定;李广平等人[10]通过正交设计试验及单因子优化试验对蓝莓ISSR反应条件的5个主要因素进行了探讨.由于ISSR是一种基于PCR的分子标记技术,其稳定性受Tag酶、dNTPs、引物等因素的影响较大,因此需要建立一个稳定可靠的ISSR-PCR反应体系.正交试验可避免传统单因素试验顾此失彼的缺点,并且能通过有限的试验组合找出最佳的反应条件及各因素对试验的影响主次.本试验从Tag酶;Mg2+;DNA;dNTPs及引物这5个主要因素4个水平出发,结合直观分析和方差分析,以求获得越桔ISSR-PCR反应体系的最佳组合.
全文HTML
-
供试的越桔取自西南大学园艺园林学院园林植物栽培与育种实验室,分别为南高丛品种:奥尼尔、薄雾、V3、南好、夏普蓝、莱格西;北高丛品种:达柔、蓝丰、蓝线、布里吉塔.
-
十六烷基三甲基溴化铵(CTAB)、巯基乙醇、聚乙烯基吡咯烷酮(PVP)、氯仿、异戊醇、醋酸钾、无水乙醇、75%乙醇、RNase(10 mg/mL)、Tag酶;Mg2+;dntps和DNAmarker均购于TaKaRa(大连)公司. ISSR引物根据加拿大哥伦比亚大学公布的序列设计,本试验所用引物UBC835序列为:(AG)8YC;UBC807序列为:(AG)8T;UBC827序列为:(AC)8G,其中Y=(C,T).由北京鼎国生物工程有限公司合成.
-
越橘基因组提取参考张鲁杰等人[11]方法并结合实际情况进行适当调整以获得高质量的DNA.主要步骤:取长势旺盛的越桔叶片1 g去主脉撕成小碎片置于研钵中,加入一小勺PVP防止材料褐化,加入液氮快速研磨,立即转移粉末至离心管中,加入60 μL巯基乙醇和在65 ℃下预热30 min的2%CTAB裂解液3 mL,混匀,65 ℃水浴1 h,每隔15 min轻轻上下摇匀一次,凉至室温,加入200 μL提前预冷的醋酸钾,混匀冰浴30 min,12 000 r/min,离心5 min,取上清液,加入等体积的V(氯仿):V(异戊醇)=24:1,静置5 min,12 000 r/min,离心8 min,取上清液,加入2 μL RNase,37 ℃消化20 min,再加入等体积的V(氯仿):V(异戊醇)=24:1,静置5 min,12 000 r/min,离心8 min,取上清液加入400 μL醋酸钾和2倍体积无水乙醇,混匀冰浴20 min,12 000 r/min,离心5 min,弃上清液,75%乙醇、无水乙醇各洗一次,烘干,加入无菌水于-20 ℃保存.
用0.8%琼脂糖电泳及Nanodrop2000检测DNA质量,无菌水稀释至0.8 mmol/L.
-
采用L16(45)正交设计表(表 1),选用越桔品种薄雾DNA为模板,引物UBC835进行试验,每个处理重复2次.各处理总体积为20 μL,均加入2 μL无Mg2+10×buffer,不足用超纯水补足.
-
PCR反应在Eppendorf Mastercycle上进行,扩增程序:94 ℃ 5 min;94 ℃ 1 min;53 ℃~56 ℃ 45 s;72 ℃ 1 min,35个循环,72 ℃延伸10 min,4 ℃保存.扩增产物用1.5%琼脂糖凝胶电泳70 min检测.在凝胶成像系统上拍照,并用Quantity One 4.3.1软件分析.
-
根据正交试验结果,选择最佳组合进行退火温度梯度试验.梯度设置以引物Tm值为基准上下浮动1~2 ℃于Eppendorf Mastercycle梯度PCR仪上进行.
-
用最佳反应体系对循环次数和延伸时间进行梯度试验.
-
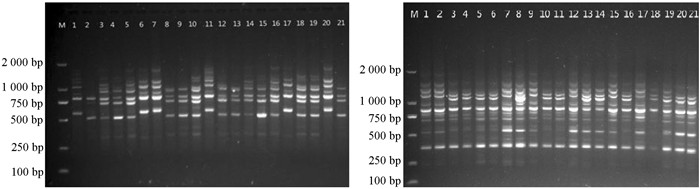
用最佳反应体系和反应程序对21份越桔材料进行稳定性验证.
1.1. 材料
1.2. 试验试剂
1.3. 方法
1.3.1. 基因组DNA提取
1.3.2. 正交试验设计
1.3.3. PCR反应条件及电泳成像
1.3.4. 退火温度的确定
1.3.5. 循环次数和延伸时间的确定
1.3.6. 最佳体系和程序的验证
-
对越桔DNA提取方法适当改进(图 1),获得DNA质量较好,纯度高,主带清晰,无拖带,杂质去除彻底,适合做ISSR-PCR扩增模板.
-
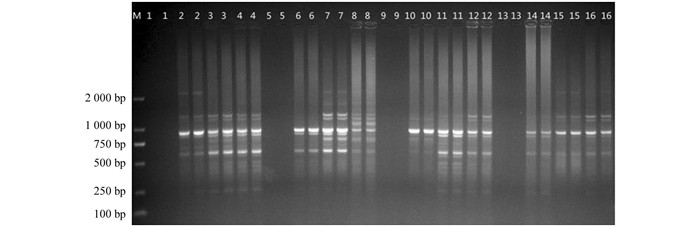
正交试验结果见图 2,16个组合除第1,5,9,13组合外均能扩出条带,参照何正文等[12]的方法对各组合打分,条带丰富,清晰且稳定的记16分,最差的记1分,两次重复单独记分.根据打分求出每一因素同一水平下的均值Ki,并求出同一因素不同水平下平均值的极差R(表 2).
极差R反应了各因素对结果的影响水平,R越大影响越显著,由表 2可知各反应因素对蓝莓ISSR(20 μL)反应体系的影响从大到小依次为:Mg2+,Tag酶,引物,模板,dNTPs.每一因素水平下的平均值K反映了影响因素在该水平下对反应体系的影响大小,K越大,反应水平越好.由直观的图片(图 2)可以看出,在16种组合中,反应最好的是第7组,其分值也是最高的.为了进一步确认第7组是否为最优组合,还应进行方差分析和因素内多重比较分析.
-
经SPSS17.0软件方差分析和多重比较分析,Tag酶,Mg2+,DNA,dntps,primer的P值均小于0.01(表 3),说明这几个因素对反应的影响都是极具有统计学意义的.且由F值可知,各因素对反应的影响大小顺序与极差分析结果一致且极具有统计学意义,可进一步进行因素内多重比较分析.
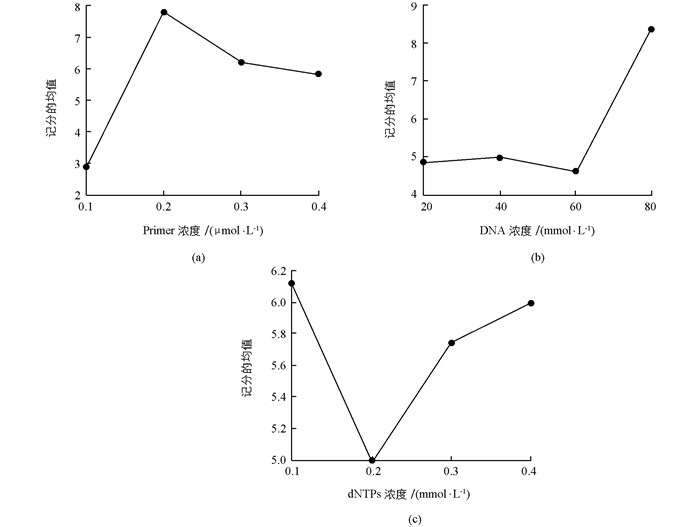
经多重分析表明,在20 μL体系中,Mg2+的4个水平是影响PCR结果的重要因素之一,Mg2+不仅影响Tag酶活性还能与体系中dntps、DNA和引物结合,过量易生产非特异性扩增产物,过少使产量不足[9].本试验中由直观分析和方差分析综合可知:Mg2+浓度对反应的结果影响最大,且当浓度为1.875 mmol/L时试验均值最高(图 3(a)),从泳道1、5、9未扩出带,而3和7带型清晰也能看出水平3的Mg2+浓度为该体系中的最佳水平,因此选择1.875 mmol/L为Mg2+反应最佳水平.
本试验中Tag酶用量对PCR反应的影响仅次于Mg2+,试验结果均值在0.50,0.75,1.00,1.25 U各水平间差异具有统计学意义,且随浓度增加而降低(图 3(b)),研究表明Tag酶浓度过高易产生非特异性条带,扩增条带减弱,清晰度下降[13].从试验效果和经济角度出发选择0.5 U为最佳反应浓度较合适.
引物浓度过高易引起错配和非特异性产物增加,多重比较分析结果均值随引物浓度先上升后下降(图 4(a)),在0.2处达最高,从处理2和7的条带明显好于1(0.1 μmol/L)和14(0.4 μmol/L)能看出0.2 μmol/L较其他水平效果好.因此选择0.2 μmol/L为引物反应浓度.
在PCR扩增中,模板加入的浓度与其种类、纯度、扩增目的等有关[14],基因组常用范围为20~80 mg/L.本试验中DNA质量浓度在80 mg/L时结果均值最大,与李广平[10]研究结果不同.
dNTPs为PCR反应的原料,浓度过低扩增产物量下降,过高错配几率增加,本试验中结果均值随Dntp浓度先下降后上升,从经济角度考虑选用0.1 mmol/L作为最佳浓度.
综合以上正交试验的直观分析和方差分析得出:越桔ISSR-PCR(20 μL)体系中各组分的最佳浓度为:Tag酶0.75 U;Mg2+1.875 mmol/L;DNA 80 ng;dNTPs 0.1 mmol/L;引物0.2 μmol/L.这与正交组合中得分最高的7组合(Tag酶0.5 U)相比,除Tag酶浓度不同外,其余均相同.
-
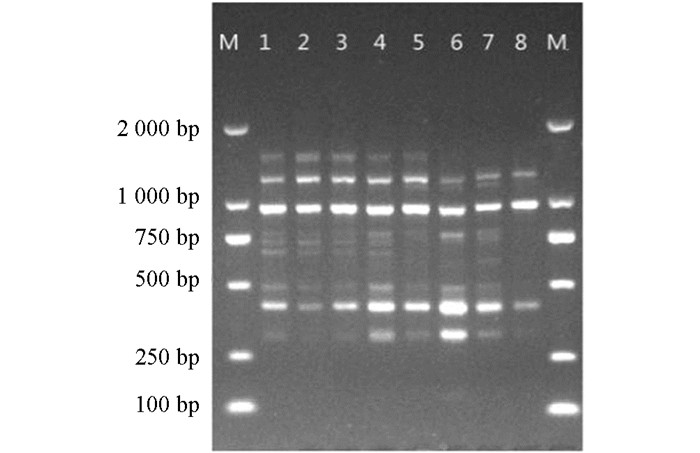
以越桔品种薄雾为材料,根据正交试验结果选择最佳组合进行引物UBC835退火温度梯度试验,由图 5可知,退火温度较低时,扩增条带弱,背景模糊,随着温度提高,条带逐渐清晰,由于ISSR引物较长,可适当提高退火温度以提高扩增产物的特异性.因此选择54.2 ℃作为UBC835的最佳退火温度.
-
ISSR-PCR的循环次数对扩增效果具有重要影响,不同材料所需循环次数不同.循环次数过少,扩增产物少,部分条带无法检测.循环次数过多会引起非特异性结合增加,产生弥散状条带.由图 6可知,当循环次数为25和30时,扩增条带较少而暗,当循环次数为35和40时扩增条带清晰,亮度高,当循环次数为45时,条带弥散并出现杂带干扰,因此,选择35次为越桔ISSR-PCR扩增的最佳循环次数.
延伸时间一般为(0.5~1 min)*待扩增片段长度.参照郑珊等[15]的延伸时间,设置30,60,90,120 s,4个梯度,在60 s时获得最佳扩增效果,因此本试验选择延伸时间为60 s.
-
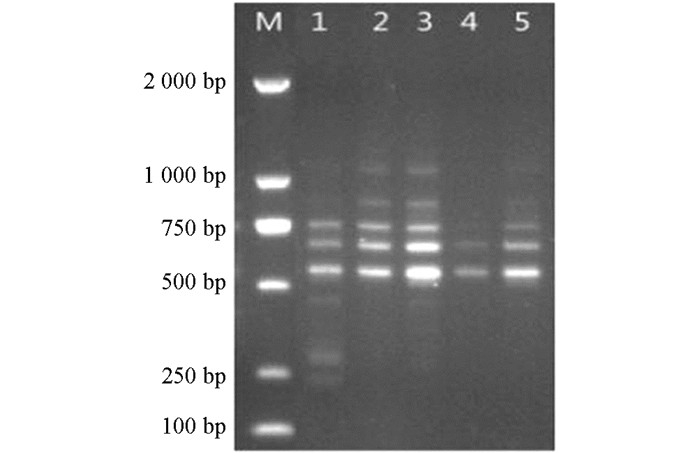
用筛选获得的体系和程序并随机选取引物UBC807和UBC827对21份越桔资源进行ISSR-PCR扩增,结果见图 7.两个引物扩增条带清晰、多态性高,说明该反应体系和程序稳定,适合越桔ISSR反应.
2.1. 基因组DNA的提取
2.2. PCR正交设计直观分析
2.3. 正交设计方差分析
2.4. 不同退火温度对越桔ISSR-PCR反应体系的影响
2.5. 循环次数和延伸时间对越桔ISSR-PCR扩增的影响
2.6. 最佳反应体系和反应程序的验证
-
ISSR作为一种新型分子标记技术,在植物种质资源鉴定、遗传多样性和亲缘关系的研究中已得到较为广泛的应用. ISSR-PCR反应中所用引物来自于简单重复序列区域,引物序列较长,退火温度较高,比RAPD等具有更高稳定性和灵敏性.但PCR扩增易受Tag酶、Mg2+;dNTPs等组分浓度的影响,在对不同植物材料扩增之前应先优化反应体系.本试验以正交设计从复因子试验中挑选部分有代表性的组合进行实验,相对于单因素设计和完全组合设计减少了处理组合,节省时间和财力.直观分析得出最佳浓度与组合7最为接近,并结合方差分析得出最佳反应体系(20 μL):Tag酶0.75 U;Mg2+ 1.875 mmol/L;DNA 0.8 mmol/L;dNTPs 0.1 mmol/L;引物0.2 μmol/L;2 μL 10×buffer (Mg2+ free),不足用超纯水补足.引物UBC835最佳退火温度54.2 ℃,最佳循环次数为35次,最佳延伸时间为60 s.
试验中得出Mg2+和Tag酶浓度对反应影响最大,而dNTPs影响最小,而在其他物种的ISSR体系优化试验中[16-18]发现dNTPs对反应的影响也是较大的,这可能与PCR扩增的不稳定性和打分的主观性有关[19].因此如果能建立更为客观的PCR评价标准将更好的促进体系优化.本研究运用得出的最佳浓度组合对21份越桔资源进行ISSR扩增,取得了理想的效果.因此不同植物在初建立PCR反应体系时,在参照亲缘关系较近物种的反应体系时,应先进行正交设计,对不确定的因素再进行单因素试验,这样能快速建立高效的PCR反应体系.




 下载:
下载: