-
重金属污染具有隐蔽性、滞后性等特点,已成为国家实施可持续发展战略的重要瓶颈[1].相对于其它重金属,Cd极易被植物吸收并在体内富集,对植物的生命代谢活动具有明显的毒害作用,严重时可导致植物死亡[2-3],成为重金属污染治理的首要目标.利用植物修复的方式达到治理土壤重金属污染的目的是近年来重金属污染治理领域理论与实践研究的热点.已有研究结果表明,柳属的某些物种具有较好的Cd耐受和吸附积累能力,是治理和修复Cd污染土壤的潜力物种之一[4-6].
Cd毒害植物的重要机制是引起植物体内活性氧(Reactive oxygen species,ROS)的积累,造成细胞膜脂质过氧化、酶失活、DNA断裂等[7-10],植物体内抗氧化防御系统失衡,造成的氧化伤害与Cd胁迫程度呈正相关关系[11-13].研究表明,植物通过启动体内的一系列功能蛋白,如超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、过氧化物酶(POD)、抗坏血酸-谷胱甘肽循环(AsA-GSH)等,清除体内过多的ROS.重金属富集植物滇苦菜(Picris divaricata V.)[14]、龙葵(Solanum nigrum L.)[15]、东南景天(Sedum alfredii)[16]等体内的抗氧化酶活性在重金属胁迫下都有不同程度的提高.
秋华柳(Salix variegata Franch.)是柳属速生灌木树种,生物量大,自然分布广泛[17].孙晓灿等[18]、贾中民等[19]、刘媛等[20]对秋华柳的Cd富集效应及生理响应的研究表明,秋华柳能耐受水淹和Cd污染并对Cd有良好的富集作用且根系活力不会对秋华柳的植物修复造成阻碍,具备修复Cd污染土壤的潜力.但对于秋华柳的Cd耐受解毒机制尚不明确,值得进一步关注.本研究采用水培的方式,对秋华柳进行Cd梯度质量浓度处理,分析不同Cd质量浓度对秋华柳叶片的氧化胁迫程度及抗氧化酶系统的应对特征,以期进一步了解秋华柳应对Cd胁迫的耐受和解毒机制.
全文HTML
-
2015年3月从重庆市嘉陵江同兴镇河岸(29°41′2″ N,106°26′56″ E)剪取长15~20 cm,茎径0.5~1 cm的秋华柳扦插条,带回实验室先后用自来水、超纯水冲洗干净,固定于胶合板后插入装有1/2 Hoagland改良营养液的水培箱中转至光照培养箱中培养,每盆5株,每3 d更换一次营养液.光照培养箱参数设定为:相对湿度60%,温度25/20 ℃,光照强度10000/0 lx,光照/无光照时间16/8 h.
-
2015年6月,从中挑选生长基本一致的秋华柳扦插苗(萌条长约40 cm)进行试验处理,随机分为5组.以加入CdCl2· 2.5H2O的形式进行Cd质量浓度梯度设置,共5个Cd质量浓度处理水平,分别为0 mg/L(CK),2 mg/L(T1),10 mg/L(T2),20 mg/L(T3),50 mg/L(T4),各处理组分别定义为低质量浓度处理组(T1),中质量浓度处理组(T2),高质量浓度处理组(T3,T4),每个处理4个重复.其中,T1的Cd处理质量浓度接近矿区等重度污染区土壤的Cd质量浓度[21].分别在Cd处理0 d,6 d,12 d和18 d时采集秋华柳叶片,用超纯水冲洗干净,滤纸擦干后密封保存于自封袋中,置于-80 ℃冰箱,待取样全部结束后进行一次性测试.
-
采用硫代巴比妥酸法测定丙二醛(Malondialdehyde,简称MDA)质量分数[22];紫外分光光度法测定过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)活性;氮蓝四唑(NBT)光化还原法测定超氧化物岐化酶(SOD)活性[23].
-
利用SPSS 20.0统计分析软件进行数据统计分析,用单因素方差分析(One-way ANOVA)及重复测量方差分析(Repeated measures)分析不同质量浓度梯度Cd胁迫对秋华柳叶片中MDA质量分数和SOD,CAT,POD,GR,APX酶活性的影响;用Duncan多重比较(Duncan's multiple range test)检验各处理组之间的差异;用相关分析探究不同Cd质量浓度与秋华柳叶片抗氧化酶系统各指标间的相关性.采用Origin 8.5软件作图.
1.1. 试验材料
1.2. 试验设计
1.3. 测定指标与方法
1.4. 数据分析
-
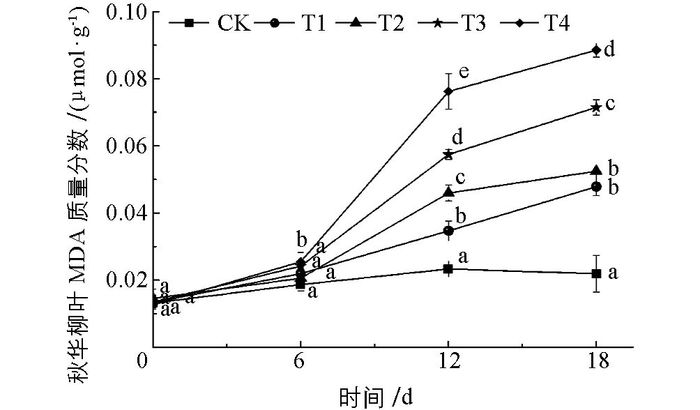
MDA作为膜脂过氧化的产物,是表征细胞是否受到氧化胁迫的重要参数[24].本研究中,秋华柳叶片MDA质量分数与Cd处理质量浓度和胁迫时间呈正相关关系(图 1),随着胁迫时间的延长,秋华柳叶片细胞受氧化胁迫程度逐渐加深.处理6 d时,各处理组间差异无统计学意义(T4除外);处理12 d时,各处理组MDA质量分数显著增加;处理18 d时,MDA质量分数增长减缓,各处理组变化趋势与12 d时相似,但T1,T2处理组间差异无统计学意义.
-
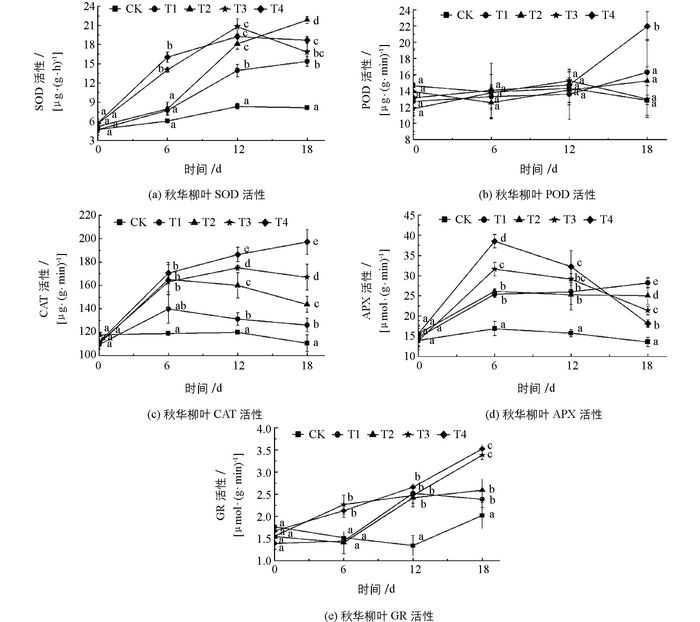
重复测量方差分析结果表明,不同Cd处理质量浓度对秋华柳叶片抗氧化酶活性在时间、质量浓度及时间与质量浓度间的交互效应上均造成了影响(表 1).其中,Cd处理时间、时间与质量浓度交互效应均对POD酶活性产生统计学意义(p<0.01),不同Cd处理质量浓度对POD酶活性存在统计学意义(p<0.05),而秋华柳叶片中SOD,CAT,APX,GR酶活性均受到Cd胁迫在时间、质量浓度及时间与质量浓度间的交互效应三方面的差异有统计学意义(p<0.01).
图 2(a)为秋华柳叶SOD酶活性.随着Cd胁迫时间的延长,秋华柳叶SOD酶活性中低质量浓度处理T1,T2组呈持续上升,高质量浓度处理T3,T4组呈先升后降的趋势.处理6 d时,高质量浓度处理T3,T4组SOD酶活性显著高于CK,T1和T2组,中低质量浓度处理T1,T2组与CK间差异无统计学意义,但酶活性均高于CK.处理12 d时,T3,T4组酶活性达到峰值.处理18 d时,T1,T2组酶活性持续上升,T3,T4组酶活性有所下降,但维持着高活性状态,与对照相比差异有统计学意义.
除18 d时,高质量浓度处理T4组POD酶活性显著高于其它处理组外,随Cd处理质量浓度的增加和时间的延长,与对照相比,秋华柳叶POD酶活性均无统计学意义(图 2(b)).说明在秋华柳叶中POD酶对Cd胁迫不敏感.
随着处理时间的延长,T1,T2,T3组CAT酶活性均呈现先上升后下降的趋势,高质量浓度T4处理组酶活性则持续上升(图 2(c)).处理6 d时,各处理组CAT酶活性出现激增,T2,T3,T4处理组酶活性均显著高于CK组,但T2,T3,T4处理组间差异无统计学意义.处理12 d和18 d时,酶活性大小与Cd胁迫质量浓度呈正相关关系,与对照相比差异有统计学意义.
随着Cd处理时间的延长,高质量浓度处理T3,T4组APX酶活性均呈先增加后降低的趋势,处理18 d时,T3,T4组APX酶活性显著低于T1,T2组;与高质量浓度处理组不同,T1,T2组APX酶活性在Cd胁迫期间则持续上升(图 2(d)).处理12 d时,T4处理组显著高于CK,T1,T2处理组,T1,T2,T3处理组间差异无统计学意义.处理6 d时,高质量浓度T3,T4组APX酶活性达到峰值,显著高于CK,T1,T2组;与对照相比,分别增加1.87,2.28倍.中低质量浓度T1,T2组间差异无统计学意义,但均高于CK组.
如图 2(e)所示,秋华柳叶GR酶活性在处理前期增长缓慢,处理6 d时,仅高质量浓度处理T3,T4组显著高于CK组.处理12 d和18 d时,各处理组酶活性均升高且显著高于对照.处理12 d时,各处理组间酶活性差异无统计学意义.处理18 d时,T3,T4组间,T1,T2组间差异无统计学意义.
-
不同Cd处理质量浓度对秋华柳叶片的氧化胁迫及其抗氧化酶系统各项生理指标的影响程度均不相同,相关性分析结果很好地反映了不同Cd处理质量浓度对秋华柳叶片抗氧化酶系统各指标的影响程度(表 2).
结果表明,在Cd处理6 d时,秋华柳叶MDA质量分数与Cd质量浓度呈显著正相关关系(p<0.05),12 d和18 d时呈极显著正相关关系(p<0.01),说明随着Cd胁迫质量浓度和处理时间的增加,秋华柳叶片细胞膜损伤程度显著增加.
不同质量浓度Cd处理与秋华柳叶片抗氧化酶活性间的相关关系不尽相同.结果显示,POD酶活性与不同Cd处理质量浓度间始终无显著性相关关系,GR酶活性在长时间Cd处理(18 d)下与其呈极显著正相关关系(p<0.01).而SOD,CAT,APX 3种抗氧化酶活性与Cd处理质量浓度间有不同程度的相关关系.处理6 d时,APX酶活性与Cd胁迫质量浓度呈极显著正相关关系(p<0.01),SOD,CAT酶活性呈显著正相关关系(p<0.05);处理12 d时,SOD酶活性与Cd处理质量浓度呈显著正相关关系(p<0.05),CAT,APX酶活性均呈极显著正相关关系(p<0.01);处理18 d时,CAT酶活性与Cd处理质量浓度呈极显著正相关关系(p<0.01),相关系数r高达0.990.
2.1. 不同质量浓度Cd胁迫对秋华柳叶片MDA质量分数的影响
2.2. 不同质量浓度Cd胁迫对秋华柳叶片抗氧化酶活性的影响
2.3. Cd胁迫质量浓度与秋华柳叶片抗氧化酶系统各指标间的相关性分析
-
Cd对植物造成伤害的重要机制之一是引起植物体内活性氧的积累,质膜正常生理功能受损,细胞内稳态失衡[25-26],植物生长受阻,严重时可导致植物死亡. MDA是植物膜脂过氧化的主要产物,质量分数的变化可在一定程度上反映植物体受重金属氧化胁迫的水平[27].本研究结果显示,秋华柳叶片MDA质量分数与Cd胁迫质量浓度间始终呈显著正相关关系.在处理6 d时,秋华柳叶片中MDA质量分数随Cd质量浓度增加而增加,但各处理组之间除高质量浓度T4处理组(50 mg/L)外,秋华柳叶MDA水平与对照相比差异并无统计学意义,说明秋华柳叶片细胞膜没有完全受损,仍具有较好的生理功能,对Cd具有一定的耐性.但随着处理时间的延长,MDA质量分数迅速上升,且随着Cd胁迫质量浓度的增加而显著增加,说明高质量浓度Cd胁迫引起了秋华柳体内活性氧自由基的反应与细胞膜脂质过氧化,Cd与含S或N的基团和蛋白质形成二硫键,从而破坏了细胞膜离子通道结构[28].这与Cd超富集植物滇苦菜[14]、龙葵[15]、东南景天[16]等MDA质量分数对Cd的胁迫响应类似.
重金属进入植物体内诱导产生的大量ROS,若不能被及时清除,会引起一系列对植物体有害的反应.如O2-和H2O2在一定条件下可以通过哈伯·韦斯反应(O2-+H2O2→·OH+OH-+O2)和芬顿反应(Fe2++H2O2→Fe3++OH-+·OH)生成·OH. ·OH可以引起植物体细胞膜受损及细胞质渗漏,导致细胞快速脱水死亡[29].为了减少ROS对植物体造成的损害,植物抗氧化系统是逆境胁迫下抵御不良影响的重要机制,以此清除体内过多的ROS.
SOD是植物抗氧化系统的第一道防线,可将O2-歧化为毒性较弱的H2O2和O2,减轻O2-对植物体的毒害作用,是植物清除O2-的主要酶[30],CAT和POD均有清除H2O2的能力[31].已有研究表明,Cd超富集植物滇苦菜在Cd胁迫下抗氧化酶活性均有所提升,尤其SOD,POD在高质量浓度Cd胁迫下,活性仍显著上升. CAT酶活性虽变化不明显,但仍高于对照组[14].本研究中对秋华柳叶片SOD酶活性与Cd胁迫强度的相关分析结果显示,低质量浓度Cd诱导了秋华柳叶SOD酶活性的升高,而高质量浓度Cd或长时间的Cd胁迫则使SOD酶活性降低[32],SOD酶活性存在一个阈值,既在一定质量浓度Cd处理或处理时间内,酶活性得以提升和维持,超过这个阈值范围,酶活性下降[33].在重金属超富集植物圆锥南芥[34]、短毛蓼[35]、富集生态型龙葵[15]中,SOD酶活性在应对逆境胁迫时也呈现出了相同的响应趋势.这有可能因为SOD酶含有巯基,可与Cd发生络合反应,导致其失去活性,也有可能因为Cd与其金属同工酶的Fe-SOD,Cu/Zn-SOD,Mn-SOD等的金属辅助因子间相互竞争离子通道,从而抑制了金属辅助因子对金属的吸收[36]. SOD酶活性在Cd胁迫下的这种低升高抑效应也有可能是因为高质量浓度的H2O2使Fe-SOD,Cu/Zn-SOD和Mn-SOD失活所致[37].另一方面,秋华柳叶CAT酶活性与Cd处理质量浓度间始终呈显著正相关关系,且随着Cd处理时间的延长,高质量浓度处理组酶活性一直呈上升趋势,中、高质量浓度处理组的酶活性在处理后期有所下降,可能因为Cd干扰了其分子结构或改变了其空间结构[38],但与对照相比仍保持着高活性状态. CAT酶在秋华柳叶中的高活性可能因为CAT酶不直接参与H2O2的分解过程,而是酶的血红素铁先与H2O2反应生成铁过氧化物活性体,CAT酶再将1分子的H2O2氧化,从而完成分解过程[39].而CAT酶和H2O2亲和力较弱,对H2O2的米氏常数Km值较大,因此为了除去低质量浓度的H2O2就需要植物体提供相当高活性的CAT酶才能实现[40].
通常情况下,植物体内过多的H2O2主要由AsA-GSH循环清除,而GSH,GR和APX是AsA-GSH循环的主要参与者[41]. Cd能直接或间接诱导GR酶活性中心的巯基氧化,也可诱导酶蛋白的重新合成[42],进而提高GR酶的活性,GR酶活性的提高可使植物细胞内GSH/GSSG的比值维持在较高的水平,使植物体免受氧化伤害[43].本研究中,相关性分析结果显示,秋华柳APX酶活性与GR酶活性表现出不同的变化特点,APX酶活性对早期的H2O2清除效果较明显,而GR酶主要在H2O2的后期清除中发挥作用.说明在Cd处理前期,GSH及APX酶在Cd解毒中起主要作用,随着胁迫时间的延长,秋华柳体内Cd诱导植物螯合态(Phytochelatins PCs)的合成,作为PCs合成前体的GSH及其衍生物质量分数下降,GR酶开始发挥更重要的作用.同时,含有硫醇的GR酶因硫醇被Cd结合而减少,后期活性也相应受到抑制,因此AsA-GSH循环对H2O2的清除效果因GSH质量分数的减少和GR酶活性的降低而减弱,造成了H2O2在细胞内的大量累积,进而导致膜脂过氧化产物的进一步积累.
在整个试验期间秋华柳叶POD酶活性差异无统计学意义(18 d时,T4除外),说明在秋华柳叶中POD酶对Cd胁迫不敏感,与其它重金属富集植物在Cd胁迫处理下POD酶活性的变化规律不完全一致.这可能与POD酶的双重作用性有关,一方面,POD酶作为细胞抗氧化酶系统的成员之一,表现为POD酶对H2O2的拮抗作用,可在逆境或衰老初期表达,清除体内过多的H2O2;另一方面,POD酶可作为衰老指标,表现为POD酶对H2O2的协同作用,可在逆境或衰老后期表达,参与活性氧的生成、叶绿素的降解,并能引发膜脂过氧化作用[44],具体机制有待进一步研究.
综上认为,Cd胁迫对秋华柳叶片造成氧化胁迫,引起脂质过氧化,致使MDA质量分数升高,且其质量分数与Cd胁迫质量浓度呈显著正相关关系.在氧化胁迫的细胞微环境中,秋华柳叶片的抗氧化酶系统作出应激反应,清除细胞内过多的ROS.不同质量浓度和时间的Cd胁迫下,秋华柳叶片抗氧化酶活性分别表现出不同的变化规律.其中SOD,CAT是2种高活性酶,随着Cd胁迫质量浓度的增加和处理时间的延长始终维持着高活性状态.在氧化胁迫前期,APX具有较高的酶活性,随着Cd胁迫程度的增加,GR酶活性升高,通过AsA-GSH循环清除ROS.而秋华柳叶中POD酶对Cd胁迫不敏感.不同的抗氧化酶活性存在不同的阈值,植物在耐受Cd质量浓度的阈值内,抗氧化酶系统通过活性变化的协同作用,共同应对Cd胁迫.同时也说明抗氧化酶系统对Cd既具有解毒功能,也是Cd毒性的作用位点.



 下载:
下载: