-
STAT5最初是从动物乳腺组织中分离鉴定出来的一种生长因子,发现它与生长激素作用有关,具有特定的生长激素结合序列,并将其命名为MGF因子[1].目前在哺乳动物中发现并已鉴定出的STATs蛋白家族成员共有7个,包括STAT1,STAT2,STAT3,STAT4,STAT5a和STAT5b,STAT6[2-5]等,其中STAT5蛋白由STAT5a和STAT5b基因编码,两者均为胞内信号传导因子,受酪氨酸激酶及受体激活作用,发生磷酸化修饰,可形成同源或异源二聚体,调节靶基因的表达,广泛参与乳腺细胞增殖、分化和凋亡[6-7]. STAT5蛋白具有7个功能结构域,按照结构和功能依次可划分为氨基端结构域(NH2 Domain,ND)[8-9]、卷曲结构(Coiled-coiled Domain,CCD)[10]、DNA结合结构域(DNA binding Domain,DBA)[11-12]、连接结构域(Link Domain)、SH2结构域(Src-homology Domain)[13-14]、转录激活结构域(Transcription Activation Domian,TAD)[15]及羧基端(COOH Domain,CA)[16-17]. STAT5a和STAT5b基因在转录调控功能上的差异主要由其基因调控元件所决定[18-20].
PRL作用下的JAK-STAT5通路对于乳腺生长、发育和泌乳具有重要的作用,STAT5a和STAT5b基因可以在不同类型乳腺细胞中通过内源性表达促进细胞增殖和乳蛋白合成[21-23]. Nelson等[24]分析STAT5a和STAT5b基因在染色体中的位置时发现,STAT5结合位点在基因组中比较广泛,这些碱基序列通常位于基因的内含子区,虽然STAT5a和STAT5b基因具有共同的靶点,但其表达水平不同,两者在启动子区存在较大差异,进而影响靶基因的表达,说明STAT5a和STAT5b蛋白在影响不同类型细胞增殖中的行为并不相同.对奶牛STAT5a基因多态性的研究表明,奶牛乳腺组织中,STAT5a信号通路受催乳素激活和调节,可作为乳蛋白合成的主要通路,STAT5a基因的突变会导致产生3种不同的基因型,即AA/GG/AG基因型,这些基因型和奶牛的产奶性状相关联,直接影响奶牛泌乳量及其品质的改变,由此推断STAT5a似乎是奶牛泌乳能力的标志[25-26].因此,对STAT5a和STAT5b基因表达及调控元件的挖掘分析,可以进一步了解两者在乳腺发育和泌乳过程中的功能.
翟磊等[27]分析了不同泌乳阶段和产奶水平对奶牛淋巴细胞凋亡的影响,但目前尚无关于水牛STAT5基因克隆及其功能的研究报道.本研究以广西本地水牛为研究对象,旨在克隆并分析水牛STAT5a和STAT5b基因启动子序列,通过构建双荧光素酶报告载体,并在水牛乳腺上皮细胞(BMECs)中分析PRL对STAT5a和STAT5b基因启动子活性的影响.研究结果可为进一步研究STAT5a和STAT5b基因在水牛乳腺发育和泌乳过程中的表达及功能奠定基础.
全文HTML
-
水牛乳腺组织取自于广西南宁市鲁班路屠宰场.
-
Trizol试剂购自Invitrogen公司;LA Taq酶,DNA Marker Ⅲ,限制性内切酶Hind Ⅲ、Kpn Ⅰ,T4 DNA Ligation,dNTP,2×GC buffer,Reverse Transcriptase XL(AMV),Oligo dT,pMD18-T载体等均购自大连宝生物公司;DH5α感受态细胞、TransIntroTM EL Transfection Reagent细胞转染试剂盒均购自北京全式金生物科技公司;蛋白酶K、琼脂糖凝胶回收试剂盒、普通质粒提取试剂盒等购自北京天根生物科技公司;Dual Luciferase@Reporter Assay System kit荧光素酶检测试剂盒、pGL3-Basic和pRL-TK质粒购自Promega公司;DMEM、胰蛋白酶、青链霉素、胰岛素、氢化可的松、催乳素、转铁蛋白因子等购自Sigma公司细胞培养级;其他均为国产分析纯试剂.
-
根据NCBI和Ensembl数据库上的牛STAT5a(AJ242522.1)和STAT5b(NM_174617.4)基因序列,利用Oligo 6.0软件分别设计STAT5a和STAT5b基因启动子区特异性引物,在上下游引物序列5′端分别加入Hind Ⅲ和Kpn Ⅰ限制性内切酶位点,引物序列如表 1所示.
-
取0.1 g水牛乳腺组织,通过酚/氯仿抽提的方法提取总DNA,以设计合成的STAT5a和STAT5b基因特异性引物,扩增5段不同长度的启动子片段. PCR反应体系共20 μL:DNA模板1.0 μL、LA Taq 1 μL、2×GC Buffer 10 μL、dNTP 2 μL、上下游引物各0.5 μL、ddH2O 5 μL.采用降落PCR方法扩增,反应程序为4 ℃预变性5 min;94 ℃变性30 s,分别于62 ℃,60 ℃,58 ℃,56 ℃,54 ℃退火30 s,其循环数分别为5 ℃,5,5,10,10,72 ℃延伸0.5~2 min,共35个循环;72 ℃延伸10 min;4 ℃保存. PCR产物经1%琼脂糖凝胶电泳检测分析,并对目的条带胶回收、TA克隆,然后转化大肠杆菌DH5α,挑菌后进行扩大培养;Cracking法快速鉴定重组质粒,然后提取质粒,酶切鉴定并送至上海生工生物公司测序分析.
-
利用UCSC和Ensembl分析克隆得到STAT5a和STAT5b基因启动子区最长序列;Methprimer分析启动子区CpG岛;FirftEF和BDGP分析转录起始位点;TFBIND预测启动子区结合元件.
-
将pMD-18T-P1~P5和pGL3-Basic重组质粒分别用Hind Ⅲ和Kpn Ⅰ进行双酶切,酶切片段经琼脂糖凝胶电泳后回收,用T4 DNA连接酶将启动子片段定向连接入pGL3骨架载体,重组载体命名为P1~P5.转化提取质粒,进行酶切鉴定.
-
转染前1 d将细胞以1×105/mL的密度接种于24孔板,待80%~90%汇合度时进行细胞转染,转染方法参照全式金细胞转染试剂盒说明书进行操作.每组设置3个重复,将P1~P5质粒和内参pRL-Trk质粒分别按照9:1质量比共转染水牛乳腺上皮细胞.在水牛乳腺上皮细胞培养中,分别设置添加5 mg/mL质量浓度的PRL药物处理组和未添加组作为对照. 72 h后收集细胞,按照双荧光素酶法检测试剂盒说明书操作分析启动子活性.
-
使用SPSS 17.0软件的单因素方差分析(ANOVA);所有试验均重复3次以上,p<0.05表示差异具有统计学意义,p>0.05表示差异不具有统计学意义.
1.1. 材料
1.1.1. 组织与细胞来源
1.1.2. 主要试剂
1.2. 方法
1.2.1. 引物设计
1.2.2. 启动子克隆
1.2.3. 启动子生物信息学分析
1.2.4. 启动子荧光素酶报告载体构建及鉴定
1.2.5. 启动子活性检测
1.2.6. 数据分析
-
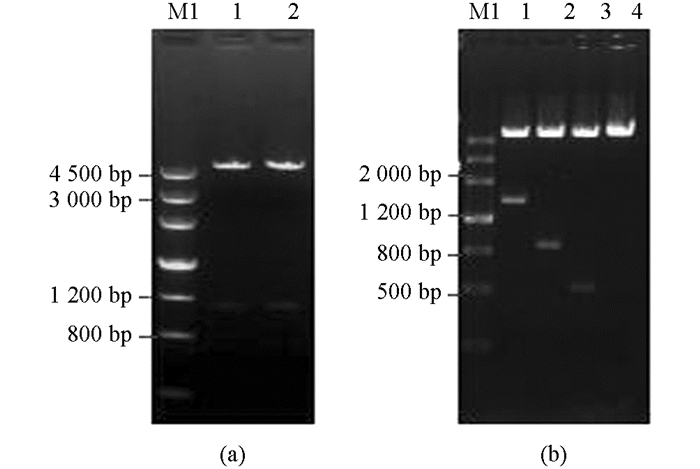
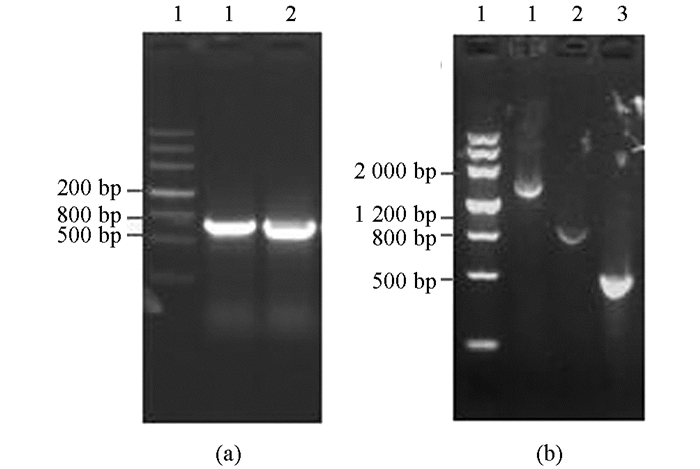
利用Oligo 6.0软件共设计5对特异性引物,以本地水牛乳腺组织DNA为模板,扩增得到的STAT 5a和STAT 5b基因启动子片段大小和预期一致(图 1).将PCR产物纯化后,分别与pMD-18T载体连接,筛选得到阳性重组质粒,命名为pMD-18T-P1,pMD-18T-P2,pMD-18T-P3,pMD-18T-P4和pMD-18T-P5.经测序分析,水牛STAT 5a基因启动子片段大小分别为500 bp和700 bp,STAT5b基因启动子片段大小分别为500 bp,800 bp和1 500 bp.
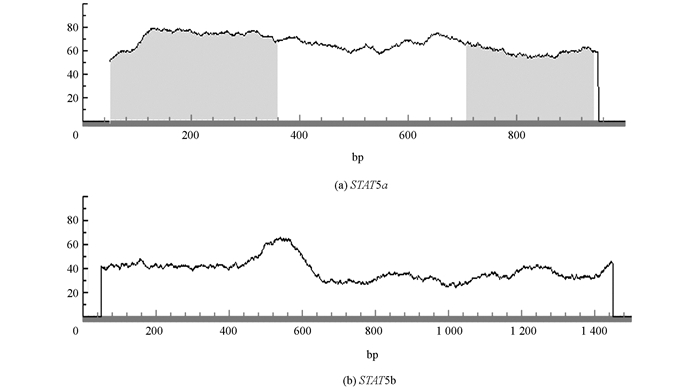
利用启动子分析软件在线分析STAT5a和STAT5b基因启动子区CpG岛情况,分析标准为Window>100 bp,GC%>50%,Obs/Exp>0.8.结果显示,STAT5a基因启动子序列存在2个CpG岛,STAT5b基因启动子序列不存在CpG岛(图 2).转录因子预测结果发现,STAT5a基因启动子区转录因子以SP1,AP1等为主,STAT5b基因则包含CREB,AP1等主要的转录因子结合位点(表 2).
-
将测序验证正确的pMD-18T-P1,pMD-18T-P2,pMD-18T-P3,pMD-18T-P4,pMD-18T-P5和pGL3-basic重组质粒分别用Hind Ⅲ和Kpn Ⅰ双酶切,T4连接后分别得到pGL3-STAT5a-promoter(P1和P2),pGL3-STAT5b-promoter(P3,P4和P5)重组质粒.酶切鉴定重组质粒,均得到1条预期大小DNA片段(图 3),测序验证亦证明构建正确.
-
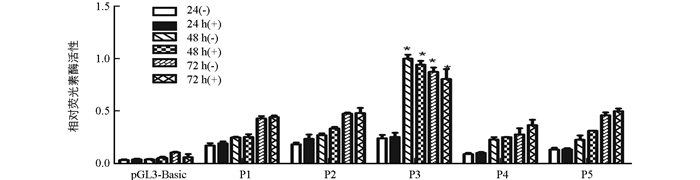
将含启动子的双荧光素酶报告质粒P1~P5分别与内参pRL-TK质粒共转染BMECs细胞,转染48 h后检测双荧光素酶表达水平,并计算荧光素酶比值.结果显示,在BMECs细胞系中,与对照组相比添加5 mg/mL质量浓度PRL处理乳腺上皮细胞时,P3质粒转染组荧光素酶比值显著高于其他各组(p<0.05);随着PRL激素处理时间延长,各组荧光素酶比值明显提高,说明PRL可以促进STAT5a和STAT5b启动子活性(图 4).
2.1. 水牛STAT5a和STAT5b基因启动子的克隆与分析
2.2. 双荧光素酶报告基因载体构建
2.3. 水牛STAT5a和STAT5b基因启动子活性分析
-
STAT5a和STAT5b基因在不同物种的各组织中广泛表达,受到生长激素(GH)、催乳素及红细胞生成素(EPO)等与细胞生长和增殖功能密切相关的激素或细胞因子调节,参与了细胞增殖、分化和凋亡,在免疫、癌症、乳腺发育等过程中均发挥重要的作用[7, 28-30].研究发现,STAT5蛋白由STAT5a和STAT5b基因分别转录翻译而来,在小鼠中两者均定位在11号染色体上,其氨基酸序列相似性达到96%[31]. STAT5基因在体内受PRL作用,参与了乳腺发育和泌乳过程,但目前对其在水牛乳腺发育和泌乳中的功能尚无报道.本试验首次克隆并分析了水牛STAT5a和STAT5b基因启动子区序列,为进一步研究水牛PRL诱导下的STAT5a和STAT5b基因在水牛乳腺发育和泌乳中的功能奠定基础.
2002年,Ambrosio等[32]克隆人STAT5基因时发现,STAT5a和STAT5b基因主要差异位于非编码区,并且进一步确定了STAT5a基因启动子区CpG岛所占碱基比率为23.2%,STAT5b基因启动子区CpG岛占碱基比率为30.2%,同时发现GH作用下STAT5a和STAT5b基因启动子活性不同.本试验以水牛乳腺基因组DNA为模板,克隆得到了水牛STAT5a和STAT5b基因5′端非编码区序列,采用生物信息学方法分析发现,水牛STAT5a基因转录起始位点附近具有多个高甲基化位点.启动子区预测结果显示,水牛STAT5a基因存在2个CpG岛,水牛STAT5b基因5′端调控区域内未发现CpG岛.此外,在水牛STAT5a和STAT5b基因启动子区内,我们不仅发现了典型的启动子元件如TATA box,CAAT box等,同时也发现一些转录因子及Cis元件. STAT5a基因启动子区以SP1,AP1等转录因子结合位点为主,STAT5b基因则包含CREB,AP1等主要的转录因子结合位点.以上结果说明克隆得到的水牛STAT5a和STAT5b基因启动子区序列是正确的,并且进一步发现STAT5a和STAT5b基因启动子上转录因子结合位点和甲基化位点存在差异,提示两者在基因表达和调控机制上的功能可能不同.
在动物乳腺中已有发现,STAT5a和STAT5b基因启动子上确实存在甲基化修饰,因此STAT5a和STAT5b受到特定的转录因子调节影响两者启动子活性,并且和乳腺泌乳过程密切相关. 2013年,郑宜文等[33]发现奶牛STAT5a基因启动子区上游-689~0 bp存在一个CpG岛,包含P300和SP1等多个转录因子的结合位点,泌乳期STAT5a基因甲基化水平低于妊娠期. 2015年,吴贤锋等[34]研究发现山羊STAT5a基因存在DNA甲基化CpG岛,STAT5a基因表达受PRL激素调节,在泌乳期甲基化水平变化与产奶量显著相关.本试验构建了水牛STAT5a和STAT5b基因启动子的双荧光素酶报告载体,在水牛乳腺上皮细胞中验证启动子活性,结果发现各启动子片段均有启动活性.在水牛乳腺上皮细胞中,STAT5a和STAT5b基因启动子活性受到PRL作用持续增强,有趣的是STAT5b基因500 bp长度启动子活性最高(p<0.05). Crispi等[35]对HeLa,HepG2和Jurkat等3种细胞系的研究发现,STAT5a基因(-430~+244,-430~+1 075,-2 119~+244)各长度启动子均比STAT5b基因(+100~+1 739,-1 690~+236)启动子活性相对要高,且甲基化程度低的STAT5a基因启动子活性明显高于STAT5b基因.我们在水牛乳腺上皮细胞中发现了STAT5a和STAT5b基因启动子活性受PRL影响,首次发现STAT5b启动子活性明显高于STAT5a,在PRL作用下STAT5a和STAT5b基因通过启动子区的甲基化修饰阻止特定转录因子结合,DNA甲基化修饰可能是影响水牛STAT5a和STAT5b基因启动子表达的重要因素之一,这一推测还有待进行进一步验证.
-
本试验克隆并分析了水牛STAT5a和STAT5b基因启动子区片段,并分析了PRL对两者启动子转录活性的影响.研究结果发现水牛STAT5a和STAT5b基因启动子区甲基化位点和转录元件存在差异,仅在STAT5a基因启动子区存在高甲基化位点;PRL可以增强水牛STAT5a和STAT5b基因启动子在乳腺上皮细胞中的活性.



 下载:
下载: