-
超低温保存是在液氮(-196 ℃)或液氮蒸汽相(-150~-180 ℃)的超低温条件下保存生物材料,被保存材料的物质代谢几乎停止,处于“生机停顿”或“假死”状态.经超低温保存后,处于“假死”的植物材料能保持正常的细胞活性、形态发生潜能和遗传稳定性,理论上可以永久保存种质资源[1-2].
植物的基因型、繁殖特性、抗性不同,适宜进行超低温保存的材料类型也有所不同.目前成功进行超低温保存的材料类型有种子、休眠芽、茎段[3]、茎尖分生组织、花粉、合子胚、体细胞胚、悬浮细胞、愈伤组织、原生质体及幼苗[4].幼苗代谢活动旺盛,含水量较高,对胁迫响应敏感,所以较难进行超低温保存,研究报道也很少[5].但是,幼苗的超低温保存可以很好地揭示超低温保存过程中的代谢活动、胁迫响应和信号转导[6-8],对于促进超低温保存的机理研究有重要意义.
羽状鸡冠花(Celosia plumose Burv.)为苋科青葙属植物,适应性强,常采用种子繁殖,广泛应用于园林绿化,作花坛或盆花栽植,近年来其切花需求量也连续攀升.羽状鸡冠花色彩艳丽、品种繁多,有效保存栽培品种和野生近缘种的种质资源对于鸡冠花品种的国产化至关重要.本试验以羽状鸡冠花无菌幼苗为材料,研究超低温保存方法,以期为其种质资源保存提供技术支持.
全文HTML
-
供试材料为羽状鸡冠花品种‘新视野’(Celosia plumosa ‘Fresh Look’).种子购买于北京林业大学林业科技股份有限公司.种子用自来水冲洗3~4次,滤干后置于超净工作台上,用75%酒精消毒30 s,2% NaClO消毒4 min,无菌水冲洗6次,吸干表面水分,播种于MS固体培养基中培养.培养温度(23±2) ℃,空气湿度60%~80%,光照强度40 μmol/(m2·s),14 h/d.种子萌发48~60 h后,取胚根长2~3 mm的无菌幼苗进行玻璃化超低温保存试验.
-
无菌幼苗的玻璃化超低温保存参照Liu等[5]和任丽[8]的方法.对装载、脱水处理和去装载时间3个影响因子设3水平,L9(34)正交设计见表 1.每个处理30株幼苗,重复3次.
具体步骤为:①装载(Loading溶液处理):在超净工作台上,将幼苗用镊子从MS基本培养基上取出,放入2 mL冷冻管中,加入2 mL Loading溶液(MS液体培养基+2 mol/L丙三醇+0.4 mol/L蔗糖,pH=5.7)室温处理20,40,60 min;② PVS2脱水:将loading溶液换成预冷(0 ℃)的PVS2溶液(MS液体培养基+30%丙三醇+15%乙二醇+15%二甲基亚砜+0.4 mol/L蔗糖,pH=5.7)0 ℃下处理20,40,60 min;③冷冻:吸出冻存管中的PVS2溶液,再加入PVS2溶液0.5 mL,迅速投入液氮,保存24 h;④解冻:从液氮中取出冷冻管,在40℃水浴锅中快速解冻60 s,并不断晃动. ⑤去装载(Unloading处理):用unloading溶液(PVS3溶液=1.2 mol/L蔗糖+MS液体培养基,pH=5.7)洗涤20,40,60 min,每10 min换一次洗涤液;⑥恢复培养:用无菌滤纸吸干洗涤液,将冻存后的幼苗接种到MS固体培养基上,暗培养7 d后转入光照培养(条件同种子萌发). 1周后统计存活率.幼苗存活以观察到幼苗有明显生长为准.
将浓度为100,200,400 U/mL的外源抗氧化酶CAT(过氧化氢酶,Sigma公司)和浓度为0.1,0.2,0.4 mmol/L的外源非酶抗氧化剂ASA(抗坏血酸,北京欣经科生物技术有限公司)分别导入超低温保存程序中的装载、PVS2处理和去装载过程,以不导入抗氧化剂为对照,统计超低温保存后的存活率,研究外源抗氧化剂在超低温保存中的作用.每个处理30株幼苗,重复3次.
-
无菌幼苗存活率以氯化三苯基四氮唑(TTC)法测得的存活率和恢复培养15 d后的再生率表示.
TTC法:取去装载后幼苗15株,加入0.4%TTC:0.05 mol/L磷酸缓冲液=1:1(V:V)的混合液,40 ℃水浴避光静置3 h,取出,置于滤纸上,观察幼苗染色情况.幼苗主要结构完整并染成有光泽的鲜红色,为有生活力的幼苗;幼苗的主要结构缺失、不染色或染成无光泽的淡红色、灰白色或其它异常颜色,为无生活力幼苗.每个处理重复3次.
式中:x为存活率;y为再生率;a1为有生活力幼苗数;a2为存活幼苗数;b为冻存幼苗总数.
采用Microsoft Excel 2010进行数据处理,SPSS Statistics 18.0软件进行方差分析和多重比较(Duncan新复极差法),显著水平p<0.05.
1.1. 试验材料
1.2. 试验方法
1.3. 指标测定与数据分析
-
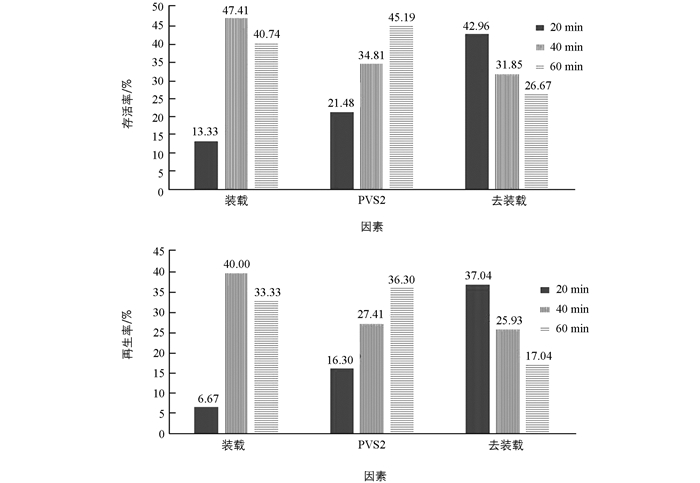
装载时间、PVS2处理时间及去装载处理时间对羽状鸡冠花无菌幼苗存活率的影响见表 2.
表 2结果表明,羽状鸡冠花无菌幼苗超低温保存存活率最高试验号为6,冻存后的TTC法检测存活率为66.67%,再生率为57.78%.极差分析结果表明,3个因素对羽状鸡冠花无菌幼苗超低温保存均有较大影响.
方差分析结果(表 3)表明,鸡冠花无菌幼苗超低温保存受到装载时间、PVS2溶液处理时间和去装载处理时间3个因素的显著影响,其中装载时间影响最大.实际恢复生长的再生率结果显示,去装载处理时间与PVS2处理时间对超低温保存后存活率的影响近乎没有差异.
对各因素水平幼苗存活率及再生率均值(图 1)进行比较,结合上述分析可知,羽状鸡冠花幼苗玻璃化超低温保存主要因素的最佳水平为:装载时间为40 min,PVS2溶液处理时间为60 min,去装载处理时间为20 min.本试验中的处理6恰为最佳水平组合,试验结果确实最佳(表 2).
采用本超低温保存程序进行检验,冻存后幼苗的存活率为66.67%,再生率为62.22%,与原处理6没有显著差异,表明本超低温保存方法重复性好.
-
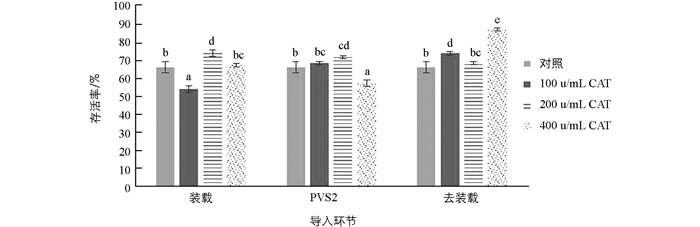
外源抗氧化剂CAT有助于提高春石斛类原球茎[9]、百子莲胚性愈伤组织[10]的超低温保存效果.本试验导入外源CAT后,无菌幼苗冻后的存活率见图 2.
结果表明,在超低温保存的3个主要环节导入CAT普遍可提高无菌幼苗存活率,但浓度不同效果不同.装载和PVS2处理环节导入200 U/mLCAT效果最佳,无菌幼苗存活率分别比对照显著提高7.78%和5.55%;去装载环节导入400 U/mL CAT效果最佳,无菌幼苗存活率高达87.78%,比对照提高21.11%.以最佳导入条件,即在“新视野”羽状鸡冠花无菌幼苗超低温保存的去装载环节导入浓度为400 U/mL外源CAT,对其进行实际恢复生长试验,冻存后再生率为83.33±1.57%.
-
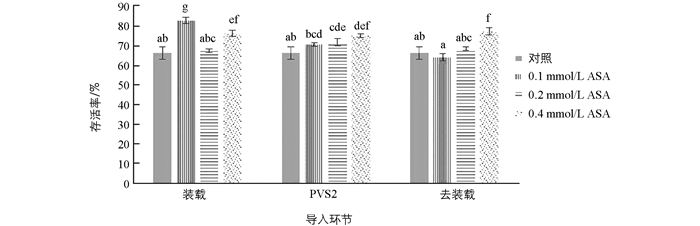
外源抗氧化剂ASA有助于拟南芥无菌幼苗[8]、春石斛类原球茎[9]和美洲榆茎尖[11]的超低温保存.本试验导入外源ASA后,无菌幼苗的冻后存活率见图 3.结果表明,在不同环节导入ASA总体上可提高幼苗存活率,具体效果与导入浓度有关.在装载环节,导入0.1 mmol/L ASA效果最好,幼苗存活率比对照显著提高16.66%;在PVS2处理和去装载环节导入0.4 mmol/L ASA效果最好,使幼苗存活率显著提高的幅度最大.
2.1. 羽状鸡冠花无菌幼苗玻璃化超低温保存程序的建立
2.2. 外源抗氧化剂在超低温保存中对羽状鸡冠花无菌幼苗存活率的影响
2.2.1. 外源CAT导入对鸡冠花无菌幼苗冻后存活率的影响
2.2.2. 外源ASA导入对羽状鸡冠花无菌幼苗冻后存活率的影响
-
试验表明,羽状鸡冠花无菌幼苗可采用如下程序进行超低温保存:种子无菌萌发48~60 h后,取胚根长2~3 mm的无菌幼苗,25 ℃下用loading溶液装载40 min,0 ℃下用PVS2溶液处理60 min,更新PVS2溶液,投入液氮,冻存24 h以上;取出,40 ℃水浴化冻60 s,去装载处理20 min;再生培养.在此条件下,幼苗再生率可达60%以上.装载时导入0.1 mmol/L ASA,卸载时导入400 U/mL CAT均可提高幼苗存活率.
超低温保存的基本程序为:材料选择与准备→预处理→降温冷冻→化冻→存活鉴定.材料对保存效果影响很大.研究表明,适宜大小(多为2~3 mm)的植物材料有利于提高超低温保存后的存活率[12-13].刘燕[14]发现,拟南芥种子和萌发1~2 d的幼苗均能进行玻璃化法超低温保存,但萌发3 d的幼苗超低温保存后不能成活.任丽[8]发现,拟南芥的苗龄与恢复生长率存在显著负相关,并确定时间拐点为58.74 h,但幼苗的生长可能出现速度的快慢差异.因此,本试验根据文献及预实验结果选取萌发48~60 h、胚根长度在2~3 mm的无菌幼苗为材料进行超低温保存,获得了62.22%的再生率.
目前已有近千种植物成功实现了超低温保存,但仍有部分种质冻后无法成活或存活率较低,添加一定的外源物质有利于提高超低温保存恢复生长率.如何从众多可添加的外源物质中筛选出效果较好的,是保存体系优化的关键点.在超低温保存众多的损伤学说中,氧化损伤被证明是影响超低温保存效果的重要原因之一[15-18].超低温保存过程中,ROS过量产生时,细胞处于生理应激状态,自身的抗氧化系统如SOD、CAT、POD等酶类以及ASA、GSH等非酶类会协同作用抵抗ROS可能带来的伤害,但当细胞抗氧化能力不足以清除过量ROS时,就会阻碍细胞正常的生理进程,导致持久伤害[19].使用外源抗氧化剂以提高超低温保存效果得到了一定的发展和应用[20].酶类抗氧化剂如CAT[8-9, 21]、SOD[20]、谷胱甘肽过氧化物酶[20]等在动物精子和植物超低温保存中被证明可减少氧化应激的发生,提高材料的冻存存活率.非酶类抗氧化剂如PVP[22]、外源抗坏血酸[8-9]、谷胱甘肽[20]、褪黑素、甜菜碱和维生素E等均有效提高了多种植物材料冻后存活率和再生率[20].本试验结果也显示,外源抗氧化剂CAT和ASA可显著提高羽状鸡冠花无菌幼苗冻后的存活率,这与狄玮[9]、Uchendu等[23]的研究结果相似.在本试验中,超低温保存过程中幼苗细胞内ROS及其清除系统的相互作用值得进一步研究.



 下载:
下载: