-
大黄鱼(Pseduosciaena croeca),隶属于硬骨鱼纲,鲈形目,石首鱼科,黄鱼属,又名黄鱼、大黄花鱼、桂花黄鱼、石首鱼、黄瓜鱼等,为传统“四大海产”(大黄鱼、小黄鱼、带鱼、乌贼)之一,是我国近海主要经济鱼类[1].大黄鱼肉质细嫩鲜美、高蛋白、低胆固醇,富含EPA,DHA等高度不饱和脂肪酸,可供鲜食或制成黄鱼鲞等.
随着育苗技术和养殖技术不断成熟,养殖大黄鱼的产量逐年增加,2016年中国大黄鱼养殖总量已达到16.55万t,是我国海水鱼类养殖产量最高的鱼类,其中福建省是大黄鱼主要养殖大省,2016年年产量达到14.65万t[2].
大黄鱼的主要产地集中在福建宁德,在国内运输鲜活鱼的成本较高,且近几年由于产量不断攀升,以及出口量和国内需求量减少,导致大黄鱼价格低位运行时间较长. 2017年宁德大黄鱼规格400~450 g的价格为26.4~26.8元/kg,相比于前两年的价格有走低的趋势,在2016年曾经达到过58~60元/kg.因此,将其加工成鱼糜制品可以有效地增加大黄鱼的附加值,解决大黄鱼量多价廉的问题.
鱼糜制品具有较高的营养价值、独特的凝胶特性,且食用方便,有益健康,有着广阔的市场空间[3-5].凝胶强度是衡量鱼糜制品品质的重要指标之一.鱼糜的形成通常经历3个阶段:凝胶化、凝胶劣化和鱼糕化,其中凝胶化温度对鱼糜制品的凝胶强度有着至关重要的作用.因此,如何选择合适的凝胶化温度来提高鱼糜凝胶的形成能力,已成为高效利用大黄鱼生产鱼糜制品的关键.
目前,已有专家研究超高压对大黄鱼鱼糜凝胶性质的影响[6],但还未有涉及温度对其凝胶特性影响的相关报道.因此,本实验以大黄鱼为原料,在不同的凝胶化温度条件下加热形成鱼糜,研究温度对其综合性质和凝胶形成特性的影响,为制备高品质的大黄鱼鱼糜制品提供基础实验数据.
全文HTML
-
大黄鱼收购于宁德海域海水养殖网箱中,生长期为18~24个月,400~500 g/尾.
Lowry试剂盒 美国Bio-Rad公司;十二烷基磺酸钠(SDS)、丙烯酰胺美国Bio-Rad公司;标准蛋白美国Termo Fisher公司.
-
UV-8000A型紫外分光光度计 上海元析仪器有限公司;S-4800扫描电子显微镜 日立高新技术公司;Q-2000差示扫描量热仪 美国TA公司;WSC-S测色色差计 上海精密科学仪器有限公司;TA-XT Plus质构仪 英国Stable Micro System公司.
-
大黄鱼鱼糜制备参考Weng[7]报道的方法.新鲜大黄鱼经去头、去内脏,用冰水漂洗去除血污和黑膜后,利用采肉机进行采肉.获得的鱼肉按质量与冰水体积为1:3(W/V)的比例漂洗3次,每次15 min,漂洗后的鱼肉用4层纱布沥干后,利用脱水机进行脱水,最后在获得的鱼糜中加入4%蔗糖、4%山梨醇和0.2%焦磷酸钠抗冻剂,分装到自封袋中,放置在-30 ℃冰箱中供以下实验.经测定,制备的鱼糜中水分百分比为77.39%,蛋白质百分比为11.59%.
-
参考张瑞婷等[8]报道的方法,将4 ℃下解冻的冷冻鱼糜于冰冷条件下空擂10 min,加入鱼糜质量3%的NaCl擂溃10 min,加入冰的蒸馏水调整水分百分比至80%继续擂溃15 min,然后将擂溃好的鱼浆装入不锈钢容器(Φ30×30 mm)中,在不同温度(35 ℃,40 ℃,45 ℃,50 ℃)下保温1 h制备成凝胶化的鱼糜,再将凝胶化的鱼糜于90 ℃下继续水浴15 min,然后用碎冰迅速冷却30 min,放在4 ℃冰箱中存放12 h后供实验使用.
-
参考翁武银等[9]报道的方法,利用质构仪在室温条件下采用球形探头(Φ5 mm)以30 mm/min的测试速度、20 mm的穿刺距离测定鱼糜凝胶的凝胶强度.
-
参考Weng[7]报道的方法利用质构仪在室温下进行鱼糜凝胶质地剖面分析(TPA),采用直径为38 mm的圆柱形探头,测试速度为60 mm/min,压缩变形量为30%,感应力最大为50 N.
-
鱼糜凝胶持水力(WHC)参考Uresti等[10]的方法.精确称取3 g块状鱼糜凝胶,然后用2张滤纸包裹,放入干燥的离心管中,在4 ℃条件下,经过2 000 r/min离心10 min后,测定离心前后鱼糜凝胶的质量,鱼糜凝胶持水力(WCH)按照下式进行计算:
式中,W1为离心前鱼糜凝胶的质量(g);W2为离心后鱼糜凝胶的质量(g).
-
用色差计测定鱼糜凝胶的色泽,测试前仪器用标准白板进行校正,标准白板的参数:L*为91.86,a*为-0.88,b*为1.42. L*表示样品的明度;a*代表红绿方向的值,b*代表黄蓝方向的值.
-
SDS-PAGE采用Laemmli[11]的方法.其中浓缩胶百分比为4%,分离胶百分比为6%,在10 mA电流下电泳后,先用考马斯亮蓝R-250染色液染色,再用脱色液(甲醇-乙酸-水体积比30:10:60)脱色至背景完全透明为止.其中,蛋白凝胶先利用蛋白变性可溶性液(8 mol/L尿素-2%SDS-20 Mm/L Tris-HCl,pH=8.8)溶解,再将溶出的蛋白配成蛋白质量浓度为1 mg/L的电泳样品.
-
参考Weng[7]报道的扫描电镜样品处理方法,将鱼糜凝胶切成3 mm×3 mm×2 mm的块状,用2.5%的戊二醛(pH=7.2)固定24 h后,再用0.1 mol/L (pH=7.2)的磷酸盐缓冲液清洗3次,然后用乙醇溶液进行梯度脱水,经CO2临界点干燥仪干燥,E-1010离子溅射仪镀金后,用扫描电子显微镜(SEM)观察微观结构,电子术的加速电压为5 kV.
-
利用差示扫描量热仪(DSC)测定不同凝胶化大黄鱼鱼糜凝胶的热转变温度.准确称取5~10 mg样品置于铝坩埚中并密封,以空坩埚作为参比,扫描温度范围为(5~150) ℃,升温速率为5 ℃/min.
-
鱼糜凝胶蛋白制品通过冷冻干燥获得的粉末与KBr按质量1:100混合,用玛瑙研钵研磨均匀,压片机压片后,使用傅立叶变换红外光谱仪扫描,扫描波速范围4 000~1 000 cm-1.
-
数据采用SPSS Statistics 17.0软件进行单因素方差分析,显著性检测方法为Duncan多重检验,检测限为0.05.
1.1. 材料与试剂
1.2. 仪器和设备
1.3. 方法
1.3.1. 鱼糜的制备
1.3.2. 鱼糜凝胶的制备
1.3.3. 鱼糜凝胶强度的测定
1.3.4. 鱼糜凝胶质构的测定
1.3.5. 鱼糜凝胶持水力的测定
1.3.6. 鱼糜凝胶白度的测定
1.3.7. SDS-PAGE凝胶电泳
1.3.8. 鱼糜凝胶微观结构(SEM)的分析
1.3.9. 差示扫描量热分析
1.3.10. 鱼糜凝胶蛋白的傅立叶红外变换光谱(FTIR)分析
1.3.11. 统计分析
-
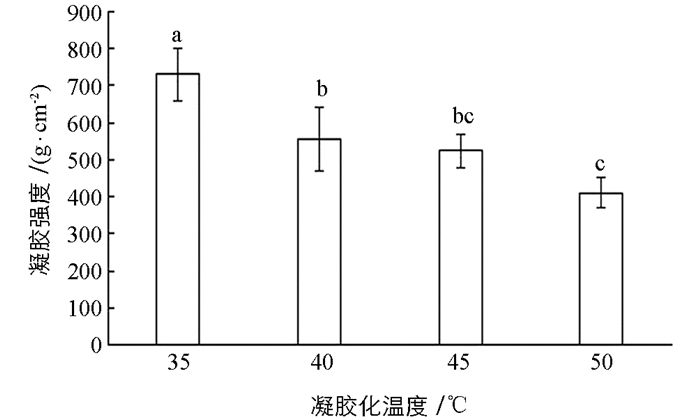
凝胶强度是评价鱼糜凝胶优劣的一个关键指标,不同的凝胶化温度对鱼糜凝胶强度有显著的影响.如图 1所示,当凝胶化温度为35 ℃时,鱼糜制品的凝胶强度高达787.26 g/cm2,但随着温度上升出现减小的趋势,在凝胶化温度为50 ℃时,鱼糜的凝胶强度最小,为410.22 g/cm2.鱼肉中加入一定量食盐后,经过擂溃工艺,鱼肉会形成肉糊状的鱼浆,此种肉糊为肌动球蛋白溶胶,它非常容易凝胶化,可以快速失去其塑性转变为富有弹性的鱼糜.从肉糊到弹性的鱼糜经历了2个过程,一是鱼肉在经过50 ℃以下的温度带时,会发生鱼糜凝胶结构的形成反应,另一个则是在60 ℃附近温度带发生凝胶结构的崩坏的劣化反应[12].出现上述结果的原因可能是鱼糜在水浴加热过程中从溶胶变为凝胶,肌原纤维蛋白分子内的疏水基团暴露,分子间相互作用形成网状结构,但随着水浴温度增加,内源性蛋白水解酶会逐渐活跃,破坏鱼糜凝胶结构,降低鱼糜凝胶强度[13].另外,XU等[14]曾提到,凝胶化温度较低时蛋白质变性和聚集的速率也较慢,从而使蛋白质之间有足够的时间进行有序的相互作用,可形成高强度的凝胶.因此,有可能是在35 ℃的凝胶化温度条件下,肌原纤维蛋白的变性速度较慢,可以更充分地形成凝胶网络结构,所以在此温度下其凝胶强度最大;但随着温度升高,鱼糜凝胶出现凝胶劣化现象,可能由于肌肉组织中存在的蛋白酶(组织蛋白酶或者丝氨酸蛋白酶)降解肌原纤维蛋白所致[15-16].
-
肌原纤维蛋白在加热后形成凝胶,对肉制品的质地和保水性有着重要的作用[17-18].鱼糜凝胶化是鱼肉中肌动球蛋白在被加热的过程中高级结构发生了松散并且在分子之间产生了三维架桥,形成了更为复杂的网状结构,进而由于热力作用,使得形成的三维网状的网目中的自由水被封锁,不能自由地流动,因此形成了鱼糜这种极具弹性的特殊凝胶状物[19].肉的持水性是在外力作用下,如加压、加热等加工或者贮藏条件下肌肉保持原有水分与添加水分的能力,其大小直接关系着肉制品的风味、色泽、质地等,是评价肉制品食用品质的重要指标之一[20],并在一定程度上反映凝胶中水分子与蛋白质分子的结合状况及凝胶的强弱[21].
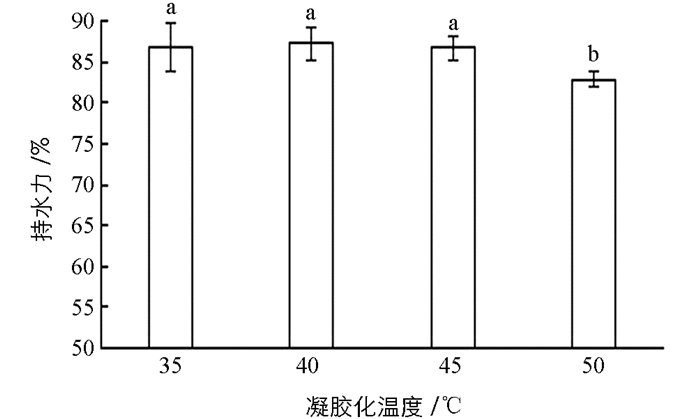
由图 2可知,当凝胶化温度为50 ℃时,鱼糜的保水性为82%,相比于其他3个温度的保水性较差,且与其他3个水平的组间差异具有统计学意义(p<0.05),而(35~45) ℃之间不具有统计学意义(p>0.05),说明在(35~45) ℃的凝胶化温度范围内,大黄鱼肌原纤维蛋白的保水性较好.原因可能是在(35~45) ℃之间,胶原纤维蛋白发生变性,当升到50 ℃时持水性却降低,可能是因为随着温度升高肌球蛋白开始聚集形成寡聚体,寡聚体之间通过相互作用形成复杂的空间网络结构并束缚一定量的水分,当温度继续升高,已形成的凝胶网络结构破坏并释放束缚的水分,从而导致凝胶保水能力下降[22].
-
鱼糜凝胶是一种固体与液体之间的中间相,温度对其质构有着重要的影响,质构参数中的硬度主要用来表示鱼糜凝胶崩溃需要的咬劲或捏劲[9];聚集性是表示鱼糜凝胶经第1次压缩变形后所表现出来的对第2次压缩的相对抵抗能力,反映鱼糜凝胶蛋白内部结合程度,是凝胶网络结构变化的体现[23];弹性数值代表其在外力作用下,鱼糜凝胶恢复到原本形态的能力;粘结性和咀嚼性则是鱼糜凝胶硬度值的补充参数[24].
对不同凝胶化温度下的大黄鱼鱼糜进行质构测定,结果如表 1所示.在(35~50) ℃的温度范围内,鱼糜凝胶的硬度、聚集性、粘结性、弹性和咀嚼性随鱼糜凝胶化温度的升高而降低,其中35 ℃鱼糜凝胶的硬度、聚集性、粘结性和咀嚼性显著高于50 ℃,这是因为35 ℃时肌动蛋白和肌球蛋白等内部各亚基充分暴露,蛋白亚基之间重新相互作用形成蛋白凝胶的网络结构,而随着凝胶化温度升高,大黄鱼鱼糜凝胶的肌原纤维蛋白由于高温作用未能在变性后相互之间充分聚合形成三维的蛋白网络所致,鱼糜凝胶的硬度、聚集性、咀嚼性和粘结性则有所下降,这与大黄鱼鱼糜凝胶强度的结果相吻合.但从弹性实验结果来看,凝胶化温度对鱼糜凝胶的弹性无显著影响.
TPA数据说明,鱼糜在加热过程中慢慢通过35 ℃到40 ℃的凝胶化温度带,并迅速通过凝胶劣化温度带,可以得到凝胶性能很好的优质鱼糜,相反则所获得的产品较差.由此可见,鱼肉在加热过程中即使最终到达的温度点相同,但如何到达最终温度点的过程不相同,鱼糜的品质也大相径庭,这也是鱼糜凝胶性能的重要特征[25-26].
-
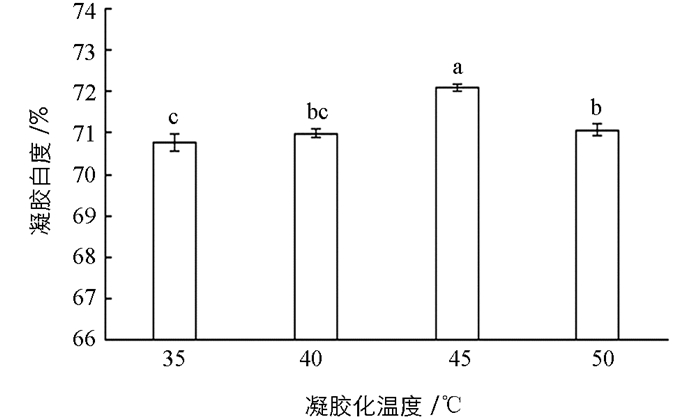
鱼糜制品的色泽是影响消费者对其感官评定的重要因素之一,在不同凝胶化温度条件下大黄鱼鱼糜的白度如图 3所示.由图 3可知,随着温度上升,鱼糜白度显著增大,在45 ℃时达到最大,为72.09,而后逐渐降低. Hwang等[27]指出鱼糜凝胶的白度变化与蛋白变性程度相关联,当凝胶化温度处于(35~45) ℃时,其变性程度明显小于凝胶化温度为50 ℃以上的鱼糜凝胶.从实验结果来看,鱼糜凝胶的白度随着凝胶化温度升高呈现出先增大后减小的趋势,在45 ℃明显高于其他3个温度时的白度,说明在此凝胶化温度下鱼糜凝胶蛋白的变性程度对于鱼糜的白度最为适宜,这也验证了Hwang等[27]关于白度与凝胶蛋白变性程度相关联的观点.其次,从感官评定也可以发现鱼糜颜色的变化,随着凝胶化温度升高,鱼糜颜色逐渐变白,而后慢慢变为灰白色.
-
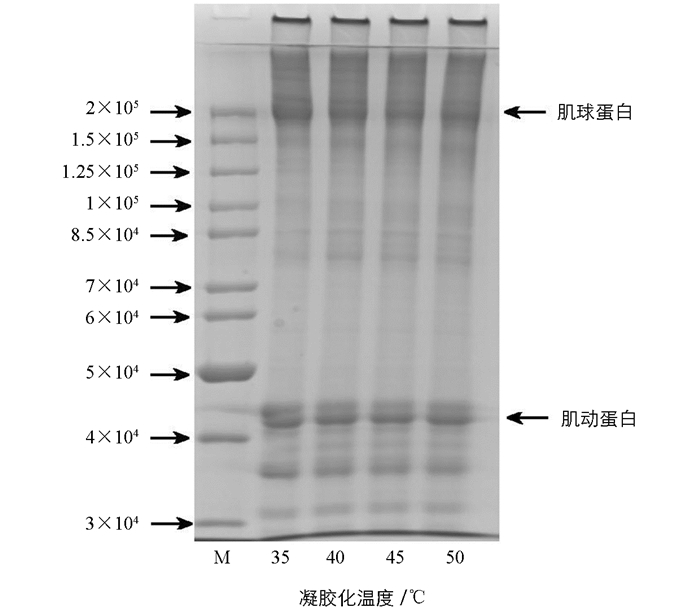
对不同凝胶化温度条件下的大黄鱼鱼糜凝胶进行SDS-PAGE电泳分析,结果如图 4所示.从图 4中可以清晰分辨出肌球蛋白重链(MHC,2×105)和肌动蛋白(Action,4.5×104).当凝胶温度为(35~45) ℃时,鱼糜凝胶的蛋白组分无显著区别,但鱼糜凝胶强度会随温度上升而减小,说明温度主要促进鱼糜蛋白发生聚集而不是使蛋白之间交联形成聚合物.从图 4中还可以发现,35 ℃的MHC条带相较于(40~50) ℃颜色较深,而(40~50) ℃的MHC条带颜色无明显变化,说明鱼糜凝胶的MHC发生了降解,原因可能是加热使内源性蛋白水解酶活性增强,从而导致肌球蛋白降解.对于不同凝胶化温度处理的鱼糜蛋白样品,MHC条带强度的减弱可能是蛋白聚集和降解共同作用的结果[28].
-
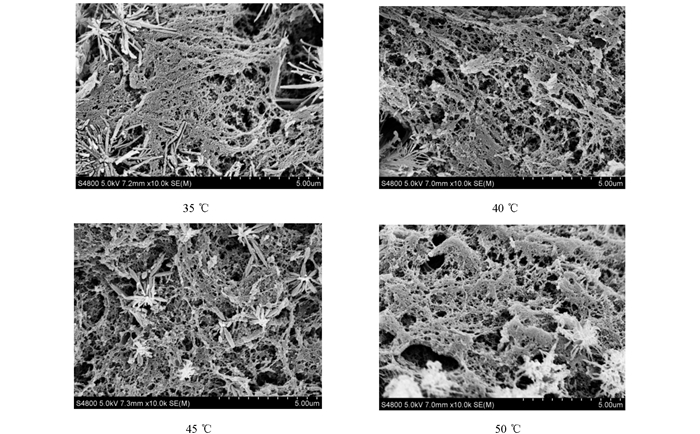
凝胶特性是评价鱼糜凝胶品质的重要参数之一,与微观结构密切相关[29].大黄鱼鱼浆在不同温度条件下形成鱼糜凝胶的微观结构如图 5所示.由图 5中可以看出,当凝胶化温度为45 ℃和50 ℃时,大黄鱼鱼糜的凝胶微观结构中具有较多棒状或颗粒状聚合物,凝胶孔径不均一,凝胶网状结构比较粗糙、无序;当降低凝胶化温度,使其处于35 ℃和40 ℃时,凝胶网络结构趋向有序和有层次,此时逐渐形成多孔且孔径均一的细致结构,棒状结构减少甚至消失,其中温度为35 ℃的孔径比温度为40 ℃的稍小.蛋白质网络交联结构在较低的温度开始形成,降低了凝胶化温度,有利于形成更致密有序的蛋白质三维网络结构[30-31].实验结果表明,鱼糜的微观结构在35 ℃时更为细密有序,而随着凝胶化温度提高,凝胶网络结构的孔洞越来越大,形态也逐渐变得错杂无序.凝胶的水分状态与其微观结构紧密相关,一般情况下鱼糜蛋白分子的有序聚集形成致密均匀的鱼糜凝胶网络结构[32],凝胶结构越均匀致密有序,水分的流动性越弱,其持水性越强,凝胶强度越大[33-34].所以,当凝胶化温度处于35 ℃时,其微观结构较为细密紧致,能将水分紧紧锁住,同时验证了35 ℃条件下鱼糜的保水性和凝胶强度较好.
-
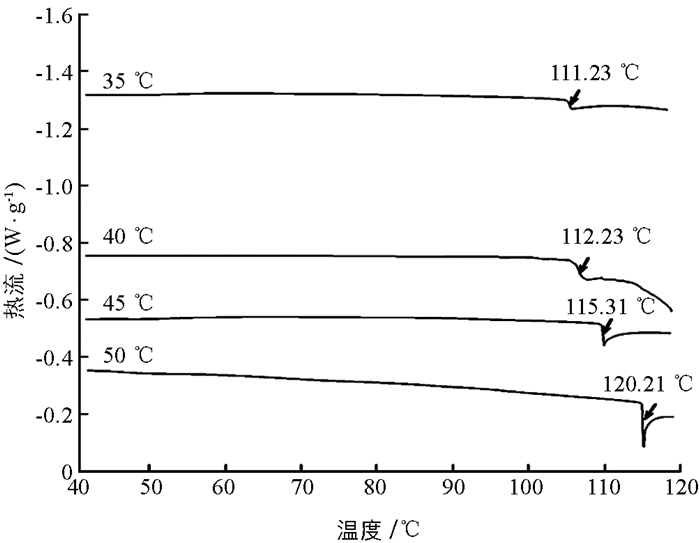
差示扫描量热试验是在程序控温及一定流量气氛下,测量物质与参比物的热流差与温度或时间的一种技术.根据这种流量差信号分析得到样品表征性的温度和量热特征参数[35]. DSC直观地反应了蛋白质在变性时吸收的热量值,其数值越大说明鱼糜稳定性越强[36].在一定的条件下,蛋白在DSC图中有固定的吸热峰,根据峰值可以确定蛋白质的变性温度.
不同凝胶化温度条件下大黄鱼鱼糜的热转变温度结果如图 6所示.当凝胶化温度从35 ℃提高至50 ℃时,鱼糜的热转变温度从111.23 ℃逐渐上升至120.21 ℃.结果表明,随着凝胶化温度升高,大黄鱼鱼糜的热稳定性逐渐增强,即蛋白变性程度越大[37],当温度为50 ℃时,鱼糜的热稳定性最好.这是由于随着凝胶化温度越来越高,鱼糜凝胶的变性程度逐渐增加,鱼糜蛋白容易因为温度改变而继续变性,其对热的耐受能力较差.
-
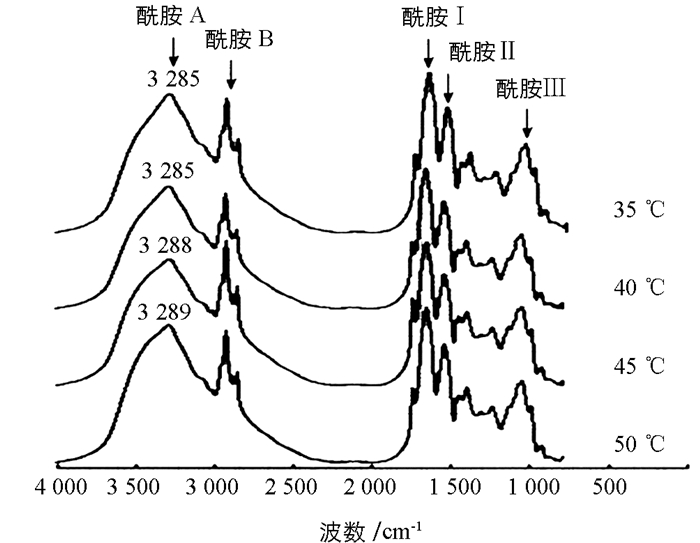
为了考察不同凝胶化温度对鱼糜凝胶中蛋白质之间的相互作用,用傅里叶变换红外光谱仪分析鱼糜中蛋白分子的官能团和氢键的变化.蛋白质的红外吸收光谱由一系列酰胺吸收带组成,即酰胺Ⅰ带、酰胺Ⅱ带、酰胺Ⅲ带、酰胺Ⅳ带、酰胺Ⅴ带、酰胺Ⅵ带、酰胺Ⅶ带、酰胺A带和酰胺B带.在肌原纤维蛋白经热处理形式凝胶的过程中,发生蛋白质变性聚集,其变性的实质是蛋白质分子中的次级键被破坏,引起蛋白质天然结构解体,其二级结构发生一定的变化,并不涉及共价键(肽键和二硫键)的断裂,蛋白质一级结构保持完整[38].
在研究蛋白质的二级结构方面,酰胺Ⅰ带(1 700~1 600 cm-1)是较为主要的研究内容[39].由图 7可知,在不同的凝胶化温度条件下,形成的大黄鱼鱼糜中蛋白质的特征吸收峰酰胺A带发生显著的变化,而对其他特征吸收峰酰胺B带、酰胺Ⅰ带、酰胺Ⅱ带和酰胺Ⅲ带没有产生明显的影响,说明凝胶化温度在(35~50) ℃的变动范围内,对大黄鱼凝胶肌原纤维蛋白的二级结构无明显的影响;对酰胺A带的振动波段位于3 300~3 270 cm-1,与N—H和O—H的伸缩振动相关,吸收峰的变化主要受氢键影响[40].随着温度降低,FTIR图谱中酰胺A波段的宽吸收峰出现增强现象,伸缩振动频率变化不明显,表明降低温度引起鱼糜中蛋白分子内和分子间的氢键增强.
2.1. 不同加热温度对大黄鱼鱼糜凝胶强度的影响
2.2. 不同加热温度对大黄鱼鱼糜凝胶持水力的影响
2.3. 不同加热温度对大黄鱼鱼糜质构的影响
2.4. 不同加热温度对大黄鱼鱼糜白度的影响
2.5. 不同加热温度下大黄鱼鱼糜凝胶的SDS-PAGE分析
2.6. 不同加热温度下大黄鱼鱼糜凝胶的微观结构分析
2.7. 不同加热温度对大黄鱼鱼糜凝胶热稳定性的影响
2.8. 鱼糜凝胶蛋白的傅立叶红外变换光谱分析
-
凝胶化温度会影响大黄鱼鱼糜的凝胶强度、质构、保水性等凝胶特性.降低鱼糜的凝胶化温度,可以显著提高大黄鱼鱼糜的凝胶强度和硬度、聚集性、咀嚼性等质构特性及保水性,在35 ℃凝胶化温度条件下,大黄鱼鱼糜凝胶的凝胶强度、保水性、硬度、聚集性、粘结性和咀嚼性最大,相较于其他温度条件的鱼糜凝胶,其凝胶微观网络结构细密紧致,MHC条带颜色较深,鱼糜凝胶中蛋白分子内和分子间的氢键增强,但其热稳定性较低,因35 ℃温度肌原纤维蛋白的变性速度较慢,充分形成凝胶网络结构,但温度升高使得蛋白质的变性程度加大,产生凝胶劣化现象且可能由于鱼糜凝胶中内源性蛋白水解酶的活性较强,使鱼糜凝胶网络结构被分解.在35 ℃的凝胶化温度条件下制备的大黄鱼鱼糜凝胶具有更高的凝胶强度及更加致密的网络结构,在此温度下制备的鱼糜制品品质较好.



 下载:
下载: