-
开放科学(资源服务)标识码(OSID):

-
伪结核棒状杆菌(Corynebacterium pseudotuberculosis,Cp)感染可引起小反刍动物山羊和绵羊干酪样淋巴结炎(CLA)和体表淋巴结脓肿,这是世界范围内引起养羊业经济损失的一种重要慢性传染病[1]。Cp感染山羊和绵羊不易直接造成死亡,危害具有隐蔽性,易被养殖者忽视,这些危害主要包括:生产性能下降、体表或内脏器官形成脓肿及干酪样病变,以及作为人畜共患病病原具有传播给人的潜在风险等。近年来,我国关于山羊和绵羊受Cp感染的报道不断增多,重庆[2]、四川[3]、云南[4]、陕西[5-6]、甘肃[6]、湖南[7]、福建[8]等多个省市均有该病原感染的报道,所检测脓肿样本中Cp分离率有的高达100%,因此,在羊场中急需探索一种有效防控Cp的方法,以降低或消除其感染造成的经济损失。在防治Cp感染致病的方法中,因手术排脓治疗过程繁琐且易造成污染,而抗生素等化学药物治疗存在药物不易进入脓肿部位、疗效差等问题,因此接种疫苗成为防控该病原感染的最佳手段[1]。本研究以前期筛选出Cp万州株(WZ)为制苗菌株[9],以ISA 201 VG为佐剂制备灭活苗,对山羊进行免疫接种及攻毒评价试验,旨在为Cp疫苗研究提供数据支撑。
全文HTML
-
Cp万州株(WZ)由西南大学动物传染病防控技术研究室分离鉴定和保存。4月龄雄性大足黑山羊,重庆市大足区腾达牧业有限公司;ISA 201 VG佐剂,Seppic;ELISA包被液,索莱宝科技有限公司;过氧化酶标记兔抗山羊抗体,Proteintech;改良马丁液体培养基,青岛高科园海博生物技术有限公司;胎牛血清(FBS),Biological Industries。
-
挑取Cp万州株(WZ)单菌落加入含10% FBS的马丁肉汤中培养24 h,按1∶20扩培至300 mL马丁肉汤(含0.5%吐温80和10% FBS),培养24 h。稀释涂板计数后,将菌液用0.4%的甲醛灭活,4 500 r/min离心15 min,取培养上清用真空冷冻干燥机冻干浓缩,并与菌体混合,使菌体浓度达到1×1010 CFU/mL。将灭菌的ISA 201 VG佐剂与菌液按体积比54∶46(油相∶水相)配制乳化,制备Cp灭活苗备用。
-
将Cp感染抗体检测阴性的6头黑山羊随机分为2组,每组3头。采取颈背部皮下注射免疫方法进行2次免疫,首免(1 mL/头)后28 d二免(2 mL/头),对照组在同样位置注射灭菌生理盐水。二免后30 d进行攻毒,连续观察65 d。免疫期间及攻毒后每周称体质量、首免及攻毒后7 d每天连续测量肛温,每周静脉采血检测血清抗体水平,二免后21、28 d和攻毒后7、14 d采血测血常规。
-
利用全自动血液细胞分析仪测量山羊的血常规。参照文献[9-10],准备ELISA包被用的Cp菌体和重组磷脂酶D蛋白(rPLD),将待检血清稀释512倍后,分别以Cp菌体和rPLD包被ELISA板,采用间接ELISA方法测定山羊血清IgG抗体水平以及抗PLD抗体水平。
-
二免后30 d,每只山羊以Cp万州株(WZ)进行皮下攻毒(4×106 CFU/ mL,不含菌液上清),在左侧前、后肢皮下2个不同部位分别注射0.5 mL。攻毒后每天观察山羊的精神状态,7 d内每天测量肛温,然后每周测量肛温并称体质量。攻毒后65 d处死山羊,解剖观察各个脏器及浅表淋巴结(下颌淋巴结、颈浅淋巴结、髂下淋巴结、腘淋巴结、髋淋巴结、腹股沟淋巴结、肠系膜淋巴结)大体病变及脓肿情况。分别采集淋巴结(除髋淋巴结及腘淋巴结分别取0.05 g及0.1 g外,其余每个部位的淋巴结取0.25 g)、内脏器官(肝脏、脾脏、肾脏、肺脏取1.5 g)和攻毒部位脓肿(取0.1 g)加入1.5 mL灭菌生理盐水中,匀浆后涂布于5%鲜兔血琼脂平板,37 ℃培养48 h进行活菌计数。
-
所有结果以x±s表示,使用GraphPad Prism 8.0.1分析数据,采用t检验分析差异的显著性,p<0.05表示差异有统计学意义。
1.1. 菌株、试验动物及主要试剂
1.2. Cp灭活苗的制备与检验
1.3. 山羊分组、免疫及攻毒处理
1.4. 免疫山羊血常规及血清抗体水平检测
1.5. 免疫山羊攻毒保护评价
1.6. 数据分析
-
对山羊皮下注射含ISA 201 VG佐剂的Cp灭活苗,在注射后第7 d发现注射部位有皮肤破溃的迹象,在注射疫苗后14 d,发现注射部位有明显的皮肤破溃,在注射后21 d,注射部位破溃有明显恢复,到注射疫苗后第49~56 d,基本上完全恢复(图 1),而对照组注射部位无明显变化。
-
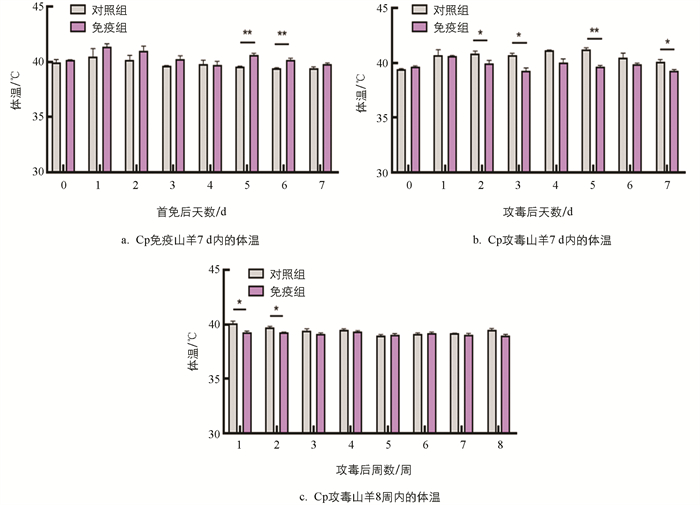
首免后第5、6 d免疫组山羊平均体温分别为40.60±0.24 ℃、40.20±0.16 ℃,显著高于对照组39.57±0.05 ℃和39.43±0.05 ℃,第7 d差异无统计学意义(图 2a)。Cp攻毒后,对照组山羊体温连续7 d平均温度为40.71±0.37 ℃,最高达41.23±0.19 ℃,均高于免疫组39.82±0.33 ℃,其中在第2、3、5、7 d达到显著水平(图 2b),且第2周对照组山羊体温39.70±0.16 ℃仍显著高于免疫组山羊体温39.27±0.05 ℃(图 2c)。
-
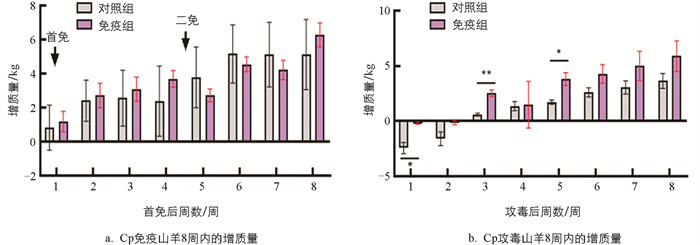
首免后1~4周,免疫组山羊增质量均高于对照组(图 3a),而二免后1~3周对照组增质量高于免疫组,到第4周则免疫组增质量高于对照组,差异无统计学意义(p>0.05)。Cp攻毒后第1~8周,对照组山羊增质量均低于免疫组,其中第1、3、5周差异有统计学意义(p<0.05),且在攻毒后第1、2周出现负增质量现象(图 3b)。
-
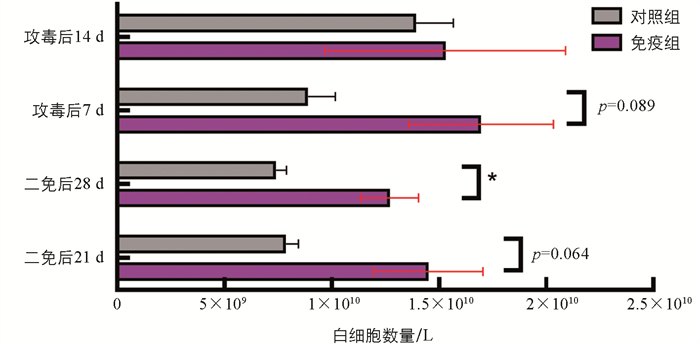
对Cp灭活苗免疫及免疫攻毒后山羊血常规进行检测,发现免疫组山羊的白细胞数量高于对照组,其中二免后28 d差异有统计学意义(p<0.05),而攻毒后14 d,免疫组和对照组白细胞数量几乎相当(图 4),其他血常规指标差异无统计学意义(p>0.05)。
-
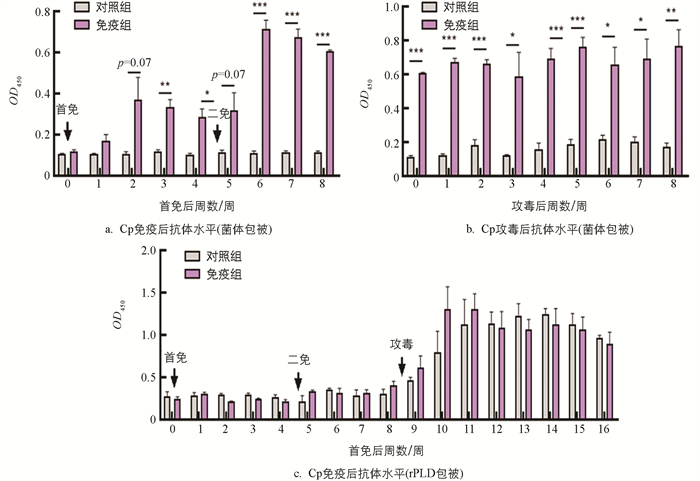
以Cp菌体作为包被抗原,检测发现免疫组山羊IgG抗体均高于对照组,且首免后第3、4周和二免后第2~4周差异有统计学意义(p<0.05),二免后山羊血清IgG抗体明显高于首免(图 5a)。攻毒后,免疫组山羊IgG抗体均显著高于对照组(图 5b)。此外,Cp灭活苗免疫后免疫组山羊抗PLD抗体水平与对照组差异无统计学意义(p>0.05),而Cp攻毒后,免疫组和对照组山羊抗PLD抗体水平均明显上升(图 5c)。
-
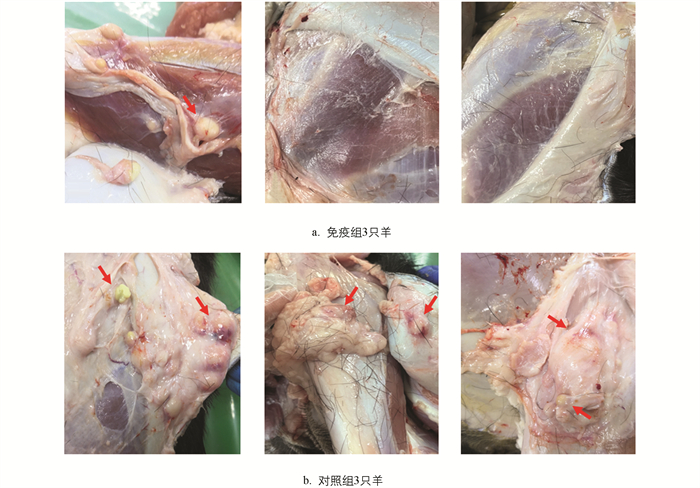
在整个攻毒试验期内没有山羊出现死亡。攻毒后65 d对山羊进行剖检,发现免疫组仅有1只山羊的后肢攻毒部位皮下出现脓肿(数量为5个,直径0.2~1 cm),而对照组3只山羊均在后肢攻毒部位皮下发现了脓肿,脓肿数量分别为15个(直径1.4~2.4 cm)、13个(0.5~2 cm)和7个(0.5~2 cm)(图 6)。此外,在对照组山羊的下颌淋巴结及髂下淋巴结也发现了脓肿的存在。
-
对攻毒山羊各脏器Cp进行检测,发现免疫组和对照组山羊的肝、脾、肺和肾脏中均未检测到Cp。对免疫组唯一1只在攻毒部位出现脓肿的山羊样本进行检测,发现其Cp量为1.06×109 CFU/g,而对照组3只山羊在攻毒部位脓肿的Cp量分别为3.53×1010、1.06×1010、1.39×1011 CFU/g。将对照组山羊中相应部位淋巴结混合检测,发现下颌淋巴结、颈浅淋巴结和髂下淋巴结中均有Cp,其载菌量分别为9.3×108、9.0×104、1.9×108 CFU/g,在髋淋巴结、腘淋巴结、腹股沟淋巴结和肠系膜淋巴结均未检测到Cp,在免疫组所有上述淋巴结样本中均未检测到Cp。
2.1. 皮下注射Cp灭活苗对注射部位的影响
2.2. Cp灭活苗免疫和攻毒对山羊体温的影响
2.3. Cp灭活苗免疫和攻毒对山羊增质量的影响
2.4. Cp灭活苗免疫和攻毒对山羊血常规的影响
2.5. Cp灭活苗免疫和攻毒对山羊IgG抗体的影响
2.6. Cp灭活苗免疫山羊攻毒后各脏器及淋巴结脓肿结果
2.7. Cp灭活苗免疫山羊攻毒后各脏器及淋巴结载菌量结果
-
目前Cp在我国多个省市均有感染致病的报道,特别是放养山羊发病率更高,而该病原一旦在羊场中存在则极难根除,因此无Cp的羊场如何预防、存在Cp病例的羊场如何降低其感染发病数和减少经济损失是急需养殖户重视的问题。接种疫苗是防控Cp的最佳手段,国外已有的商品化灭活苗包括硕腾公司生产的GlanvacⓇ系列疫苗、科罗拉多州血清公司生产的Caseous D-TⓇ和Case-BacⓇ疫苗,弱毒活疫苗有Labovet Produtos Veterinários生产的Vacina 1002Ⓡ和Vencofarma Lab生产的LinfovacⓇ[1],这些疫苗在防控Cp感染中发挥了重要作用。目前,我国尚无预防Cp感染的商品化疫苗,一些学者以铝胶、ISA 206 VG、白油等为佐剂制备Cp灭活苗,通过小鼠[11-12]和/或山羊[12-13]进行免疫评价并取得了一定的免疫保护效果。
机体应对Cp感染的免疫十分复杂,体液免疫和细胞免疫各自起到了一定的作用[14]。我们发现所制备的Cp灭活苗免疫可诱导山羊血清IgG抗体显著升高,且二免后山羊IgG抗体明显高于首免,证明该灭活苗免疫山羊可产生明显的体液免疫反应。虽然所制备灭活苗中含Cp培养上清液,但经过2次免疫后,免疫组山羊血清中抗PLD抗体水平与对照组差异并不明显,Cp攻毒后对照组和免疫组山羊血清中抗PLD抗体水平均明显上升,其中对照组在攻毒后第3~8周(首免后11~16周),免疫组在攻毒后2~8周(首免后10~15周)抗PLD抗体水平均高于攻毒前水平。据报道Cp在感染的巨噬细胞内PLD会高水平表达[15],该灭活苗免疫未能诱导高水平PLD抗体的原因可能是体外培养条件下PLD表达水平相对较低,所分泌的PLD蛋白尚不足以引发机体产生高水平抗体。
本研究发现Cp灭活苗免疫山羊白细胞数量高于对照组,其中二免后28 d达到显著水平,该结果与屈辉[16]报道注射口蹄疫O型疫苗的波尔山羊白细胞在第28 d显著升高、李玉豪[17]报道牛病毒性腹泻重组抗原亚单位疫苗免疫组绵羊的白细胞数高于对照组相似。由于伴随免疫应答的白细胞相应升高,本研究结果提示Cp灭活苗免疫可增强山羊的免疫应答能力。此外,本研究表明所制备的Cp灭活苗免疫可缓解因Cp感染引起山羊体质量下降及体温升高,明显减少Cp攻毒引起的脓肿数量和淋巴结载菌量。如果单以是否产生脓肿来判定Cp疫苗对山羊的免疫保护率[1],本研究表明所制备的Cp灭活苗对山羊的免疫保护率为66.7%。此外,本研究发现注射以ISA 201 VG为佐剂的Cp灭活苗在注射部位可形成一定的皮肤破溃,ISA 201 VG是基于矿物油的佐剂,这与张媛等[18]报道小鼠皮下注射猪丹毒丝菌油佐剂灭活苗产生皮肤破溃相似,但本研究的皮肤破溃在注射疫苗后49~56 d基本上完全恢复,而且所制备Cp灭活苗免疫对山羊增质量无明显影响,提示该疫苗具有直接应用于生产的可能性。后续研究中,将进一步优化制苗条件及免疫方法,增大试验山羊的数量,在临床上进一步评价其免疫保护效果,为研发防控Cp感染的疫苗提供资料。
-
本研究制备了Cp灭活苗,免疫山羊后可诱导抗Cp血清IgG抗体的显著升高,缓解因Cp攻毒引起的山羊体质量下降及体温升高,减少Cp攻毒引起的脓肿数量和淋巴结载菌量,为山羊养殖中Cp感染防治提供了参考资料。




 下载:
下载: