-
金花小檗(Berberis wilsonae Hemsl)是小檗科小檗属植物[1],可作黄连的代用品,主要分布在云南、贵州、四川和甘肃等地.其中,四川小檗属植物共有40种、5变种[2],是川西南地区民族习用的药食同源植物.在藏药和中药中,常以小檗属植物作为药用原料[3].小檗属植物全株均含生物碱,如小檗碱、药根碱、巴马汀等.这些成分具有多种生理活性,如:小檗碱抗菌抗炎、抗氧化应激效果强[4-5],还有抗肿瘤及免疫调节[6]、治疗糖尿病等[7]作用.巴马汀抗氧化活性好[8],药根碱降糖活性好[9].除此之外,小檗属植物与罂粟科角茴香属植物角茴香在植物抑菌方面也有相似作用[10].除药用外,它的花、果实和枝叶都极具观赏价值[11],可作为一种观赏植物,其果实可直接食用[12],亦可制作野生水果饮料、果醋等[13].
刘燕[14]、史娟[15]等的研究证明生物碱对DPPH·,O2-,·OH均有一定的清除效果,并且清除效果与生物碱浓度有剂量依赖效应.该属植物还能通过抗氧化能力对肾脏疾病[16]、消化道、尿道疾病[17]进行有效改善. Malayeri[18]在对大鼠结肠癌的试验中,也发现该属提取物有有效的抗氧化作用.
本研究先对金花小檗提取物和萃取部位的功效成分进行了测定,分析比较生物碱各组分含量的差异;之后,以金花小檗为材料,乙醇提取后,用滤纸片扩散法、比浊法及二倍稀释法测定其抑菌性;然后用DPPH·自由基清除法、总还原力法等体外抗氧化活性测定方法研究金花小檗醇提物及萃取部位的抗氧化活性,用体内抗氧化活性的测定方法研究其对小鼠血清MDA、T-SOD值的影响.目前,关于金花小檗醇提物的抑菌活性及体内外抗氧化活性的研究尚未见文献报道,本研究旨在为金花小檗的利用提供理论依据.
全文HTML
-
金花小檗采自四川省冕宁县,经西昌学院的罗强教授鉴定确认(图 1).样品采集后将根、茎分开,分别阴干,粉碎过4号筛,备用.
昆明小鼠,来自成都达硕实验动物有限公司;95%乙醇、甲醇、石油醚、乙酸乙酯、氯仿、正丁醇、磷酸二氢钠、铁氰化钾、三氯乙酸,均为分析纯,成都市科龙化工试剂厂生产;1,1-二苯基-2-三硝基苯肼(DPPH·),Sigma公司生产;芦丁标准品(质量分数≥98%),四川省维克奇生物科技有限公司生产;MDA和T-SOD测定试剂盒,南京建成生物工程研究所生产;牛肉膏蛋白胨培养基,杭州微生物试剂有限公司生产;乙醇、甲醇、DPPH、ATBS,成都市长征化玻有限公司生产;测试菌种金黄色葡萄球菌和大肠杆菌,由四川师范大学生命科学学院实验室提供.
R-1005型旋转蒸发仪,上海予华仪器设备有限公司生产;SHB-B95型循环水式多用真空泵,郑州长城科工贸有限公司生产;HH.W21型恒温水浴锅,北京中兴伟业仪器有限公司生产;LDZX-50KB型立体压力蒸汽灭菌锅,上海申安医疗器械厂生产;DZF-6050型真空干燥箱、DHP-9082型电热恒温培养箱,上海一恒科学仪器有限公司生产;SW-CJ-2F型超净工作台,苏净集团苏州安泰空气技术有限公司生产;DHG-9240型电热鼓风干燥箱,上海精宏实验设备有限公司生产;UV-2600型紫外可见分光光度计,日本岛津科学仪器公司生产;Biomate-3S型紫外分光光度计,Thermo Scientific公司生产;ESJ220-4B型天平,沈阳龙腾电子称量仪器有限公司生产;AM-75E型制冰机,HOSHEZAKI(日本)生产;LH-08B中药粉碎机,浙江温岭市创立药材器械厂生产.
-
提取物的制备:称取金花小檗25.00 g,按1:20比例加入75 %乙醇,60 ℃水浴回流提取1 h,重复2次,过滤,合并过滤液,去除乙醇后浓缩至50 mL(以生药量计500 mg/mL),冷藏备用.
萃取部位的制备:取金花小檗的根、茎若干,分别粉碎过80目筛,用95%乙醇提取,提取液喷干得到醇提取物,备用.再取金花小檗的根、茎,分别用95%乙醇浸泡提取,浓缩得浸膏后用水萃取,再用与水等体积的石油醚、乙酸乙酯和正丁醇分别依次萃取,各部分分别浓缩干燥得到4个萃取部位,冷藏,备用.
DPPH·溶液:精确称取8.0 mg干燥后的DPPH·粉末,用甲醇溶解定容至100 mL,获得质量浓度80 μg/mL的DPPH·溶液,DPPH·溶液现配现用.
芦丁对照液:取20.0 mg芦丁标准品用甲醇溶解定容至100 mL,得到200 μg/mL芦丁对照品溶液.
菌悬液:参照文献的方法[14]制备菌悬液,分别取出大肠杆菌、金黄色葡萄球菌各0.1 mL,接种到20 mL牛肉膏蛋白胨琼脂固体培养基上,37 ℃恒温培养24 h,挑选生长健壮的菌落,再接种到牛肉膏蛋白胨液体培养基上,培养24 h活化菌种,备用.分别取活化菌种各0.1 mL,置于20 mL牛肉膏蛋白胨液体培养基上,37 ℃恒温培养48 h,紫外可见分光光度计625 nm处测定OD值,加无菌的牛肉膏蛋白胨液体培养基,调节菌悬液浓度,使其OD值在0.08至0.13之间,此时的菌悬液浓度为108 CFU/mL.测定时,菌悬液稀释到105 CFU/mL.
标准品溶液:取一定量的药根碱、巴马汀和小檗碱的标准品,分别用甲醇溶解、定容,二倍稀释法稀释至初始浓度的2-8.
-
用酸性染料比色法[19]测定总生物碱的比例,用HPLC法测定其组分的比例. HPLC的参数:色谱柱Platisil C18 ODS柱(250 mm×4.6 mm×5 μm),流动相为乙腈和水(含磷酸二氢铵0.01 moL/L,用磷酸调pH值至2.8),柱温25 ℃,流速0.8 mg/mL,检测波长345 nm,进样量10 μL,用梯度洗脱程序.
-
参照文献的方法[20],根据有无抑菌圈、抑菌圈直径判定提取物的抑菌活性.用打孔器制备5 mm滤纸圆片,灭菌后烘干.分别将10 μL一定浓度的醇提物滴在各滤纸圆片上,以75%乙醇为阳性对照,以蒸馏水为空白对照.分别移取0.1 mL菌悬液,用灭菌的涂布棒均匀涂布到牛肉膏蛋白胨琼脂固体培养基上,用无菌镊子夹取各处理过的滤纸片,置于培养基上.每皿贴4张,37 ℃培养24 h,测定抑菌圈直径,重复3次.
-
参照文献的方法[21],测定醇提物的抑菌活性.以75%乙醇为阳性对照,以只加0.10 mL菌悬液和4.90 mL培养基为空白对照.将醇提物稀释成不同的浓度,各浓度吸取0.10 mL,分别加入装有4.8 mL无菌液体培养基的试管,再加入0.10 mL菌悬液,塞上棉塞,振荡混匀,在37 ℃条件培养24 h.用液体培养基调零,600 nm处测定各个试管的OD值,重复3次.
-
参照文献的方法[22],采用试管二倍稀释法测定醇提物的最小抑菌浓度.取2组各9支无菌试管,每管各加2.00 mL灭菌培养基,先在第1支试管中加醇提物2.00 mL,混匀后吸出2.00 mL置于第2支试管,混匀后再吸取2.00 mL至第3支试管,如此连续稀释至第7管,混匀后弃去2.00 mL;第8支试管不加提取物,作为空白对照;第9支试管不加细菌只加提取物2.00 mL,混匀后弃去2.00 mL,观察提取物是否有污染. 2组第1-7支试管,分别加入0.1 mL的105 CFU/mL大肠杆菌、金黄色葡萄球菌的菌悬液,混匀,37 ℃培养24 h,观察结果.与第8和第9支试管比较,第1-7支试管中不发生混浊变化的最高提取物稀释倍数的浓度,即为MIC值,重复测定3次.
-
用DPPH·清除法和总还原力法评价金花小檗提取物和萃取部位的体外抗氧化活性,以测定动物血清的MDA、T-SOD变化评价其提取物和萃取部位的体内抗氧化活性.
-
参考李春阳[23]的DPPH·清除法,并稍作改进.空白组:0.2 mL甲醇+3.8 mL DPPH·溶液,室温摇匀,置于避光处60 min后,在515 nm处测定吸光度(A0).样品对照组:0.2 mL样品+3.8 mL甲醇,室温下充分摇匀,置于黑暗条件反应60 min,在515 nm处测定吸光度(Aj).试验组:精确量取各样品0.2 mL,置于具塞试管,然后加入3.8 mL的DPPH·溶液,黑暗条件反应60 min,在515 nm处测得吸光值(Ai).
试验平行测定3次,按下列公式,计算各样品对DPPH·的清除率:
-
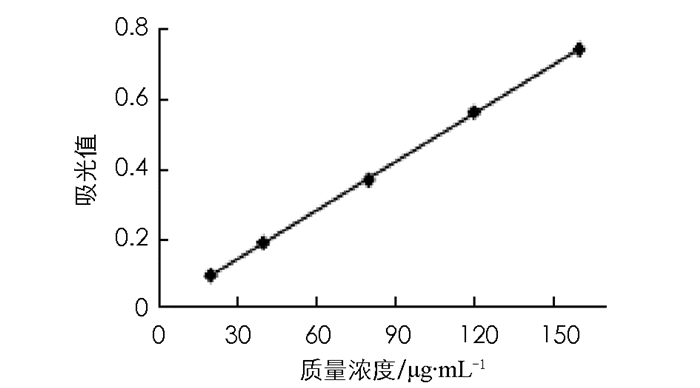
参照刘刚等的方法[24],稍作改进.精密吸取0.1,0.2,0.4,0.6,0.8 mL的芦丁标准液,相应分别加入0.9,0.8,0.6,0.4,0.2 mL甲醇溶液至1 mL,得到芦丁质量浓度20,40,80,120,160 μg/mL,以1.0 mL甲醇为空白对照.各试管顺序加入2.5 mL磷酸缓冲液和2.5 mL 1%铁氰化钾溶液,混合均匀封口,置50 ℃水浴20 min,冰块迅速冷却,再各加入2.5 mL的10%三氯乙酸溶液,混合摇匀,4 000 r/min离心10 min.取离心上清液2.5 mL至新试管,顺序加入2.5 mL蒸馏水和1.0 mL的0.1%三氯化铁溶液,混合摇匀,静置10 min. 700 nm波长测定吸光光度值,平行测定3次,以芦丁的质量浓度X(μg/mL)为横坐标,吸光光度值为纵坐标(Y),线性拟合得到芦丁标准曲线为:Y=0.004 1X+0.016 8,R2=0.999 5.在质量浓度为20~160 μg/mL范围内,吸光光度值与质量浓度有良好线性关系,见图 2.
根据芦丁标准曲线,按前述方法步骤,测定吸光值,记录各样品的芦丁质量浓度,并换算成芦丁质量浓度,即为芦丁当量(g/g).
-
雄性小鼠共120只,每只体质量(20±2) g,按体质量随机分为10组.根和茎提取物的高(1 000 mg/kg)、中(500 mg/kg)、低(250 mg/kg)剂量各1组(共6组),再加上茎的正丁醇萃取部位组(1 000 mg/kg)、根的正丁醇萃取部位组(1 000 mg/kg)、空白组和模型组,共10组,每组12只小鼠.在(23±2) ℃温度条件下,每日光照和黑暗各12 h,早上8点停止光照,自由饮水、进食,试验开始前适应性喂养3 d,试验处理30 d.从小鼠的眼球取血1~2 mL,静置30 min,4 ℃条件下,4 000 r/min离心10 min,收集80~150 μL血清,立即放入-20 ℃冰箱保存备用,用试剂盒测定血清的MDA,T-SOD含量.
-
用SPSS 17.0的方差分析、Probit回归分析法[17],比较各样品组的DPPH·清除率差异性,计算出各组的SC50值,用Origin 8.0软件绘制图形.
1.1. 材料、试剂和仪器
1.2. 样品和标准品的制备
1.3. 功效成分的测定
1.4. 测定金花小檗提取物的抑菌活性
1.4.1. 滤纸片扩散法
1.4.2. 比浊法
1.4.3. 二倍稀释法
1.5. 测定金花小檗提取物和萃取部位的体外抗氧化活性
1.5.1. DPPH·清除法
1.5.2. 总还原力法
1.6. 测定金花小檗提取物的体内抗氧化活性
1.7. 统计与分析
-
称取金花小檗的干燥根和茎各300 g分别粉碎后,用95%乙醇提取2次,处理后各得浸膏24.22 g和12.39 g,再分别依次使用石油醚、乙酸乙酯和正丁醇萃取,计算各萃取部位的萃取率(表 1).
从表 1可看出,金花小檗根、茎的萃取物主要集中于正丁醇部位、水部位中.根的正丁醇部位萃取率为25.4%,根的水部位萃取率为65.8%;茎的正丁醇部位萃取率为39.7%,茎的水部位萃取率为46.3%.石油醚部位、乙酸乙酯部位萃取率都较低,说明金花小檗根、茎提取物中的组分物质主要集中于正丁醇部位和水部位中.
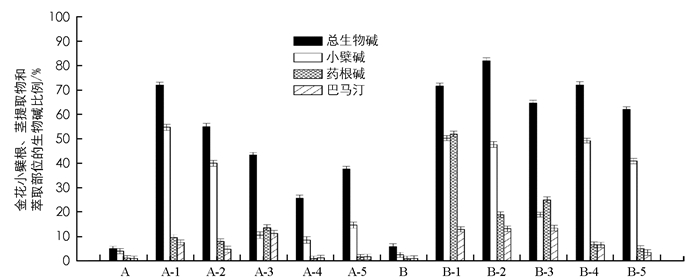
用酸性染料比色法、HPLC法测定金花小檗根茎和其提取物、萃取部位的总生物碱及其组分的比例,结果见图 3.
从图 3可以看出:金花小檗的根和茎中,除了正丁醇部位中小檗碱比例小于药根碱外,各组分的生物碱比例顺序从大到小为总生物碱、小檗碱、药根碱、巴马汀.根中小檗碱的比例比茎中高,根中药根碱、巴马汀的比例比茎中的低.金花小檗根、茎的萃取部位中均含有3种生物碱,其主要分布在水和正丁醇部位,乙酸乙酯部位和石油醚部位生物碱较少. 3种生物碱中,小檗碱在提取物、萃取部位中的比例都最多,茎的提取物中为50.25%,根的提取物中为54.72%;药根碱在茎的正丁醇部位最高,为25.00%,其次是茎的水部位中(18.95%),最低是茎的乙酸乙酯部位中(6.67%);巴马汀在茎的正丁醇部位最高,为13.41%,其次是茎的水部位中(13.16%),最低是茎的石油醚部位中(3.45%).
根据文献的结果[25],黄连中的总生物碱质量分数为0.112 5 g/g,盐酸小檗碱在4.176~16.68 μɡ/mL范围呈线性关系,其结果与本研究测定的金花小檗总生物碱比例相对比较一致.
-
采用滤纸片扩散法,在牛肉膏固体培养基上分别测定金花小檗根和茎的醇提物对大肠杆菌、金黄色葡萄球菌的抑菌活性,结果见表 2.
从表 2可知,无菌水空白对照的抑菌圈为0.00 mm,75 %乙醇对大肠杆菌的抑菌圈为6.59 mm,而对金黄色葡萄球菌的抑菌圈为6.47 mm.与无菌水空白比较,金花小檗根和茎的醇提物对大肠杆菌和金黄色葡萄球菌都有一定的抑制作用,其中,对金黄色葡萄球菌的抑菌效果为低敏,而对大肠杆菌的抑菌效果为中敏.与75%乙醇比较,金花小檗根和茎的醇提物对金黄色葡萄球菌的抑菌圈分别为8.57 mm和7.46 mm,较75%乙醇的抑菌圈(6.47 mm);而对大肠杆菌的抑菌圈分别为10.23 mm和11.32 mm,比75%乙醇的抑菌圈(6.59 mm)更大.试验结果表明,对G+和G-菌的抑制作用,金花小檗根和茎的醇提物抑菌效果明显高于75%的乙醇.
-
采用比浊法测定金花小檗根和茎的醇提物对大肠杆菌、金黄色葡萄球菌的抑菌作用,结果见表 3.
从表 3可知,与空白对照比较,金花小檗根、茎的醇提物对大肠杆菌、金黄色葡萄球菌的抑菌效果显著;与75 %乙醇比较,金花小檗根、茎的醇提物的抑菌率显著升高,同时,随醇提物浓度的增加,抑菌率都增大.
对大肠杆菌的抑菌率,75%乙醇为2.65%,最低浓度125 mg/mL的金花小檗根、茎的醇提物的抑菌率达到21.95%和20.91%;而对金黄色葡萄球菌,75%乙醇的抑菌率为2.53%,最低浓度125 mg/mL的金花小檗根、茎的醇提物的抑菌率达到19.43%和20.45%.因此,最低浓度125 mg/mL的金花小檗根、茎的醇提物对大肠杆菌、金黄色葡萄球菌的抑制率,都是明显高于75%的乙醇.金花小檗根、茎的醇提物浓度500 mg/mL时对大肠杆菌的抑菌率为90.76%和89.56%,而对金黄色葡萄球菌的抑菌率为91.48%和90.48%.因此,金花小檗根、茎的醇提物对两类细菌的抑制率均大于90%.
-
采用试管二倍稀释法测定金花小檗根、茎的醇提物抑菌活性,以MIC值表示,结果见表 4.
结果表明:金花小檗根、茎的醇提物,对金黄色葡萄球菌的最低抑菌质量浓度为63.62 mg/mL,对大肠杆菌的最低抑菌质量浓度为125 mg/mL.结果提示,金花小檗醇提物对G+菌的MIC值比对G-的MIC值小,结果可能是两类细菌的抑制作用机理差异所致.
-
按1.4.1的方法,测定金花小檗的根、茎提取部位对DPPH·的清除,结果见图 4.
由图 4A可知,除根的石油醚部位外,金花小檗根、茎的其他部位对DPPH·的清除能力的变化趋势大致相同,各部位中的乙酸乙酯部位、正丁醇部位和水部位对DPPH·清除的能力相近,并且均大于石油醚片段.根的乙酸乙酯部位、正丁醇部位和水部位,质量浓度小于300 μg/mL时,对DPPH·的清除率增加均明显,质量浓度超过300 μg/mL后,对DPPH·清除率的增长不明显.由图 4B可知,茎的4种部位对DPPH·的清除能力的变化趋势大致相同,在萃取部位质量浓度小于600 μg/mL时,对DPPH·的清除率增加明显,质量浓度超过600 μg/mL后,对DPPH·清除率的增长不明显.
按1.4.1的方法,测定金花小檗的根、茎提取物对DPPH·的清除效果,结果见图 5.
从图 5可以看出,根、茎提取物对DPPH·有清除率随质量浓度的增加逐渐增大,增加较为平滑,根、茎的提取物对DPPH·清除率的影响差异性不大.
-
对清除DPPH·的结果进行SPSS回归分析,求出各样品提取物和萃取部位的浓度与DPPH·清除率的回归方程和决定系数,结果见表 5.
由表 5可知,金花小檗的根、茎提取物的浓度与DPPH·清除率有线性关系,各萃取部位对DPPH·的清除率都与浓度有明显的线性关系,决定系数R2为0.993~0.997.
进一步用Probit法计算DPPH·清除率为50%时的样品体积质量分数,得到各样品清除率DPPH·的SC50值,结果见表 6。
由表 6可知,根的提取物和各个提取部位,SC50值从大到小排序是:石油醚部位、提取物、正丁醇部位、乙酸乙酯部位、水部位,最小的是根乙酸乙酯部位,其SC50值为29.0 μg/ml,最大的是根石油醚部位,其SC50值为477.0 μg/mL.
茎的提取物和各个提取部位,SC50值从大到小排序是:石油醚部位、提取物、正丁醇部位、水部位、乙酸乙酯部位,最小的是茎乙酸乙酯部位,其SC50值为18.7 μg/mL,最大的是茎石油醚部位,其SC50值为144.9 μg/mL.
因此,根的水部位对DPPH·的清除能力(SC50值为28.0 μg/mL)最强,而正丁醇部位(SC50值为56.0 μg/mL)和乙酸乙酯部位(SC50值为29.0 μg/mL)的清除效果较好.茎的乙酸乙酯部位对DPPH·的清除能力(SC50值为18.7 μg/mL)最强,水部位(SC50值为21.1 μg/mL)和正丁醇部位(SC50值为65.0 μg/mL)的清除效果较好.
-
按1.4.2的方法,测定金花小檗的根、茎提取物及其萃取部位的抗氧化活性强弱,结果见表 7.
由表 7可知,各提取物部位均有一定的抗氧化性,其能力没有达到芦丁的水平,最高的接近芦丁抗氧化能力的一半多点.根的乙酸乙酯部位总还原力最大,为0.525 g/g(芦丁当量);正丁醇部位为0.492 g/g(芦丁当量),水部位为0.469 g/g(芦丁当量),这两个部位的总还原力较好.茎的乙酸乙酯总还原力最大,为0.517 g/g(芦丁当量),正丁醇部位和水部位总还原力较好.该结果与DPPH·清除试验的结果相似.与小檗属其他物种的研究比较,金花小檗的抗氧化活性相似,都存在明显的剂量依赖性[26-27].
综上所述,用DPPH·清除法、SC50值和总还原力法,衡量金花小檗的根、茎提取物与萃取部位,体外抗氧化活性的强弱,正丁醇部位和水部位的抗氧化活性较强,石油醚的抗氧化活性最低.
-
正丁醇部位和水部位的抗氧化活性较强,而且它们的提取率最高,动物试验中将正丁醇部位和水部位合并,按试验设计方案分别用金花小檗的根、茎提取物及其正丁醇-水部位饲养小鼠30 d,断尾取血后测定小鼠血清的MDA,T-SOD含量,结果见表 8.
从表 8可以看出:与正常组比较,模型组的T-SOD显著降低,MDA水平显著升高,表明模型组动物的体内抗氧化活性显著降低.与正常组比较,除茎的正丁醇-水部位组外,根正丁醇-水部位组的T-SOD显著升高,不同剂量的根、茎提取物组T-SOD也显著升高;与正常组比较,高剂量的根提取物组MDA显著降低,茎的中低剂量提取物组MDA有不同程度地降低,其他组的MDA无显著变化.与模型组比较,除茎的正丁醇-水部位组外,根正丁醇-水部位组和高中低剂量的根、茎提取物组的T-SOD显著升高,而全部试验处理组的MDA均显著减少.
因此,体内抗氧化试验证明,金花小檗提取物及正丁醇-水部位对小鼠血清MDA和T-SOD的影响明显,对小鼠体内抗氧化活性有显著改善.根据文献研究结果[28-29],与小檗属其他物种的体内抗氧化活性进行比较,金花小檗根和茎的提取物、正丁醇-水部位抗氧化活性的较一致,均有提高抗氧化活性的功能.
2.1. 测定根、茎提取物及其萃取部位的功效成分
2.2. 金花小檗醇提取物的抑菌活性
2.2.1. 滤纸片扩散法测定的抑菌活性
2.2.2. 比浊法测定的抑菌活性
2.2.3. 二倍稀释法测定的抑菌活性
2.3. 根、茎的提取物及其萃取部位对DPPH·的清除率
2.4. 根、茎的提取物及其萃取部位清除DPPH·的SC50值
2.5. 根、茎的提取物及其萃取部位的总还原力
2.6. 根、茎的提取物及其萃取部位对血清MDA和T-SOD含量的影响
-
小檗属的物种多达450~500种[30],是一种常用的抗菌消炎中药和民族药[31],多为常绿或落叶灌木,一般高1~5 m,有刺,其茎、根可提炼黄色染料,有些种的果实富含维生素C,可以食用.小檗属植物功能多样、功效成分丰富,其主要的功效成分是生物碱且作用靶点多,现对其功能研究方兴未艾.当前,对小檗属物种的更多功能研究有待深入.本试验对金花小檗的研究有如下结论:
(1) 以酸性染料比色法测定金花小檗根和茎提取物及萃取部位的总生物碱,根、茎的总生物碱比例为4.90%~5.82%,根、茎乙醇提取物的总生物碱比例达69.57%~72.09%.以HPLC法测定3种生物碱,其中金花小檗根、茎中小檗碱比例最高,其值均大于0.6%. 3种生物碱组分中,根、茎提取物和水部位中小檗碱比例最高,巴马汀比例最低;在根、茎的正丁醇部位中,药根碱比例较高,但小檗碱与巴马汀比例都较低;在根、茎的乙酸乙酯部位和石油醚部位中,小檗碱比例最高,药根碱与巴马汀的比例很低.因此,金花小檗根、茎提取物和萃取部位中,功效物质主要集中于正丁醇部位和水部位中.
(2) 在金花小檗抑菌活性试验中,采用滤纸片扩散法、比浊法和二倍稀释法,以抑菌圈、MIC为评价指标,测定金花小檗醇提物对大肠杆菌、金黄色葡萄球菌的抑制效果.滤纸片扩散法的结果表明,金花小檗醇提物对G+和G-两类细菌的抑菌效果有显著差异;比浊法的结果表明,质量浓度为500 mg/mL的金花小檗醇提物,对G+和G-两类细菌的抑制率都达到90%以上;金花小檗醇提物对大肠杆菌的MIC值为125 mg/mL,对金黄色葡萄球菌的MIC值为63.62 mg/mL.因此,金花小檗醇提物具有显著的抑菌活性,为进一步研究金花小檗的抑菌成分、抑菌机理等奠定了理论基础.
(3) 通过DPPH·清除法、总还原力法等体外抗氧化活性的测定方法,对金花小檗根、茎、提取物及萃取部位进行还原力分析,发现两种测定方法的结果一致.结果表明:金花小檗根和茎的提取物及正丁醇部位和水部位的抗氧化活性较强,石油醚部位的抗氧化活性最低.因此,醇提物及萃取部位都具有体外抗氧化活性.
(4) 用金花小檗根、茎、醇提物和萃取部位饲喂处理小鼠30 d,分别测定各组小鼠的血清MDA、T-SOD含量,结果表明,金花小檗提取物及正丁醇-水萃取部位对小鼠血清MDA、T-SOD的影响显著,对小鼠的体内抗氧化活性具有显著的改善作用.因此,提取物及正丁醇-水萃取部位在小鼠体内具有抗氧化活性.
通过试验发现,金花小檗根和茎的功效成分丰富且主要集中在根上,这与藏药马尿泡茎段快繁体系及分化过程体内生物碱变化研究中用HPLC法测定试管苗不同部位4种生物碱量的结果相似,即:根中总生物碱量最高[32].金花小檗醇提物通过滤纸片扩散法、比浊法、二倍稀释法均表明,金花小檗醇提物对G+和G-两类细菌的抑菌效果显著,此结果与云南民族药臭灵丹在抗菌消炎、抑菌、祛痰、镇痛、抗肿瘤等方面均有着一定的药理活性结果相似[31].正丁醇-水部位体内外抗氧化活性的研究结果均表明,金花小檗根和茎都具有较强的抗氧化活性,黄连素治疗阿尔茨海默病的研究进展中也发现黄连素具有较好的抗氧化应激作用[5].
因此,本试验通过对金花小檗抑菌、功效成分、抗氧化作用等的测定,进一步巩固和提升了其在中药及藏药中的地位.




 下载:
下载: