-
性别决定与分化作为基本的生物学问题之一,一直以来都是生命科学领域的研究重点.脊椎动物性别决定与分化方式既具有保守性,同时又在进化过程中呈现出多样性.现普通认为脊椎动物的性别决定方式分为遗传性别决定(GSD)和环境性别决定(ESD).在哺乳类中,大多数物种属于遗传性别决定,其性别决定系统是XX/XY型. 1990年,哺乳类的性别总开关SRY基因的发现是性别决定领域的重大突破[1].鸟类的性别决定系统是ZZ/ZW型,在Z染色体上特异存在一个Dmrt1基因,含有保守的DM结构域[2],已有的研究结果暗示Z染色体上的Dmrt1基因很有可能就是鸟类的性别决定基因[3].爬行类动物普遍被认为有GSD和ESD 2种性别决定方式.但其性别决定的具体机制尚不清楚,并且至今未找到性别决定基因.在两栖动物中也有GSD和ESD 2种性别决定方式,不过两栖动物的染色体组成非常复杂[4].在非洲爪蟾中发现的W染色体连锁基因DM-W是在两栖类动物中发现的首个性别决定候选基因[5].与其它脊椎动物相比,鱼类的性别决定更为复杂.对超过2 000种硬骨鱼类作过的性染色体组型的分析发现,仅有72种被认定有性染色体[6].硬骨鱼的性染色体组成方式多样,既有XX/XY型,也具有ZZ/ZW型,还有一些鱼类对于这2种性别决定系统兼而有之[7].在鱼类的性别决定系统中,环境因素对于鱼类的性别决定也有调控作用,包括pH值、群体结构、温度等.同时,外源激素也可以引起鱼类的性逆转,比如外源性的雌激素可以完全诱导雄性尼罗罗非鱼性逆转为功能性的雌性尼罗罗非鱼[8].正是由于鱼类性别决定的原始性和多样性,使得其性别决定与分化的机制变得更为复杂,但也更具有研究意义.
生殖细胞的分化方向并不是依靠性染色体本身,而是依靠其所处的环境.如雄性生殖细胞可以在雌性的性腺中被诱导成卵母细胞,同时雌性生殖细胞也可以在雄性的性腺中被诱导为前精原细胞,这种现象在低等脊椎动物中更常见,尤其是鱼类[9].在斑马鱼的性腺发育过程中,早期先发育为卵巢样组织,该组织具有发育为精巢或者卵巢的双向潜能,若卵巢样组织中的卵母细胞凋亡,则会性逆转为精巢.如果在斑马鱼中敲降早期生殖细胞标记基因DND(Dead end)可以导致雄性不育.此外,在罗非鱼中,雌性生殖细胞的丢失会使性腺雄性化[10].在青鳉中,生殖细胞的缺失会导致由雌向雄的性逆转[11-12].综上所述,生殖细胞在鱼类性别决定与分化中发挥着非常重要的作用.
长链非编码RNA(Long non-coding RNA,LncRNA)是一类长度大于200个核苷酸、无编码蛋白质功能的RNA分子[13].很长一段时间内,LncRNA被当做转录噪声,随着测序技术以及生物信息学的发展,它的生物学功能才逐渐被了解,比如剪接调控、转录激活、染色质重构、X染色体失活等[14].与蛋白编码基因相比,LncRNA表现出更明显的组织特异性[15].在鸡的卵母细胞发育过程中,人们发现有一系列特异表达的LncRNA,但这些特异的LncRNA是否与卵母细胞的分化以及发育有关,现在并不清楚[16].到目前为止,还没有关于LncRNA在硬骨鱼类卵母细胞分化以及发育过程中的作用报道.
本研究采用尼罗罗非鱼(Oreochromis niloticus)作为研究对象,通过二代高通量测序技术,筛选出在雌、雄性腺中呈现出差异表达的LncRNA.采用生物信息学、Real-time PCR和原位杂交技术研究其在硬骨鱼类卵母细胞分化与发育过程中的作用.在研究硬骨鱼类生殖细胞分化与发育方面,尼罗罗非鱼具有其他硬骨鱼类不可比拟的优点,其性成熟时间短,产卵周期为14天,易于获得全雌和全雄鱼苗.罗非鱼是世界性的养殖鱼类,是联合国粮农组织向世界各国推荐的优良养殖对象,雄鱼比雌鱼生长速度快约50%,全雄鱼养殖具有更好的经济价值[17].因此,通过研究非编码RNA在硬骨鱼类卵母细胞分化与发育中的作用,可以加深我们对于硬骨鱼类性别决定与分化的理解,为性控育种提供理论基础,并更好地服务于水产养殖业.
全文HTML
-
尼罗罗非鱼全雌♀(XX)鱼苗由正常雌鱼♀(XX)的卵子与性逆转假雄鱼♂(XX)的精子通过人工授精获得.全雄♂(XY)鱼苗由正常雌鱼(XX)♀的卵子与超雄鱼♂(YY)的精子通过人工授精后得到,受精卵置于孵化器中,在26 ℃循环水孵化系统中孵化.孵化后的尼罗罗非鱼饲养于26 ℃循环水系统中,光照时间与自然光周期保持一致.
-
分别提取孵化后4个月的罗非鱼精巢和卵巢的RNA,委托诺禾致源生物信息科技有限公司进行转录组测序,筛选到一系列具有明显性别二态性的LncRNA.以其中一个LncRNA (TCONS_02477925)为例,初步研究非编码RNA在硬骨鱼类卵母细胞发育及性别分化过程中的作用.将获得的TCONS_02477925序列输入NCBI (https://blast.ncbi.nlm.nih.gov/Blast.cgi),通过序列比对分析,将LncRNA序列定位于罗非鱼基因组(版本为Jan.2011(Broad oreNil1.1/oreNil2))上,分析此基因具有的外显子数目及其染色体定位,确定TCONS_02477925作用的靶基因,最后通过分析靶基因在罗非鱼各组织中的的表达预测对应的LncRNA可能具有的功能.
-
以LncRNA在雌、雄性腺中的FPKM(每百万测序碱基中每千个转录子测序碱基中所包含的测序片断数,是目前最为常用的基因表达水平的估算方法)的比值为依据,设定比值大于2即为有显著的性别二态性.进一步采用Real-time PCR的方法验证该LncRNA在雌、雄性腺中的表达模式.其中LncRNA逆转录合成cDNA的步骤参照PrimeScript® RT reagent Kit With gDNA Eraser试剂盒(TaKaRa,大连)使用说明书.扩增方法按照SYBR® Premix Ex TaqTM II(Perfect Real-Time)实验手册进行.反应条件为:95 ℃5 min,95 ℃15 s,60 ℃30 s,72 ℃20 s,重复40个循环.以β-actin为内参,通过2-ΔΔCT计算得出相对表达水平.
-
1) 探针的制备.以F2,R2为上下游引物,以上述逆转录的cDNA为模板进行PCR扩增,扩增程序:95 ℃预变性5 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 50 s,循环36圈,72 ℃延伸7 min.目的片段的回收纯化步骤参照BioSpin Gel Extraction Ki t(Bioflux,杭州)的操作说明书进行.然后将回收后的PCR产物与pGEM-T easy克隆载体进行连接,并进行亚克隆扩大培养和测序验证.以测序验证后的质粒为模板,用通用引物M13F和F2进行PCR扩增,扩增参数:95 ℃预变性5 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 50 s,循环36圈;72 ℃延伸7min,12 ℃保存.最后电泳,切胶回收.以回收的DNA为模板,采用MEGAscriptTM T7 Transcription Kit(美国,赛默飞公司)体外转录出探针,放置于-80 ℃备用.
2) FISH步骤.预处理:①固定.将所取材料放在4%多聚甲醛中,在室温放置2~3 h. ②脱水.将固定好的材料依次放入梯度酒精中脱水. ③包埋.二甲苯透明(30 min×3,具体视材料而定,直至材料完全透明为止);石蜡浸润(30 min×3). ④切片和展片.组织切片厚度为5 μm,用无酶水展片,置于37 ℃烘片机上干燥过夜.
脱蜡:①将预先处理好的石蜡切片进行二甲苯脱蜡. ②梯度酒精复水.
蛋白酶K处理:①每个染色缸40 mL蛋白酶K消化溶液. ②37 ℃水浴槽中预热染色缸和蛋白酶K溶液20 min. ③1XSSC在室温下漂洗. ④梯度酒精脱水.
变性:①每一个立式染色缸配置40 mL变性溶液. ②80 ℃水浴槽中平衡预热混合液染色缸. ③80 ℃孵育8 min.
杂交:①准备探针. ②加10 μL探针在组织切片上,加盖玻片. ③43 ℃预热杂交后水洗切片15 min. ④60 ℃孵育12~16 h. ⑤2xSSC漂洗. ⑥从1XPBS中取出切片,每张切片加入60 μL抗地高辛抗体,加盖塑料膜孵育20 min. ⑦1XPBS室温下洗3次,每次2 min;细胞核染色,拍照观察.
1.1. 实验鱼
1.2. 实验方法
1.2.1. LncRNA测序及其靶基因的生物信息学分析
1.2.2. 雌、雄性腺中TCONS_02477925的转录组分析及Real-time PCR验证
1.2.3. 荧光原位杂交(Fluorescence in situ hybridization, FISH)
-
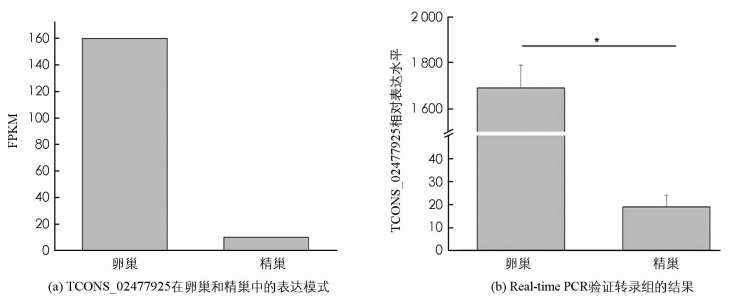
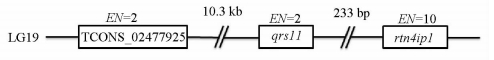
本研究发现,LncRNA(TCONS_02477925)基因定位于LG19上,具有2个外显子,其转录本全长为1 537 nt(图 1).生物信息学预测发现,qrsl1和rnti4p1分别位于TCONS_02477925下游10.3K和10.5K位置的2个基因座上.因此上述2个基因可能是该LncRNA的cis靶基因,并且qrsl1和rtn4ip1都位于LG19上. qrsl1具有12个外显子,转录本全长为1 735 nt,而rtn4ip1具有10个外显子,转录本全长为1 666 bp(图 1).
转录组的结果表明,卵巢中TCONS_02477925的表达水平远高于精巢(图 2-a). Real-time PCR数据进一步表明,该基因在卵巢中的表达水平显著高于精巢(图 2-b),暗示该LncRNA可能在卵巢分化和功能维系中发挥重要作用.荧光原位杂交结果显示,TCONS_02477925仅在卵巢中表达,并且主要表达在I-II时相的卵母细胞的细胞质中(图 3),在精巢中未检测到表达(未展示).
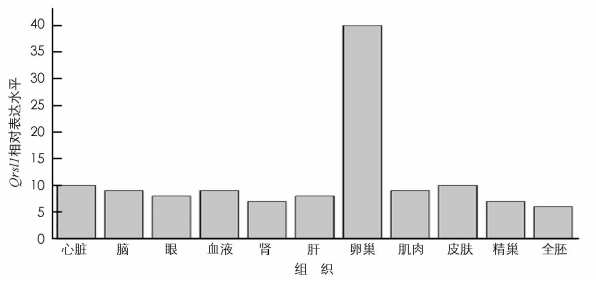
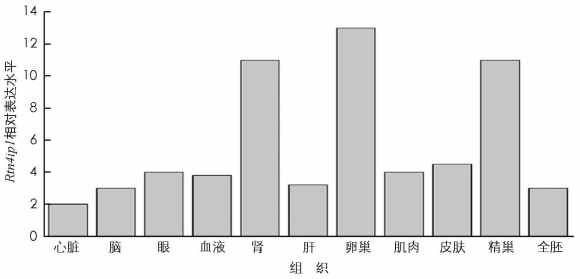
TCONS_02477925的cis靶基因之一qrsl1 (glutaminyl-tRNA amidotransferase subunit A,编码谷氨酰胺转移酶,作用是参与谷氨酰胺与tRNA的结合反应),依据本实验室测得的罗非鱼不同组织转录组数据发现,虽然qrsl1在罗非鱼中是一个泛表达的基因,但在卵巢中的表达水平远远高于其它组织(图 4). TCONS_02477925的另一个靶基因rtn4ip1 (reticulon 4 interacting protein 1,编码一种线粒体蛋白质)参与细胞内吞噬和胞吐作用、血管重建,以及β肽加工和分泌调控等功能[18].从转录组数据中发现rtn4ip1在肾、卵巢和精巢中的表达水平都比较高,在其它组织中的表达水平相对较低(图 5).这些数据初步表明,LncRNA可能是通过作用于上述靶基因影响卵母细胞的发育从而影响鱼类的性别分化.
-
近年来,随着高通量测序技术的发展,转录组测序技术打破了传统的单基因研究模式,在性别决定与分化研究领域得到了广泛应用.在哺乳动物的卵子发生过程中,对卵丘细胞、卵丘卵母细胞复合体测序结果发现了大量差异表达的LncRNA.同时,在减数分裂过程中,LncRNA在精母细胞中大量表达[19].有报道显示,LncRNA对雌性黑腹果蝇(Drosophila melanogaster)发育的性别致死基因具有一定的调控作用.多方面研究表明,LncRNA对于脊椎动物的性别决定和性腺发育有着重要作用[20].本课题组采用转录组测序,在罗非鱼雌、雄性腺获得了一系列高水平表达的LncRNA基因.其中TCONS_02477925在卵巢中的表达水平要远高于精巢中的表达水平.同时,TCONS_02477925的cis靶基因qrsl1和rtn4ip1在卵巢中高表达,这暗示着TCONS_02477925可能是通过调控qrsl1和rtn4ip1的表达从而调控卵母细胞的生长.后期,本课题组将通过分别敲除TCONS_02477925(TCONS_02477925),及其靶基因qrsl1和rtn4ip1,进而研究TCONS_02477925及这2个靶基因在罗非鱼卵母细胞发育以及性别分化中的作用.



 下载:
下载: