-
随着制造、冶炼、采矿和电镀业的发展, 重金属离子进入环境增多, 不仅污染地下水和土壤, 而且因其难降解、易积累, 可能通过食物链危害人类健康.据全国土壤环境质量公报(2014)显示[1], 全国耕地点位超标率达19.4%, Pb和Cd均为主要污染元素.人们对单一重金属污染研究较多, 但土壤重金属多以复合污染存在.复合污染不等同于单一污染的叠加, 会改变重金属的毒性和生物活性, 且不同元素之间可能存在交互作用, 比单一污染更为复杂[2]. Pb和Cd毒性强, 分列重金属潜在毒性Ⅰ类第4位和第2位[3], 达到一定浓度后会抑制植物生长、降低光合效率和影响机体代谢等[4].植物修复对环境扰动小, 能大面积实施且不易引发二次污染, 已被广泛应用于土壤重金属修复.目前植物修复研究大多集中于超积累植物或草本植物, 对寿命长、生物量大、根系发达的园林树木的研究鲜有报道.
秋枫为西南地区常见的园林绿化树种, 抗性强、生长速度快、适应范围广.本试验以秋枫幼苗为材料, 采用土壤盆栽法研究秋枫对Pb和Cd复合污染的耐受及累积特性, 为秋枫应用于Pb和Cd污染土壤的修复提供理论依据和技术参考.
全文HTML
-
试验材料为秋枫一年生实生苗, 供试土壤采集于西南大学农场.供试土壤的基本理化性质为: pH 6.51、有机质1.54%、全氮0.807 g/kg、速效氮68.3 mg/kg、速效磷65.2 mg/kg、速效钾230.4 mg/kg、总Cd 0.17 mg/kg、总Pb 17.6 mg/kg.
-
2018年2月将秋枫种子(采自西南大学校园)于温室内播种, 3月选取长势基本一致的幼苗移至装有供试土壤5 kg(干质量)的塑料盆中, 每盆种3株, 盆下垫托盘, 常规管理.
-
待幼苗恢复生长60 d后, 以Pb(CH3COO)2·3H2O和CdCl2·2.5H2O配制不同质量比的Pb+Cd溶液进行一次性土壤浇灌.根据《土壤环境质量农用地土壤污染风险管控标准》[5], 设置土壤外源Pb+Cd质量比(mg/kg)为: Pb 0+Cd 0, Pb 500+Cd 1, Pb 500+Cd 50, Pb 1500+Cd 1, Pb 1500+Cd 50, 共5个处理, 每盆种3株, 每个处理重复5盆.
-
处理前及处理30, 60, 90 d后测定幼苗株高、地径, 处理10, 20, 30, 40 d后采用丙酮-乙醇混合提取法测定叶绿素质量比, 硫代巴比妥酸法测定丙二醛(MDA)摩尔质量浓度, 考马斯亮蓝法测可溶性蛋白质量比, 氮蓝四唑法测定超氧化物歧化酶(SOD)活性[6].处理90 d后收获、洗净材料, 烘干至恒质量, 测定地上部、根部生物量(干质量)和Pb及Cd质量比[7].
-
采用Microsoft Excel 2003和SPSS16.0进行数据处理与分析, 采用Origin 2017进行图表制作.
转移系数(translacation factor)=植物地上部重金属质量比/植物根部重金属质量比
1.1. 试验材料
1.2. 试验方法
1.2.1. 幼苗培育
1.2.2. 试验处理
1.3. 测定指标
1.4. 数据处理与分析
-
2.1.1土壤Pb和Cd复合胁迫对秋枫幼苗株高净生长量的影响
如表 1所示, 重度Pb和Cd复合胁迫使秋枫株高净生长量增长受抑制, 处理90 d时, Pb 1500+Cd 50处理组株高净生长量较对照降低了39.3%, 差异极具有统计学意义(p < 0.01); Pb 1500+Cd 1处理组较对照增加了14.4%, 但差异不具有统计学意义; 其余处理组受影响较小.
-
如表 2所示, Pb 1500+Cd 1胁迫对秋枫地径净生长量增长具有促进作用, 且随时间的延长促进效果更明显, 胁迫90 d时, 比对照增加了27.2%, 差异极具有统计学意义(p < 0.01). Pb 1500+Cd 50处理组地径净生长量增长受抑制, 随时间延长受抑制作用减缓, 90 d时较对照降低了20.1%, 差异极具有统计学意义(p < 0.01), 其余处理组与对照差异不具有统计学意义.
-
如表 3所示, Pb 1500+Cd 50胁迫抑制了秋枫生物量的积累, 地上部、根部和总生物量分别比对照下降了49.9%, 41.8%和43.5%, 差异极具有统计学意义(p < 0.01).其余处理组各部分生物量和总生物量均未受明显影响.
-
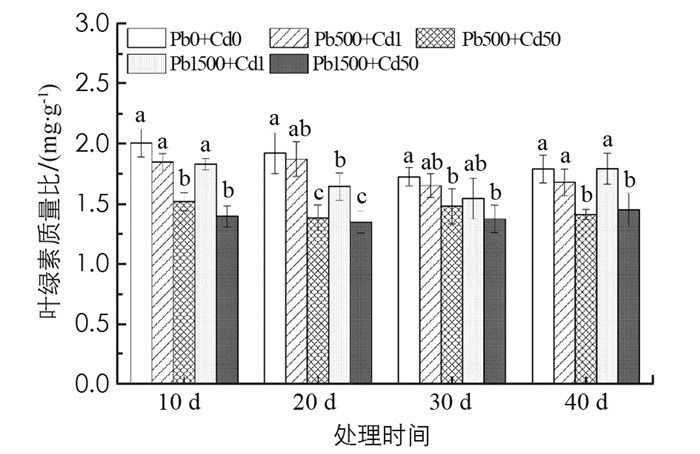
如图 1所示, Pb和Cd复合胁迫使秋枫叶绿素质量比下降, Pb 500+Cd 50和Pb 1500+Cd 50处理组下降更明显, 胁迫40 d时, 分别比对照下降了21.1%, 18.9%, 差异具有统计学意义(p < 0.05). Pb 500+Cd 1和Pb 1500+Cd 1处理组较对照稍有降低, 但差异不具有统计学意义, 说明重度Cd对叶绿素的影响更大.
-
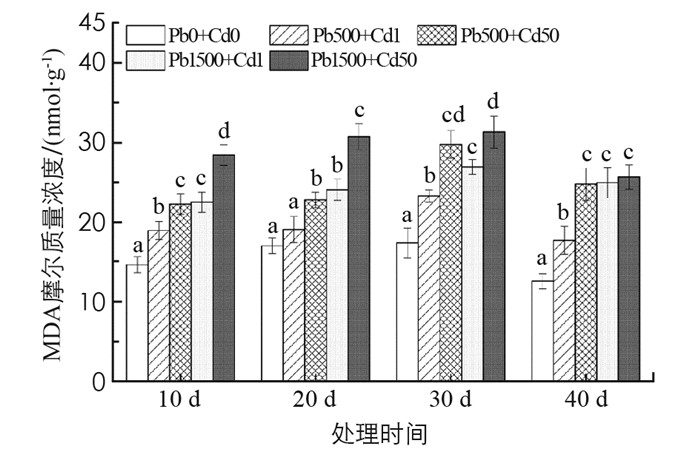
如图 2所示, 随Pb或Cd质量比的增加, 秋枫MDA摩尔质量浓度上升, 但随时间的延长又稍有下降趋势.处理组MDA摩尔质量浓度均显著高于对照, Pb 1500+Cd 50处理组最高, 胁迫20 d时, 是对照的1.81倍; 40 d时, 为对照的2.04倍, 差异具有统计学意义(p < 0.05).
-
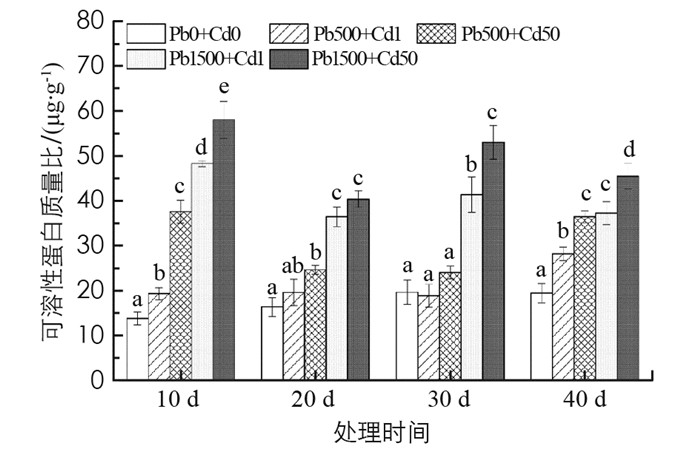
由图 3可知, 秋枫可溶性蛋白质量比随外源Pb或Cd浓度的增加不断上升, 随时间的延长与对照间差异变小. Pb 1500+Cd 50处理组最大, 在10, 20, 30, 40 d时分别为对照的4.22, 2.47, 2.70, 2.34倍, 差异具有统计学意义(p < 0.05).
-
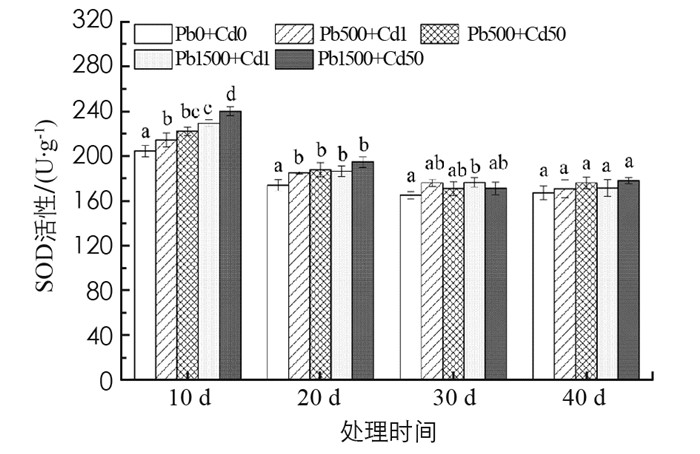
如图 4所示, 在处理10 d时, 秋枫各处理组SOD活性均高于对照, 且随外源Pb和Cd的增加不断增大, Pb 1500+Cd 50胁迫时呈现最大, 比对照上升了17.4%, 差异具有统计学意义(p < 0.05).随时间的延长, 处理组SOD活性趋于稳定, 各处理与对照间差异不具有统计学意义.
-
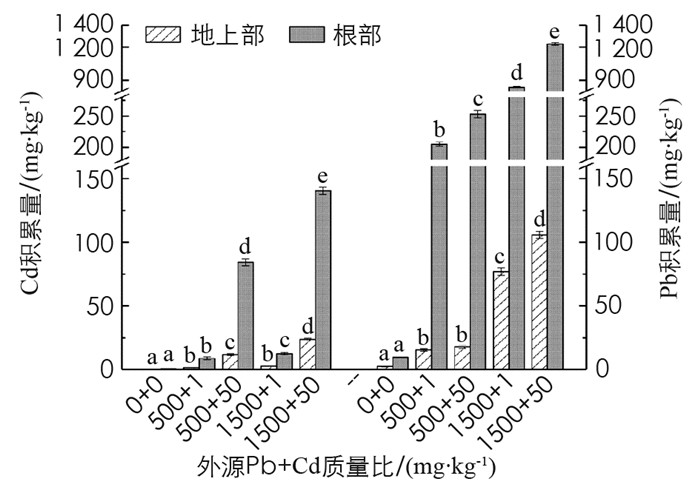
由图 5可知, 外源Pb或Cd浓度增加, 秋枫地上部和根部Pb和Cd积累量也随之增加, 且表现为根部高于地上部. Pb 1500+Cd 50处理组地上部Pb和Cd积累量分别达到105.68和23.49 mg/kg, 根部Pb和Cd积累量分别达1229.36和140.37 mg/kg.在相同Cd质量比下增加Pb, 秋枫地上部和根部Cd积累量增加; 同样, 在相同Pb质量比下增加Cd, 秋枫体内Pb富集量增加, 说明秋枫对Pb和Cd元素的吸收具有协同效应.
-
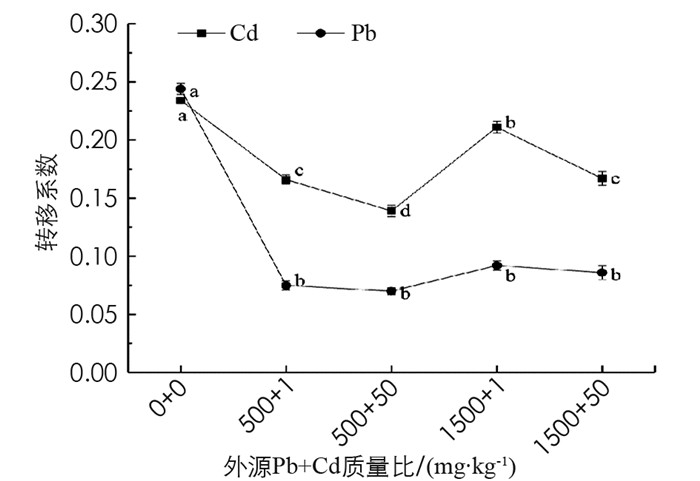
如图 6所示, 秋枫各处理组对Pb的转移系数在0.07~0.092之间, 相互间差异不具有统计学意义; 对Cd的转移系数在0.139~0.211之间, 相同Pb质量比下, 随外源Cd质量比增加秋枫对Cd的转移能力下降; 相同Cd质量比下增加Pb, 秋枫对Cd的转移系数增大, 说明外源Pb促进Cd向地上部转移.
2.1. 土壤Pb和Cd复合胁迫对秋枫幼苗生长的影响
2.1.2. 土壤Pb和Cd胁迫复合对秋枫幼苗地径净生长量的影响
2.1.3. 土壤Pb和Cd复合胁迫对秋枫幼苗生物量的影响
2.2. 秋枫幼苗对土壤Pb和Cd复合胁迫的生理响应
2.2.1. 土壤Pb和Cd复合胁迫对秋枫幼苗叶绿素质量比的影响
2.2.2. 土壤Pb和Cd复合胁迫对秋枫幼苗MDA摩尔质量浓度的影响
2.2.3. 土壤Pb和Cd复合胁迫对秋枫幼苗可溶性蛋白质量比的影响
2.2.4. 土壤Pb和Cd复合胁迫对秋枫幼苗SOD活性的影响
2.3. 秋枫幼苗对Pb和Cd的累积转移
2.3.1. Pb和Cd复合胁迫下秋枫幼苗对Pb和Cd的累积
2.3.2. Pb和Cd复合胁迫下秋枫对Pb和Cd的转移
-
本研究中秋枫在Pb和Cd同时达到重度胁迫时株高、地径净生长量和总生物量等均呈现一定程度的降低, 其余处理受影响较小.总体看来秋枫受Cd的影响大于Pb, 可能是Pb在植物体内多以沉淀形式存在, Cd在细胞内的毒性更大[8].本研究中复合胁迫均导致叶绿素质量比下降, 也许是因为Pb和Cd进入植物体抑制了相关酶类或破坏叶绿体结构, 干扰叶绿素合成, 也有研究表明重金属进入植物体内使叶绿素酶活性升高从而加速叶绿素降解[9].已有研究发现[10-12], 植物遭受逆境胁迫时MDA摩尔质量浓度、可溶性蛋白质量比和SOD活性等均呈现一定程度的升高, 这与本研究结果一致.
秋枫对Pb和Cd累积均表现为根部高于地上部, 这与目前大多数研究结果相同[4, 13].共存重金属元素影响着植物对重金属的吸收迁移, 但目前关于Pb和Cd的交互作用由于供试材料和条件不同并未得出一致结论[14].本研究中秋枫对Pb和Cd的吸收表现出一定的协同作用, 这与鲁艳等研究结果一致[12].外源Cd增加, 秋枫对Cd的转移能力下降, 可能是Cd质量比过高, 影响植物正常生长, 从而抑制Cd向地上部转移.而增加外源Pb, 秋枫对Cd的转移能力上升可能是Pb取代根中滞留的Cd从而促进Cd向地上部转移[15].
-
1) 秋枫对Pb和Cd复合胁迫的耐受性较强, 在外加Pb 1500+Cd 50(mg/kg)时才表现出生长受抑;
2) 秋枫对Pb和Cd的积累量表现为根部高于地上部, 随外源Pb和Cd浓度增加而增加; 两种元素间具有明显的协同作用. Cd促进秋枫吸收富集Pb, Pb亦有利于Cd的积累;
3) 秋枫对Cd的转移能力强于Pb, 且转移Cd能力随外源Cd增加而下降, 随外源Pb的增加而增强.



 下载:
下载: