-
近年来, 工业三废的大量排放、大气沉降、污水灌溉、农药和肥料的不合理使用造成了严重的土壤重金属污染[1]. 2014年国家发布的《全国土壤污染状况调查公报》[2]指出, 镉的点位超标率达到7.0%, 在8种无机污染物中居最高, 是目前污染最严重的重金属之一.镉具有很强的致癌致畸作用和生物累积效应, 能够引发骨痛病、肝脏损伤[3], 潜在威胁人体健康.植物修复是生物修复的一种, 它与传统的物理、化学修复相比具有成本低、不破坏土壤、不引起二次污染的优点.而木本植物与草本相比生物量大、寿命长, 具备良好的环境生态效应, 其可以将重金属累积在根、茎内, 收获的木材可用作家具、建材, 避免重金属再进入食物链.
楝(Melia azedarach)为楝科、楝属落叶乔木, 其生长速度快, 对土壤要求不严, 木材易加工[4], 同时能大量吸收有毒有害气体, 是优良的城市及矿区绿化树种[5].梧桐(Firmiana platanifolia)是梧桐科、梧桐属落叶大乔木, 其树形优美、寿命长、生长速度快, 对多种有害气体有较强耐性, 是优良的矿区绿化[6]及农田防护林速生经济树种[7].康薇等[8]对矿区植物调研发现, 苦楝、梧桐对土壤镉的平均富集系数大于1, 具备优良的土壤镉修复潜力.
本研究以苦楝、梧桐1年生幼苗为试验材料, 通过盆栽试验的方式, 从形态特征、生物量、生理响应、重金属累积分配等方面探究2个树种对不同程度土壤镉污染的耐性及富集能力差异, 以期为筛选具优良土壤镉修复潜力的树种用于植物修复提供参考.
全文HTML
-
以1年生楝、梧桐幼苗为试验材料.种子于2017年10月采集于西南大学校园内, 干藏至来年3月[9], 50 ℃温水浸种催芽、播种. 5月挖取长势一致的幼苗(株高约15~20 cm), 移栽至底部带托盘的营养钵中(直径28 cm, 高20 cm), 每盆装紫色土5 kg(干质量), 移至西南大学农场遮阳网下培养1个月.
-
用CdCl2·2.5H2O(分析纯)配制不同浓度的CdCl2溶液各300 mL, 一次性浇入营养钵中, 渗出液反复回浇, 直到Cd2+与盆土均匀混合.施加重金属后2 d内不浇水, 在实生苗上方搭建雨棚以防止雨水的淋溶作用, 后期进行常规管理.参照《土壤环境质量标准GB15618—2018》设置1个对照组及3个镉处理组:轻度污染(1 mg/kg)、中度污染(10 mg/kg)和重度污染(50 mg/kg).每个处理3次重复(盆), 每盆3株.
-
处理90 d后收获植株, 用自来水洗净后, 再用蒸馏水冲洗3遍, 于105 ℃杀青30 min, 80 ℃恒温烘干至恒重, 称量地上部、根部及总生物量.将烘干材料研磨过1 mm筛, 硝酸-高氯酸混合消化后用Z-5000原子吸收分光光度计测定植株地上部、根部Cd含量[10].处理10 d, 20 d, 30 d, 40 d和50 d分别摘取幼苗功能叶, 采用丙酮乙醇混合液提取法[10]测定叶绿素质量分数, 硫代巴比妥酸法[10]测定丙二醛(MDA)含量, 氮蓝四唑法[10]测定超氧化物歧化酶(SOD)活性, 考马斯亮蓝法[10]测定可溶性蛋白含量.
采用Microsoft Excel 2007进行数据统计, SPSS.25进行方差分析及差异显著性分析, Duncan多重比较检验各处理间组与对照间是否具有显著差异性, 采用Orgin7.5进行图表制作.
1.1. 试验材料
1.2. 试验设计
1.3. 指标测定与数据分析
-
试验过程中, 轻、中度镉胁迫下, 楝、梧桐未出现明显的毒害症状.处理10 d后, 楝在重度镉胁迫下叶片褪绿发黄、叶脉扭曲, 随着时间的延长而逐渐缓解.梧桐在重度镉胁迫下叶片出现黑色病斑, 叶脉粗大呈红色, 叶柄发黑, 也随时间的延长而缓解.处理90 d后, 随镉浓度升高, 楝根长受到明显抑制, 根系变小, 梧桐全株未表现出毒害症状.
-
试验结果看出, 随重金属浓度升高, 楝、梧桐各部位生物量均先增大后减小, 除了梧桐根部, 均在轻度处理组达到峰值, 地上部生物量分别比对照(CK)增加了32.44%, 101.6%, 差异有统计学意义(p<0.01).重度镉胁迫下, 楝、梧桐各部分生物量小幅度降低. 90 d后, 梧桐各处理组总生物量增幅均大于楝, 体现出更强的镉耐性(表 1).
-
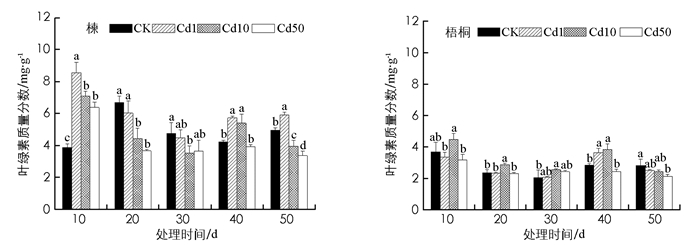
试验结果看出, 镉胁迫10 d, 楝各处理组叶绿素质量分数激增, 分别比CK高120.6%, 82%, 64.4%, 差异有统计学意义(p<0.05). 10 d以后, 重度处理组叶绿素质量分数均低于CK, 50 d降至最低.胁迫前40 d, 梧桐叶绿素质量分数随镉浓度升高而先增大后减小, 在中度(10 mg/kg)处理组升至峰值, 10 d比CK高21.74%(p<0.05).处理50 d胁迫程度加重, 梧桐叶绿素含量随镉浓度升高而递减(图 1).
-
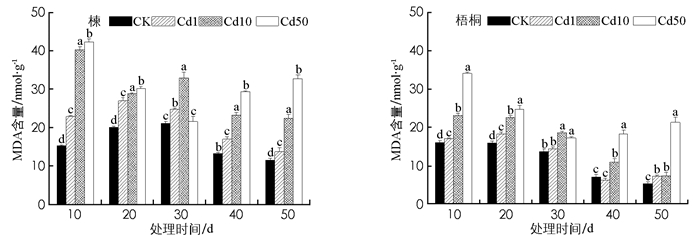
由图 2可知, 镉胁迫下, 楝叶片MDA含量增加, 整体随镉浓度升高而递增.各处理组MDA含量在10 d达到最大, 分别比CK增加了51.32%, 164.5%, 178.3%, 差异有统计学意义(p<0.05).随镉浓度升高, 梧桐MDA含量整体递增, 重度处理组在10 d时到达峰值, 为34.1 nmol/g, 为对照的2.13倍, 差异有统计学意义(p<0.01).
-
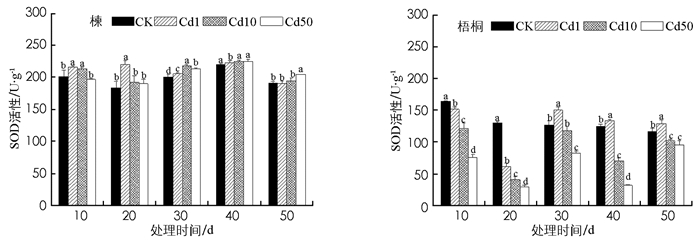
由图 3可知, 胁迫前20 d, 楝体内SOD活性随镉浓度升高而先升后降, 在轻度(1 mg/kg)胁迫下达到峰值, 20 d比CK高20.77%, 差异有统计学意义(p<0.05).镉胁迫前20 d, 梧桐SOD活性随镉浓度升高而降低, 后30 d轻度胁迫组SOD活性激增, 第30 d比CK高18.11%(p<0.05).
-
试验结果看出, 所有处理浓度下, 楝体内镉质量分数均表现为根部大于地上部;梧桐在重度处理组镉质量分数分布为根部大于地上部, 其他处理下为地上部大于根部.楝、梧桐各部位镉质量分数及单株富集量均随外源镉的升高而增大.楝、梧桐单株镉富集量分别在重度污染下达到162.590 mg和369.438 mg.除了轻度处理组, 梧桐单株镉富集量均大于楝, 说明梧桐在中、重度污染下对镉的富集能力强于楝.相同处理水平下, 梧桐的镉转移系数大于楝, 体现出更强的镉转运能力(表 2).
2.1. 土壤Cd2+胁迫下楝和梧桐1年生幼苗的形态学及生长特性
2.1.1. 形态学特征
2.1.2. 对各部位的生物量的影响
2.2. 土壤Cd2+胁迫下楝、梧桐1年生幼苗的生理耐性
2.2.1. 对叶绿素的影响
2.2.2. 对MDA含量的影响
2.2.3. 对SOD活性的影响
2.3. 楝、梧桐对重金属镉的富集特性
-
研究发现, 当植物体内镉含量超过临界值便会引起植物生长迟缓、根系发育受阻[11]、生物量降低[12], 甚至死亡.本试验中, 楝、梧桐的胁迫症状体现出2个树种对轻、中度镉污染有较强的耐性, 对重度镉污染有短期的敏感性及长期的耐受能力.生物量变化则说明2个树种均在10 mg/kg至50 mg/kg之间存在一个耐镉临界值, 胁迫浓度高出这个值植物生长受到抑制.
本试验中, 楝、梧桐在镉胁迫下叶绿素质量分数整体表现为先升后降, 与苹果幼苗[13]的研究结果一致.可能是低浓度镉的络合物促进了植物对于土壤中必需元素的吸收, 促进了卟啉环的合成, 增加了叶绿素质量分数[14], 而重度镉可能破坏了叶绿素生物合成途径相关酶结构[15], 导致叶绿素含量降低. MDA作为膜脂过氧化的产物, 其含量高低反应出细胞膜损伤程度.楝、梧桐在镉胁迫下质膜损伤加重, 与玉米[16]、洋甘菊[17]研究结果相似.
研究发现大多数植物通过将镉固定在根部, 限制其长距离运输, 降低对重要生理过程的干扰[18].本研究发现楝将大部分的镉累积在根部, 而梧桐在轻、中度镉胁迫下将大部分镉累积在地上部分, 体现出2个树种不同的镉累积策略.根据超富集植物的定义[19], 楝、梧桐均不是超富集植物.木本植物相比草本具有生物量大的优点, 因此可从单株富集量来评价2个树种的镉富集能力.梧桐的镉富集能力强于楝, 且具备较强的镉转运能力, 适用于重度镉污染土壤的植物提取或植物固定修复.楝对镉的单株富集量较大, 可用于植物固定修复.
综合来看, 楝、梧桐对土壤镉胁迫耐性较强, 轻、中度土壤镉污染对2个树种影响不大.梧桐对镉的长期耐性大于楝, 且具备更强的镉富集、转移能力, 适用于重度镉污染土壤的植物修复.
本试验采取盆栽试验, 能更真实地反映幼苗在自然生长条件下对镉的耐受富集特性, 但田间试验不可控因素较多, 譬如土壤理化性质、根际微生物的差异等, 影响了试验的准确性.而盆栽培养一定程度上限制了幼苗根系的生长, 影响幼苗总生物量的增长, 这有待进一步优化.本试验采用的材料是1年生幼苗, 培养时间较短, 仅能反映2个树种在遗传特性上对镉的耐受富集特性, 具有一定局限性.下一步研究可以采用多年生树种, 探究植物在不同年龄阶段对镉的耐受富集能力.



 下载:
下载: