-
世界环境问题日益突出,关于环境污染与保护成为当前研究的重点和热点. 地球上的纤维素生物质数量巨大,应用广泛且价廉,作为一种可再生资源,纤维素生物质可以有效缓解环境污染和能源危机,促进经济的可持续发展[1]. 我国每年纤维素资源的产量也十分庞大,木质纤维素在作物秸秆中含量丰富,“十二五”期间,我国秸秆理论总量从8.4亿t增至10.4亿t,但对它的利用却不高[2]. 纤维素在大自然中的降解速率非常缓慢[3]. 纤维素酶系可以有效水解纤维素,使其转化为葡萄糖,从而提高纤维素资源的利用率. 纤维素酶系主要分为3类:1)内切葡聚糖酶,也称为Cx酶;2)外切葡聚糖酶,又称为Ci酶;3)β-葡萄糖苷酶,也称为纤维二糖酶[4-5]. β-葡萄糖苷酶是组成纤维素酶系中的最重要的纤维素酶,对天然纤维素降解起着主导作用[6]. 它主要水解化合物末端的非还原性β-D-葡萄糖苷键,从而释放出β-D-葡萄糖和配基[7]. 它的酶活力高低直接影响到纤维素酶的总体酶活,对纤维素的降解十分重要. β-葡萄糖苷酶在自然界中存在的形式有很多种,微生物是其主要的存在形式之一,但是大多数β-葡萄糖苷酶的酶活较低[8]. 因此从微生物中筛选出高效产β-葡萄糖苷酶的菌株,对纤维素资源的利用有着十分重要的意义[9].
目前用于商业化生产和应用的β-葡萄糖苷酶大部分产自于真菌[10],其中对霉菌的研究最为广泛. 真菌以孢子生殖,容易被扩散和感染[11]. 细菌也能产β-葡萄糖苷酶,且存在范围十分广泛,但对细菌在这方面研究并不多. 细菌与真菌相比,繁殖速度快,抗逆性有所提高[12].
β-葡萄糖苷酶在常温下的酶解速率缓慢,在一些极端环境中降解更为艰难. 因此研究极端条件下β-葡萄糖苷酶活性更有意义,如耐高温耐碱的β-葡萄糖苷酶菌株比常温的更有优势[13],其优势在于耐高温耐碱的β-葡萄糖苷酶相比常温下的酶热稳定性更高,可以降低生产过程中的成本,减少能耗,同时也减少了生产过程中的杂菌污染[14]. 苏迪等[15]于2012年筛选获得1株有极高耐碱性的产β-葡萄糖苷酶的菌株CBG-08,该菌株在pH值为10,35 ℃时有最大酶活力,活性最高为48.9 U/mL. 李松等[16]于2015年分离到1株可在50 ℃,pH值为9.5的条件下分解纤维素的产β-葡萄糖苷酶的菌株(Bacillus sp.). Schröder C等[17]则在2019年重组β-葡萄糖苷酶Vul_Bgl1A,使其在105 ℃,pH值为7.0的条件下显示最高活性,在120 ℃下相对活性为61%,成为迄今为止最热活性的β-葡萄糖苷酶之一. 目前就发酵生产β-葡萄糖苷酶的参数优化这一方面在国内外学者的研究中引起一阵热潮. 优化β-葡萄糖苷酶发酵过程中的生产参数可以有效提高其产率,从而提高酶的降解速率. 我国学者彭利沙[18]于2016年发现1株产β-葡萄糖苷酶的绿色木霉GIM3.139,该菌株在80 ℃,pH值为6.16时具有最佳酶活力,耐酸碱稳定性好,通过单因素正交试验和响应面方法优化其发酵培养基和发酵条件,使β-葡萄糖苷酶酶活力较初始酶活力提高了144%. 国外研究相关人员Martins E D S等[19]于2019年分离到1株具有β-葡萄糖苷酶活性的嗜热真菌(Thermomucor indicae-seudaticae),其最大的酶活性在pH值为3.5~4.5,70 ℃下发生,通过对生产β-葡萄糖苷酶的发酵参数进行优化,使酶活性提高了120.0%.
白蚁肠道内细菌种类十分丰富,且数量惊人. 就目前而言,白蚁研究者从显微研究得到,低等白蚁和高等白蚁后肠中都存在着大量密度和形态不同的优势细菌. 现已从低等白蚁和高等白蚁后肠道中分离出多种异养型细菌,大部分为兼性厌氧菌,有的甚至是严格的好氧型细菌,包括肠杆菌(Enterobacteriaceae)、葡萄球菌(Staphylococcus sp.)、芽孢杆菌(Bacillus sp.)、拟杆菌(Bacteroids sp.)和链球菌(Streptococcus sp.)等,但白蚁肠道内的优势菌株因与其所共生的白蚁种类不同而有所差异[20-22]. 白蚁体内共生微生物具有高效消化纤维素食物的能力,为在白蚁中筛选分离纤维素降解酶提供了可靠依据.
本试验利用七叶苷平板从黑胸散白蚁肠道中筛选出产β-葡萄糖苷酶的菌株,通过选择培养对其耐受性进行研究,筛选出1株在60 ℃,pH值为8的高温碱性条件下也能高效分解纤维素的菌株BH1,并对它的产酶条件,如培养基、培养时间和温度等进行优化. 成果为以后相关学者对耐高温耐碱菌株的筛选鉴定和产酶条件优化这方面的研究提供了参考,白蚁体内共生微生物具有能够高效消化纤维素食物的能力,该成果也为在白蚁中探究降解纤维素机制提供了可靠依据.
全文HTML
-
白蚁由华中师范大学杨红老师研究团队友情赠送,为低等木食黑胸散白蚁.
-
筛选培养基:酵母膏1 g,蛋白胨2 g,七叶苷水解物0.2 g,柠檬酸铁铵0.5 g,琼脂4 g,蒸馏水200 mL,用稀硫酸溶液和氢氧化钠溶液分别将筛选培养基的pH值调至7,8,9,10,11,12.
LB培养基:酵母膏1 g,蛋白胨2 g,氯化钠2 g,琼脂4 g,蒸馏水200 mL,pH值为7.0.
对硝基苯酚-β-D-葡萄糖苷溶液(p-NPG),0.2 mol/L pH值为7.0的柠檬酸-磷酸氢二钠缓冲液.
-
取成年黑胸散白蚁25只,用75%乙醇消毒5 min,然后用无菌磷酸盐缓冲液(PBS)冲洗3次,去除头、胸部,在无菌操作台下取出肠道组织,匀浆后取菌液进行梯度稀释,吸取100 μL菌液涂布于筛选培养基上,将培养基放入恒温培养箱中,30 ℃倒置培养2~3 d,观察有无带有透明圈的黑色菌落的生成.
-
待平板上长出菌落后,将带有黑色透明圈的菌落分别接种在pH值为7,8,9,10,11,12共6个酸碱梯度的筛选培养基中,将接种不同pH的筛选培养基分别放置于温度为20 ℃,30 ℃,40 ℃,50 ℃,60 ℃,70 ℃的恒温培养箱中,并进行倒置培养2~3 d,观察是否产生带有透明圈的黑色菌落.
-
将接种环灼烧并冷却,挑取BH1的单菌落划线接种于LB固体培养基上,在30 ℃的恒温培养箱中,倒置培养24 h,观察耐高温耐碱β-葡萄糖菌株BH1单菌落特征,如大小、颜色、质地、边缘状态、表面状态等.
将上述所得到的BH1菌株的单菌落,用灭菌的牙签挑取于载玻片上,对BH1菌株进行革兰氏染色,经过初染、媒染、脱色、复染后,加以镜检并记录.
提取BH1菌株的基因组,用27 F和1 492 R引物扩增该菌株的16S rRNA序列,将其PCR产物送至上海生物有限公司进行纯化和测序. 拼接测序所得序列,并删去上下游引物前后序列,借助于NCBI中Blast功能,下载多个与菌株BH1序列同源性较高的序列,通过EzBioCloud软件进行多序列比对,之后借助于MEGA 7.0软件构建系统发育树.
-
分别取7支已高温灭菌过的试管并标上记号,按表 1分别加入0.5 mol/L的氢氧化钠溶液和0.1 mmol/L的对硝基苯酚溶液,充分混合均匀,并于室温下静置30 min,在可见分光光度计的400 nm波长下,用1号试管作为空白对照,将分光光度计归零,测定2-7号试管溶液的吸光值,并记录.
取活化后的菌株BH1,挑单菌落接种于5 mL LB液体培养基中,37 ℃,220 r/min恒温震荡培养12 h,以1∶100的比例转接于250 mL的LB液体培养基中,37 ℃,220 r/min恒温震荡培养,不同时间段于超净工作台吸取5 mL的发酵液,在高速离心机中8 000 r/min离心20 min,收集上清液. 用移液枪吸取0.1 mL上清液,加入0.9 mL的0.2 mol/L pH值为7.0的柠檬酸-磷酸氢二钠缓冲液,置于50 ℃水浴锅中加热10 min,然后立即加入1 mL预热10 min的5 mmol/L p-NPG溶液,室温静置10 min,计时结束后快速加入3 mL的0.5 mol/L氢氧化钠溶液终止反应,室温静置15 min,于紫外分光光度计400 nm处测定吸光值. 以经100 ℃沸水浴煮沸使β-葡萄糖苷酶活性失活的样品做空白对照.
β-葡萄糖苷酶酶活力:在上述反应条件下,以1 min内催化生成1 μmol对硝基苯酚所需的酶量为1个单位酶活力.
-
碳源的影响:采用控制变量法,保持培养基中其他条件不变,观察使用不同碳源对酶活力的影响.
氮源的影响:采用控制变量法,保持培养基中其他条件不变,观察使用不同氮源对酶活力的影响.
无机盐的影响:采用控制变量法,保持培养基中其他条件不变,观察使用不同无机盐对酶活力的影响.
pH的影响:pH会影响菌株的生长和发酵,通过设置不同pH梯度的溶液来观察不同pH对酶活力的影响.
温度的影响:温度会影响菌株的生长和发酵,通过设置不同温度梯度的溶液来观察不同温度对酶活力的影响.
正交试验:根据发酵培养基的优化结果,选取对BH1菌株产酶影响较大的5个因素,用试验中获得的结果取3个平均值,通过正交试验进行分析和处理.
-
参考文献方法[23],对耐高温耐碱β-葡萄糖苷酶进行分离纯化.
-
先对菌株进行发酵培养,然后取粗酶液25 mL,分别置于6个烧杯中,向烧杯中分别加入饱和度为30%,40%,50%,60%,70%,80%的硫酸铵溶液,室温静置一段时间后,在4 ℃,8 000 r/min的条件下离心20 min,取上清液测蛋白质的含量,从而得出最适合酶分离的硫酸铵饱和度,进而较大程度地除去杂蛋白质.
-
1) 取长度在10 cm左右的透析袋,放入NaHCO3溶液中加热煮沸约10 min,拿出用蒸馏水清洗干净,然后放到1 mmol/L的EDTA溶液中加热煮沸10 min.
2) 将样品装入透析袋中,用10 mmol/L pH值为6.0磷酸盐缓冲液在4 ℃的条件下透析1 d,用磁力搅拌器充分混合溶液,以便加快透析的效率. 在此期间,缓冲液每隔2~3 h更换1次,从而使样品的电导率低于2 ms/cm,使蛋白质能够在阳离子交换柱上结合.
-
1) 缓冲液和样品用0.45 μm的膜进行真空过滤处理,除去其中的不溶性颗粒.
2) 将柱子清洗干净并固定在铁架台上,加入去离子水,然后将柱子内的气泡赶净. 液面体积大约是柱体积的一半,轻轻搅拌柱材料使其混合均匀,混匀后先缓慢少量加入柱子中,当看到最下面有少量沉降层,再用玻璃棒引流缓慢加入柱材料,在整个过程中,速度不可过快,以保证有沉降层、上层水层、正在沉降层. 反应结束后盖上盖子,将上下导管连接在一起,将柱子和铁架台放在层析柜上,竖直放置过夜,让材料因为重力自然压实.
3) 在平衡柱子前,要充分洗净机器,保证不留杂质,并用去离子水清洗泵;先连接机器与柱子,用洗脱缓冲液平衡柱子,保持柱子充分平衡,以确保洗去杂蛋白. 然后用上样缓冲液洗脱,将柱子内的NaCl充分去后准备上样.
4) 流速控制为0.5 mL/min,直到出现穿透峰时结束上样. 然后用上样缓冲液将不结合的蛋白充分洗去.
5) 进行梯度洗脱,用梯度为20%,40%,60%,80%,100%的洗脱缓冲液进行洗脱,等到出现洗脱峰时收集样品.
6) 洗脱结束,用缓冲液多次冲洗柱子. 撤掉柱子,保存层析柜,用去离子水清洗A和B泵各15 min,流速为5 mL/min,以防被盐结晶堵塞导管. 若柱材料、柱子和机器长时间不用,应保存在20%的乙醇中.
-
用考马斯亮蓝G250法:预先把待测酶液稀释,并记录稀释倍数,然后将0.5 mL已稀释过的酶液加入到试管中,再加入2.5 mL考马斯亮蓝G250试剂,充分混匀,室温放置5 min,在595 nm处测定其吸光值.
-
聚丙烯酰胺凝胶电泳测定β-葡萄糖苷酶的分子量,并测定纯酶的活性及酶学性质.
1.1. 材料
1.2. 培养基与试剂
1.3. 产β-葡萄糖苷酶菌株的筛选分离
1.4. 耐高温耐碱β-葡萄糖苷酶菌株的复筛
1.5. 耐高温耐碱β-葡萄糖苷酶BH1菌株的鉴定
1.6. β-葡萄糖苷酶活力测定
1.7. BH1菌株的产酶条件优化
1.8. 耐高温耐碱β-葡萄糖苷酶的分离纯化
1.8.1. 硫酸铵分级沉淀
1.8.2. 透析去盐
1.8.3. DEAE-52柱层析
1.8.4. 蛋白质浓度的测定
1.8.5. 纯酶活性验证
-
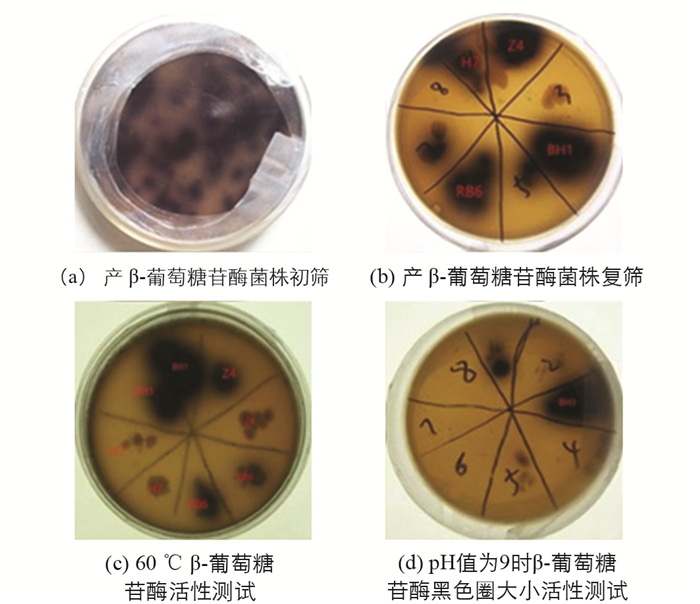
利用七叶苷与柠檬酸铁铵的显色反应,从白蚁肠道中共筛选出14株产β-葡萄糖苷酶菌株(图 1a). 通过复筛对比黑色透明圈的大小得到4株产酶活性较高的菌株,命名为BH1,Z4,H7,RB6(图 1b),分别对上述4菌株进行耐高温和耐pH性能试验. 先对这4菌株进行活化,挑取单菌落放到同一LB固体培养基平板上,分别置于20 ℃,30 ℃,40 ℃,50 ℃,60 ℃,70 ℃的恒温培养箱中,倒置培养24 h. 在60 ℃的培养条件下,只有BH1菌株黑色圈最大(图 1c). 同时对这4菌株进行活化,挑取单菌落放到不同pH值(7,8,9,10,11,12)的LB固体培养基平板上,分别置于37 ℃恒温培养箱中,倒置培养24 h. 在pH值为9的平板上,只有BH1菌株黑色圈最大(图 1d).
对这4菌株进行酶活对比,结果见表 2.
通过对上述4菌株进行耐高温和耐酸碱性能试验,发现BH1菌株具有耐高温耐碱的特性,所以选择BH1作为目的菌株进行研究,并对BH1菌株进行鉴定.
-
将BH1菌株在30 ℃条件下于恒温培养箱中倒置培养24 h后,对其单菌落进行观察,BH1菌株的单菌落形小近似圆形,灰色,表面较光滑,湿润,质地均匀,较黏稠,易挑取. 通过革兰氏染色进行观察,结果见图 2.
由图 2可以看出,BH1菌株通过革兰氏染色后,用生物显微镜进行观察,鉴定为革兰氏阳性菌,杆状(0.7~1.5 μm)×(1.6~4.0 μm).
-
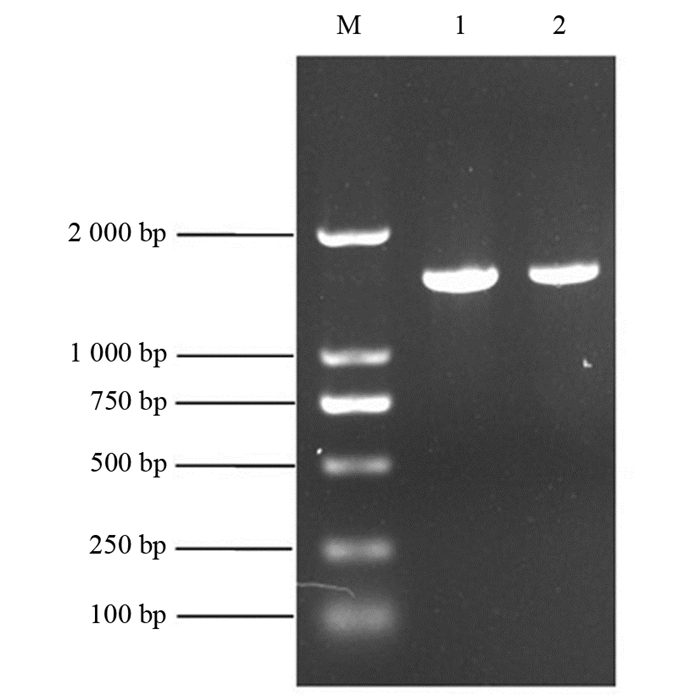
对BH1菌株的16S rRNA基因组进行扩增,用0.8%的凝胶进行核酸电泳检测,结果见图 3.
由图 3可以看出,BH1菌株的16S rRNA PCR扩增的长度约为1 600 bp.
-
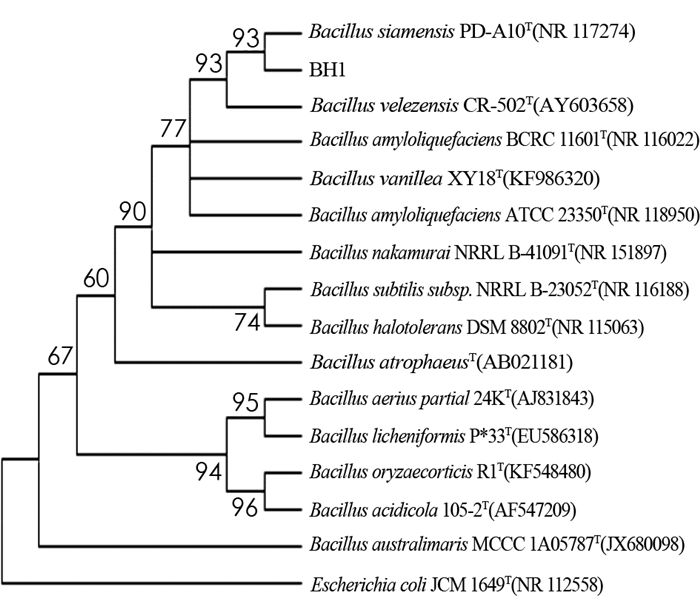
对BH1菌株的16S rRNA序列构建系统发育树,结果见图 4.
由图 4可以看出,BH1菌株的16S rRNA基因组扩增所测序列与BH1菌株同源性较高的序列进行比对,发现BH1菌株与标准菌株NR 117274(Bacillus siamensis)的同源相似性最高,达到99.73%.
通过对BH1菌株的形态学、生理学及16S rRNA序列比对分析,结果表明BH1菌株为革兰氏阳性菌,属于芽孢杆菌属(Bacillus sp.).
-
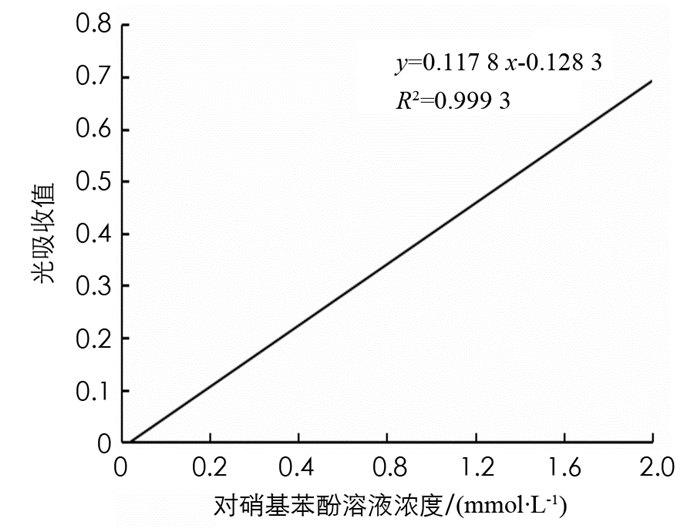
制备β-葡萄糖苷酶的酶活力标准曲线,横坐标为对硝基苯酚溶液浓度,纵坐标为光吸收值(400 nm),绘制标准曲线,结果见图 5.
由图 5可以看出,β-葡萄糖苷酶的酶活力测定标准曲线方程为y=0.117 8 x-0.128 3,R2=0.999 3.
-
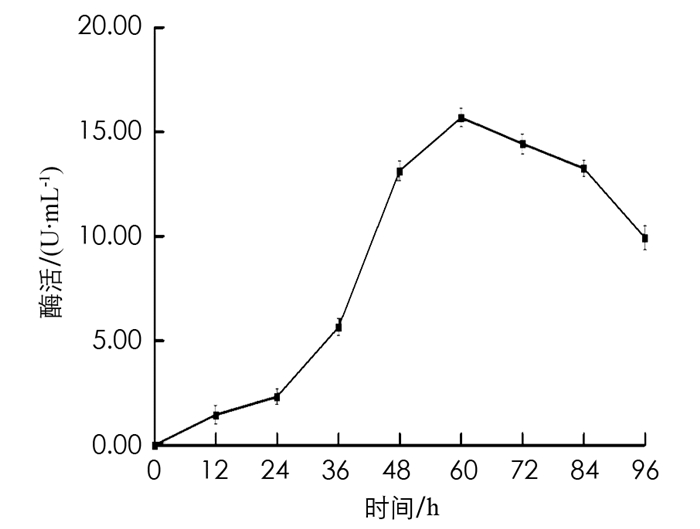
在初始发酵培养条件下,每间隔固定的时间取一次样,测定样品酶活力值,结果见图 6. 由图 6可以看出,当BH1菌株培养至60 h时,发酵液中β-葡萄糖苷酶的酶活力值最高,为15.6 U/mL.
-
将BH1菌株培养基的初始pH值分别调至3.0,4.0,5.0,6.0,7.0,8.0,9.0,在37 ℃,180 r/min条件下培养60 h. 取发酵液测定酶活力,结果见图 7. 由图 7可以看出,在发酵液的培养基pH值为8.0时,测得的BH1菌株酶活力值最大.
-
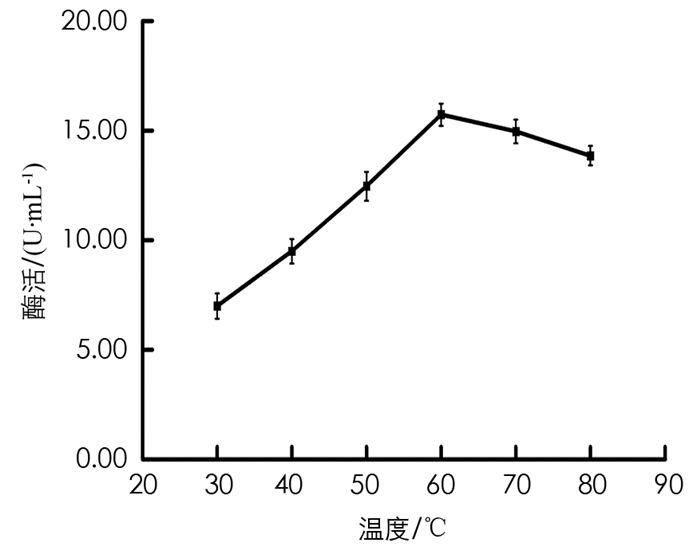
将BH1菌株培养基的初始温度分别调为30 ℃,40 ℃,50 ℃,60 ℃,70 ℃,80 ℃,180 r/min条件下,培养60 h. 取发酵液测定酶活力,结果见图 8. 由图 8可以看出,在发酵液的培养基温度为60 ℃时,测得的BH1菌株酶活力值最大.
-
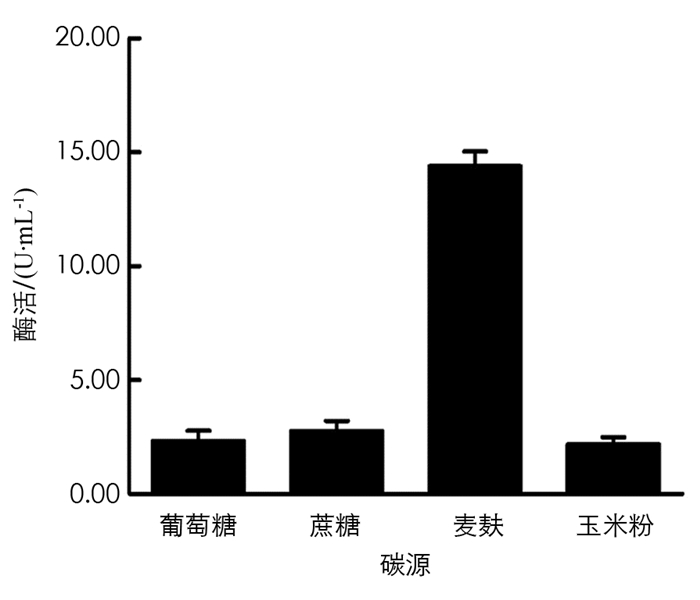
分别在初始培养基中用蔗糖、麦麸、葡萄糖、玉米粉作为碳源,保持其他条件不变,在37 ℃,180 r/min条件下培养60 h,取发酵液测定酶活力值,结果见图 9. 由图 9可以看出,麦麸是BH1菌株发酵产β-葡萄糖苷酶培养基中的最佳碳源.
-
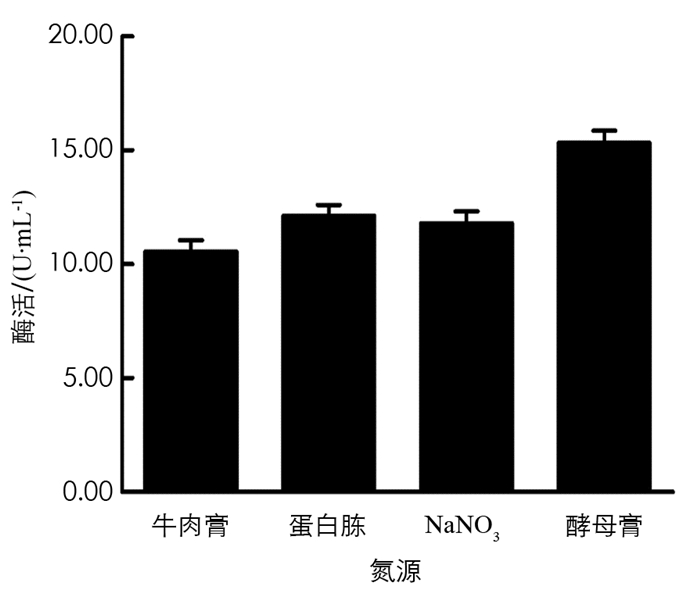
分别在初始培养基中用NaNO3、酵母膏、蛋白胨、牛肉膏作为氮源,保持其他条件不变,在37 ℃,180 r/min条件下培养60 h,取发酵液测定酶活力值,结果见图 10. 由图 10可以看出,酵母膏是BH1菌株发酵产β-葡萄糖苷酶培养基中的最佳氮源.
-
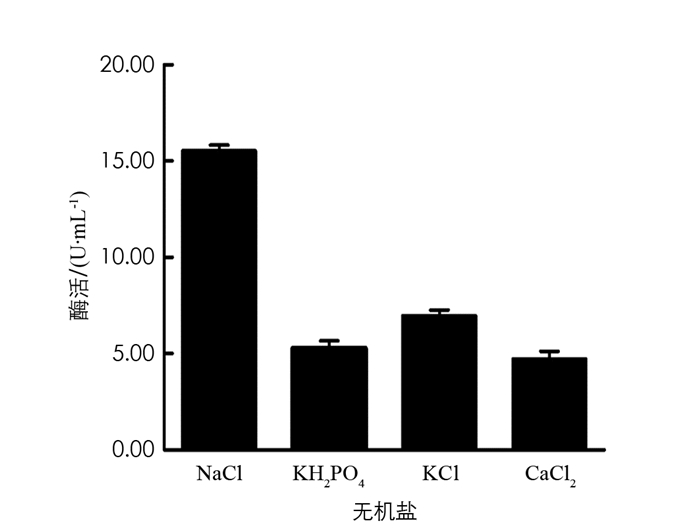
分别在初始培养基中添加0.2%NaCl,0.2%KH2PO4,0.2%KCl,0.04%CaCl2,保持其他条件不变,在37 ℃,180 r/min条件下培养60 h,取发酵液测定酶活力值,结果见图 11. 由图 11可以看出,NaCl是BH1菌株发酵产β-葡萄糖苷酶培养基中的最佳无机盐.
-
通过以上试验确定了最佳碳源、氮源、无机盐、初始pH值、温度,然后运用正交试验L9(34)对碳源、氮源、无机盐和初始pH的最佳配比等进行分析,试验设计见表 3,表 4. 250 mL三角瓶装液量20 mL、温度37 ℃、转速180 r/min作为不变条件.
表 4显示,4因素对β-葡萄糖苷酶活力的影响与单因素试验结果大致相同. 再由方差分析表 5可知,每个因素对β-葡萄糖苷酶活力的影响由大到小为碳源,初始pH值,无机盐,氮源,可见碳源对酶活力影响最大. 最优组合为A2B2C3D1,即当培养基中麦麸浓度为3%,酵母膏为1.5%,NaCl为0.10%,初始pH值为7.0时,对BH1菌株产酶最好.
对正交试验得出的结果进行进一步验证,设计单因素优化后的4个因素发酵产酶的最佳条件与正交试验后得出的结果进行对比,做3个平行取平均值,结果见表 6,得出发酵最优组合为A2B2C3D1.
-
在pH值为8.0,60 ℃及最佳培养基配方的条件下测定BH1菌株粗酶液的活性最高可达36.24 U/mL. 酶的热稳定性测试结果表明,在高于70 ℃时酶活仍在50%以上,该酶的热稳定性比其他大多数真菌来源的β-葡萄糖苷酶的酶活要高,进而也说明了该酶具有耐高温的特点. 酸碱稳定性测试结果表明,在pH值为9.0时,该酶的酶活仍保持在60%左右,并且稳定,从而进一步说明了该酶具有耐碱的特性,为该酶以后在碱性洗涤剂工业的应用上打下了坚实的基础.
2.1. 耐高温耐碱β-葡萄糖苷酶菌株的分离筛选
2.2. 耐高温耐碱β-葡萄糖苷酶BH1菌株的鉴定
2.2.1. BH1菌株的形态学鉴定
2.2.2. BH1菌株16S rRNA基因的扩增
2.2.3. 系统发育树的构建
2.3. β-葡萄糖苷酶活力测定
2.4. BH1菌株的产酶条件优化
2.4.1. BH1菌株培养时间对产酶条件的影响
2.4.2. BH1菌株培养基pH对产酶条件的影响
2.4.3. BH1菌株培养温度对产酶条件的影响
2.4.4. BH1菌株的发酵培养基主要成分优化
2.4.4.1. 不同碳源对产酶条件的影响
2.4.4.2. 不同氮源对产酶条件的影响
2.4.4.3. 不同无机盐对产酶条件的影响
2.5. 正交试验
2.6. 最佳条件下酶活及酶学性质测定
-
纤维素是一种可再生资源,在全球数量也十分巨大,β-葡萄糖苷酶可有效高速降解纤维素,促进纤维素资源的利用,减少浪费. 因此筛选耐高温耐碱的产β-葡萄糖苷酶的菌株应用前景广阔.
β-葡萄糖苷酶对pH和温度等条件的适应能力不强,在一些极端条件下,如高温、碱性等,菌种产的β-葡萄糖苷酶活性会降低甚至失活,并且产酶量也急剧下降,因此筛选出具有耐受性和酶活力高的菌株显得十分重要. 关于β-葡萄糖苷酶的耐受性和产酶方面的研究是目前国内外学者研究的热点. 我国学者Xu Z N等[24]在2016年发现Bacillus sp. ZJ1308产生的β-葡萄糖苷酶在pH值为6.0~8.0,80 ℃和90 ℃下表现出极高的热稳定性,通过响应面方法来优化培养基组成,在最佳条件下,β-葡萄糖苷酶的活性为4.71 U/mL. 国外研究人员Almeida J M等[25]于2015年利用绿色木霉在深层发酵中生产β-葡萄糖苷酶,通过应用中央复合设计和响应面方法优化生产工艺,β-葡萄糖苷酶活性提高了3.6倍.
目前同时在高温和碱性条件下对β-葡萄糖苷酶的研究不多. 本研究通过七叶苷与柠檬酸铁铵的显色反应分离出14株产β-葡萄糖苷酶的菌株,对其温度和酸碱度进行选择培养,筛选出1株可以在60 ℃,pH值为8.0的条件下存活且产β-葡萄糖苷酶活力较好的菌株BH1. 对BH1的菌种进行形态学鉴定,结合16S rRNA序列进行同源性序列比对分析,确定BH1的菌种为芽孢杆菌属(Bacillus sp.). 为有效提高其酶活力,本研究还对BH1菌种的产酶条件,如时间、温度和培养基等进行了优化,结果表明BH1菌种在发酵产酶过程中,培养基的最佳碳源是麦麸,氮源是酵母膏,无机盐是NaCl,最适培养时间为60 h,最适pH值为8.0,最适温度为60 ℃. 结果为以后相关学者对耐高温耐碱的β-葡萄糖苷酶菌株的研究提供了参考.



 下载:
下载: