-
开放科学(资源服务)标识码(OSID):

-
红棕象甲(Rhynchophorus ferrugineus)隶属于鞘翅目(Coleoptera)、象甲科(Curculionidae)、棕榈象亚科(Rhynchophorinae)和棕榈象属(Rhynchophorus),被列入19种林业检疫性有害生物名录[1]。该虫寄主种类众多,主要包括加拿利海枣(Phoenix canariensis)、椰子(Cocos nucifera)、槟榔(Areca catechu)、大王棕(Roystonea regia)、霸王棕(Bismarckia nobilis)等30余种棕榈科植物[2]。棕榈科植物是热带和亚热带地区广泛种植的一类经济林木和园林观赏树木,其中美洲和亚洲的热带地区为其主要分布中心[3]。这些植物不仅在园林绿化中具有重要的经济和观赏价值,而且在城市景观设计中扮演着不可或缺的角色。然而,作为一种外来入侵物种,红棕象甲对棕榈科植物构成了严重威胁,导致了重大经济损失和生态灾难[4]。根据覃伟权等[5]的研究发现,红棕象甲的入侵风险评估指数高达2.29,被列为高度危险的外来入侵生物。自20世纪80年代中期以来,红棕象甲已在全球范围内广泛传播。数据预测,红棕象甲将危害全球至少15%的椰子种植国和约50%的海枣种植国,部分沿海国家每年因防治及根除严重受害棕榈树所带来的经济损失最高可达869万美元[6]。红棕象甲的主要危害虫态为幼虫,它能钻蛀寄主的茎干,取食生长点及附近的柔软组织,逐渐在树干内形成深深的隧道,影响养分运输,导致流胶、组织坏死腐烂,并使寄主活力下降,产生特殊气味。若危害严重,可引起树干中空,最终导致植株死亡。由于没有明显的感染症状,尤其在感染的早期阶段,很难识别棕榈种植园中受感染的植株[7]。
目前,针对红棕象甲的防治措施面临诸多挑战。化学防治由于施药难度大、环境污染问题以及药剂难以直接接触虫体,效果并不理想。物理防治则受到环境因素的制约,例如,低湿度和强紫外线等都会影响诱杀效果[8]。相比之下,利用自然天敌进行害虫控制的生物防治手段,显示出较好的应用前景[8]。红棕象甲在个体生长发育过程中易受到细菌和真菌等病原体的感染。Gindin等[9]的研究发现,金龟子绿僵菌(Metarhizium anisopliae)对红棕象甲的控制效果优于球孢白僵菌(Beauveria bassiana),使用金龟子绿僵菌后,红棕象甲幼虫在6~7 d内的死亡率达到100%,卵的死亡率为80%~82%;淡紫色拟青霉(Paecilomyces lilacinus)能够从体节连接处的缝隙侵入虫体,导致虫体死亡,因此可以作为生物资源应用于红棕象甲的防控[10]。苏云金芽孢杆菌(Bacillus thuringiensis)能够显著降低红棕象甲幼虫的钻蛀活性,并减少其进食活动;二龄幼虫死亡率随着苏云金芽孢杆菌浓度增加而提高[11-12]。
然而,生物防治仍存在防治效果不稳定的问题,再加上幼虫和成虫活动范围较广,对一些天敌表现出负趋性,导致目前的生物防治效果并不显著。红棕象甲作为一种极具危害性的害虫,虽然其幼虫阶段为主要的危害时期,但针对虫卵开展防治工作的重要性同样不可忽视。在害虫生命周期的初始阶段,若能针对虫卵进行有效干预,便能从根源上遏制红棕象甲种群的繁殖。相较于幼虫等虫态,虫卵具有高度集中且尚未对寄主造成直接破坏的特性,此时采取防治措施,可避免后续因幼虫钻蛀树干导致的一系列严重后果(如植株生长受阻、树干内形成隧道甚至死亡等),从而减少棕榈科植物种植产业在经济和景观维护方面的巨大损失。此外,针对虫卵的防治可显著降低因大规模幼虫危害引发的化学防治强度,减少化学农药的使用量,这不仅有利于降低防治成本,还能最大程度减轻对生态环境的负面影响,保护生物多样性与生态平衡,为可持续的害虫管理策略构建关键的早期防御体系。
我国目前在害虫防控上仍主要采用化学防治手段,例如,将以氨基甲酸酯、苯基吡唑和新烟碱为主要活性成分的杀虫剂注入棕榈植物树干,以防治红棕象甲[13];然而,持续使用大量的化学药剂势必会使害虫种群逐步产生抗药性。已有证据表明,红棕象甲的田间种群已对毒死蜱、高效氯氟氰菊酯和吡虫啉等多种常用药剂产生抗药性;该虫在经过吡虫啉的7代选择后,其抗性倍数已达1 883倍,说明在持续的选择压力下,红棕象甲对吡虫啉的抗药性将导致化学杀虫剂失效[14]。这不仅大大削弱了害虫的防治效果,也在一定程度上降低了农林产品的质量安全水平,并污染了环境[15]。因此,害虫防治模式正逐渐由单一的化学防治转向以生物防治为核心的综合治理[16]。
本研究从室内饲养染菌的红棕象甲虫卵中成功分离并纯化得到1株病原细菌,发现该菌株对红棕象甲虫卵具有显著防治效果。通过形态学特征、16S rRNA序列分析以及生理生化特性对该菌株进行了鉴定,旨在为红棕象甲的生物防治提供新的菌株资源。此项发现有望为进一步开发高效环保的红棕象甲新型杀虫剂提供新的思路和途径。
全文HTML
-
红棕象甲成虫采集自福建省漳州市闽南师范大学(117.63°E,24.51°N)及江滨公园(117.66°E,24.51°N),使用安装在棕榈科植物上的漏斗形诱捕器进行采集,诱捕器距地面约1 m,诱芯每50~60 d更换1次。每隔48 h收集成虫并带回实验室进行饲养[17]。在实验室中,成虫根据性别配对,安置于植物组织培养瓶中,并提供新鲜甘蔗作为食物[18]。成虫产卵后,用毛笔挑取虫卵,随后转移至底部铺有湿润脱脂棉的培养皿中孵化[19]。孵化出的幼虫被转移至60 mm培养皿中,提供适量甘蔗块,随着幼虫成长,转移至更大的培养皿。成虫羽化后继续繁殖下一代。实验室的培养条件为温度(27±1)℃,湿度(75%±5%),光照周期(12 L∶12 D),其他虫态则在全黑暗条件下培养。实验所用的虫卵均来自室内饲养的成虫。
-
超净工作台、生化培养箱、人工气候箱、高压蒸汽灭菌锅、高速离心机、PCR仪、凝胶电泳仪、凝胶成像仪、恒温摇床、微量分光光度计、光学显微镜等。
-
(1) 营养琼脂(Nutrient Agar,NA)固体培养基:称取18 g NA培养基粉末,将其溶解于1 000 mL纯水中,121 ℃高压蒸汽灭菌20 min后,保存于4 ℃冰箱中备用。
(2) 营养肉汤(Nutrient Broth,NB)液体培养基:称取33 g NB培养基粉末,将其溶解在1 000 mL纯水中,121 ℃高压蒸汽灭菌20 min后,保存于4 ℃冰箱中备用。
(3) 1%琼脂糖凝胶:称取0.2 g琼脂糖与20 mL 1×TAE缓冲液,倒入100 mL锥形瓶中,使用微波炉加热40 s,冷却后添加1 μL核酸染料。该溶液需现配现用。
(4) 磷酸盐缓冲液(Phosphate Buffer Saline,PBS):称取7.9 g NaCl、1.8 g K2HPO4、0.24 g KH2PO4、0.2 g KCl,将其溶解在800 mL蒸馏水中,用HCl调节溶液的pH值至7.4,补加蒸馏水至1 L。将溶液保存于4 ℃冰箱中备用。
-
收集实验室中感染病原细菌的红棕象甲虫卵作为实验样本,在超净工作台上使用无菌接种环采集虫卵上的病原菌脓液,并通过平板划线法将其接种至NA固体培养基表面。接种后,将培养皿置于25 ℃的恒温生化培养箱中初步培养10 h[20]。培养结束后,使用接种环从培养皿上挑取单个菌落进行连续4次分离纯化,最终获得纯培养的细菌分离株。对这些纯培养的分离株在NA培养基上形成的菌落进行形态学观察,记录菌落的大小、色泽、形状、边缘特征、隆起程度、质地和透明度等特征。使用甘油保藏法[21],将菌株保存于-80 ℃温度条件下,并命名为LL-2。
-
使用无菌接种环从NA固体培养基上挑取单个LL-2菌落,并将其接种至含有NB液体培养基的250 mL锥形瓶中。随后,将锥形瓶置于37 ℃的摇床中,以200 r/min的速度过夜培养12 h。培养完成后,使用移液枪吸取1 mL菌液并转移至1.5 mL的离心管中。接着,使用高速离心机以12 000 rpm的速度离心1 min,吸除上清液,留下细菌沉淀。按照北京索莱宝科技有限公司提供的细菌基因组DNA提取试剂盒说明书进行细菌基因组DNA的提取。
-
以菌株DNA为模板,采用由生工生物工程(上海)股份有限公司合成的细菌16S rRNA的通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′- GGTTACCTTGTTACGACTT-3′)扩增LL-2的16S rRNA全长序列。每个PCR反应体系为50 μL,其中DNA模板4 μL,10 μM的上游引物27F和下游引物1492R各2 μL,2×Taq PCR MasterMix 25 μL和ddH2O 17 μL。反应条件为:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共35个循环;最后72 ℃延伸10 min[22]。先取5 μL的PCR扩增产物进行1%的琼脂糖凝胶电泳,检测目的片段的条带和大小,然后将其送至生工生物工程(上海)股份有限公司进行测序。
-
根据测序结果,将LL-2菌株的16S rRNA全长序列提交至GenBank,并使用NCBI的BLAST工具进行比对,下载与目标序列具有高同源的序列。使用MEGA5.22软件的Multiple Sequence Alignment功能进行16S rRNA同源性分析,并采用最大似然法(Maximum Likelihood,ML)构建系统发育树。为评估系统发育树的稳定性,使用MEGA 5.22软件对发育树进行1 000次的Bootstrap分析。
-
分子生物学方法在细菌鉴定中存在一定局限性,因此参照《一般细菌常用鉴定方法》并结合菌株的生理生化反应,进一步对细菌进行分类鉴定[23]。采用革兰氏染色法[24],使用北京陆桥技术股份有限公司提供的革兰氏染色试剂盒对分离得到的LL-2菌株进行染色,并通过光学显微镜观察菌体细胞的形状、芽孢和大小等形态特征。LL-2菌株的生化试验使用杭州微生物试剂有限公司提供的细菌微量生化鉴定管进行。接种时,使用接种针从NA平板上挑取已分离纯化的LL-2菌株单菌落,接种至相应的鉴定管中,随后将其放置于(36±1)℃的生化培养箱中进行培养。各检测项目的培养要求及结果判别见表 1。
-
从室内饲养的红棕象甲种群中选择无损伤的新鲜虫卵作为供试样品,用PBS将LL-2菌株分别配制成1.0×105、1.0×106、1.0×107、1.0×108、1.0×109 CFU/mL的细菌悬浮液。在实验前,将虫卵放置于铺有无菌水浸润的医用脱脂棉的9 cm玻璃培养皿中,每皿均匀分布10粒虫卵。采用微量点滴法,将10 μL菌悬液均匀滴加至每粒虫卵表面,磷酸盐缓冲液(PBS)作为对照组。处理后,将虫卵置于(25±1)℃、湿度(75%±5%)、0 L∶24 D光照周期的温控环境中培养。每组处理10粒虫卵,重复3次,共30粒虫卵用于生物活性测定[25-26]。实验过程中,每日观察虫卵的感染情况,并记录染菌虫卵数,直至第7 d。染菌虫卵及时移除,以防交叉感染。使用Abbott(1925)公式计算校正死亡率,进一步进行毒力回归分析,得出致死中浓度(LC50)。同时,根据科赫法则对染菌虫卵再次分离病原菌,以验证所接种菌株的致病性。
-
数据整理使用Excel 2021,统计分析通过SPSS 23.0进行,显著性水平设为α=0.05。毒力回归采用probit模型,根据浓度和死亡率计算LC50。数据结果以“平均值±标准误(SE)”表示,不同浓度的死亡率和校正死亡率的差异用单因素方差分析(ANOVA)进行检验,多重比较采用Duncan法。
1.1. 虫源采集和饲养
1.2. 实验仪器与试剂
1.2.1. 主要仪器设备
1.2.2. 主要试剂配制
1.3. 虫卵病原细菌的培养与分离纯化
1.4. 细菌分离菌株的分子生物学鉴定
1.4.1. 细菌总DNA的提取
1.4.2. 细菌16S rRNA序列的扩增
1.4.3. 16S rRNA序列同源性比较
1.5. 细菌分离菌株的生理、生化鉴定
1.6. 细菌分离株对红棕象甲虫卵的生物活性测定
1.7. 数据处理与统计学分析
-
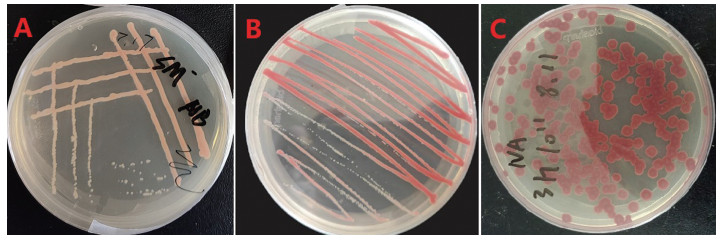
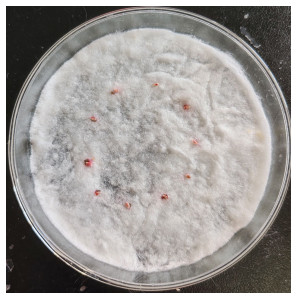
实验室饲养的红棕象甲虫卵在感染LL-2菌株后,最初未表现出明显变化,随后颜色由乳白色逐渐转变为粉红色,最终腐烂并有明显的菌脓溢出(图 1)。将感染菌株的虫卵接种至NA固体培养基上培养,观察到菌株形成不透明的粘稠液滴,菌落光滑、凸起,边缘不规则,呈近圆形,颜色由无色变为淡红色,并在25 ℃条件下培养10 h后显现出鲜红色(图 2)。
-
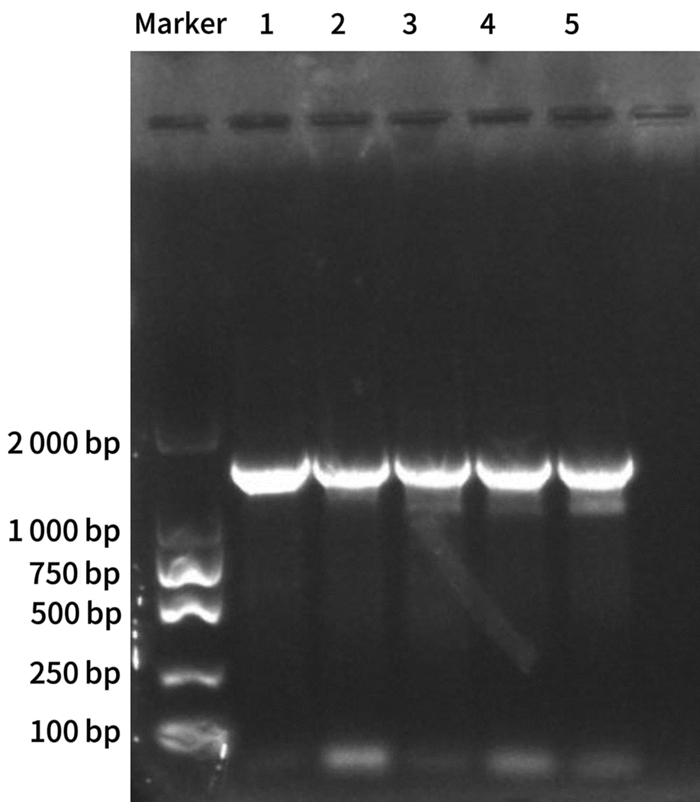
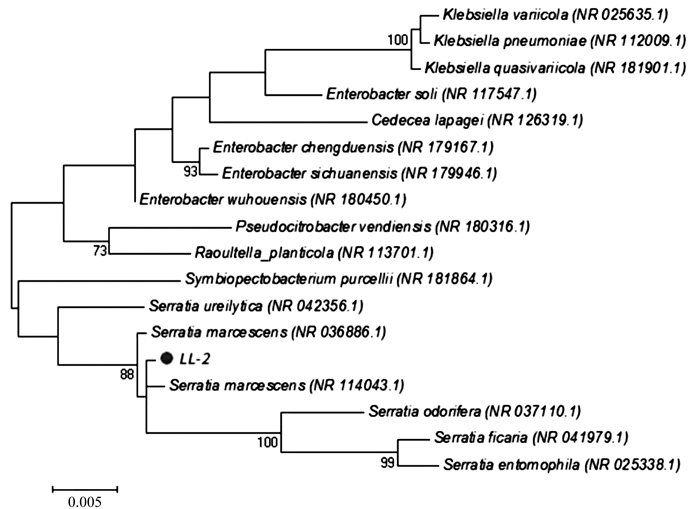
LL-2菌株的16S rRNA序列测定结果显示,扩增的DNA序列全长为1 447 bp,与预期目的片段大小一致(图 3)。将该序列通过GenBank的BLAST工具进行比对,选择与LL-2菌株同源性较高的若干模式菌进行系统进化分析。分析结果表明,LL-2菌株与粘质沙雷氏菌(Serratia marcescens)在一个簇群内,同源性高达99%以上(图 4)。
-
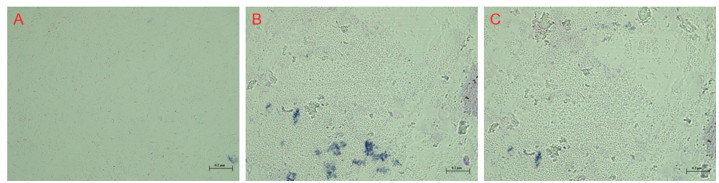
细菌分离株LL-2在培养基上的菌落呈红色、边缘不规则、形状近圆形且隆起、质地光滑且中心不透明。通过革兰氏染色后,在光学显微镜下观察菌体,发现该菌体呈红色、短杆状、无芽孢,大小为(1.2~1.5)μm×(0.7~1.0)μm,菌株为阴性菌,兼性好氧(图 5),其余生理、生化特性见表 2。参照《一般细菌常用鉴定方法》[23],最终确定该红棕象甲虫卵的病原细菌分离菌株LL-2为粘质沙雷氏菌。
-
红棕象甲虫卵的死亡率随着粘质沙雷氏菌LL-2菌株菌液浓度的增加而显著上升,不同浓度处理组之间的死亡率存在显著性差异(死亡率:F4,10=28.094,p<0.001;校正死亡率F4,10=28.945,p<0.001)。在自然状态下,红棕象甲虫卵的平均孵化率为83.33%。当使用1.0×105 CFU/mL的菌液处理虫卵时,孵化率降至60.00%;而使用1.0×109 CFU/mL的菌液浓度处理时,卵的平均校正死亡率可高达95.83%(表 3)。此外,LL-2菌株的毒力回归分析结果表明,菌液浓度的对数值与红棕象甲虫卵的死亡率呈现正相关关系。菌液浓度越高,红棕象甲虫卵的死亡率也随之升高。根据毒力回归分析结果,LL-2菌株7 d内对红棕象甲虫卵的LC50值为1.5×107 CFU/mL,表明粘质沙雷氏菌对红棕象甲虫卵具有较高的毒力(表 4)。
2.1. LL-2菌株感染红棕象甲虫卵后的症状与菌落特征
2.2. LL-2菌株16S rRNA序列测定及系统发育分析
2.3. LL-2菌株的形态特征和生理、生化特性
2.4. LL-2菌株对红棕象甲虫卵的致病力
-
近年来,红棕象甲虫的入侵对我国本土棕榈产业造成了严重威胁。为应对这一挑战,我国采取了检疫、物理、化学及生物等多种防治手段。然而,化学药剂的过度使用使得害虫种群的抗药性逐渐增强,进而对环境和生态系统造成了显著破坏。作为一种具有可持续控制潜力的防控手段,生物防治在减少药物残留和抑制害虫抗药性等方面展现出了优势。国内外研究主要集中于金龟子绿僵菌[9]、球孢白僵菌[9]、淡紫拟青霉[10]及苏云金芽孢杆菌[11]等生物防治资源的应用。本研究从室内饲养的染菌红棕象甲虫卵中分离得到1株粘质沙雷氏菌LL-2,研究结果表明,该菌株能够使虫卵的平均致死率达到95.83%。
国内外学者对真菌、细菌、病毒、线虫等昆虫病原体对害虫的毒力作用及其防控应用进行了广泛研究。目前,全球范围内关于红棕象甲生物防治的研究主要集中在病原菌对其幼虫的作用,而关于侵染红棕象甲虫卵的病原菌的研究相对较少。研究表明,粘质沙雷氏菌对红棕象甲四龄幼虫也具有较高的毒力,其LC50为1.2×107 CFU/mL[27]。本研究从室内饲养的自然染菌红棕象甲虫卵中分离得到LL-2细菌株。通过形态特征、生理生化特性以及16S rRNA序列比对分析,该菌株被鉴定为粘质沙雷氏菌。研究结果进一步证实了该菌株对红棕象甲虫卵具有较强的侵染能力,其LC50为1.5×107 CFU/mL,这表明粘质沙雷氏菌对红棕象甲幼虫和卵的毒力差异不显著。然而,关于该菌在这两个虫态中的致病机制及其在全变态发育过程中的保守性仍需进一步研究。
粘质沙雷氏菌是一种自然界中广泛分布的微生物,能够侵染多种昆虫,包括棉铃虫(Helicoverpa armigera)、小地老虎(Agrotis ipsilon)、粘虫(Mythimna separata)、菜青虫(Pierisrapae Linne)、马铃薯块茎蛾(Phthorimaea operculella)和草地贪夜蛾(Spodoptera frugiperda)等[28]。粘质沙雷氏菌对多种害虫的幼虫具有较强的致病力。例如,该菌对草地贪夜蛾3龄幼虫在72 h后的LC50为3.58×105 CFU/mL[29];对马铃薯块茎蛾处理后第3 d的LC50为9.784×1010 CFU/mL[30];其发酵液对桃小食心虫(Carposina sasakii)和梨小食心虫(Grapholitha molesta)的LC50分别为1.70×108 CFU/mL和4.00×108 CFU/mL[31]。根据袁梓涵等[32]的研究发现,粘质沙雷氏菌能够侵染亚洲玉米螟(Ostrinia furnacalis),对3龄幼虫具有强致病性,显著影响其生存和繁殖,其LC50为2.45×108 CFU/mL。此外,粘质沙雷氏菌对红棕象甲4龄幼虫也具有较高毒力,其LC50为1.2×107 CFU/mL[27]。然而,现有证据尚未表明粘质沙雷氏菌对害虫虫卵阶段的致病性。本研究首次发现,粘质沙雷氏菌对红棕象甲虫卵具有较高的侵染能力,其LC50为1.5×107 CFU/mL,这一发现为将该菌应用于田间生物防治提供了理论依据。
本研究发现,粘质沙雷氏菌对红棕象甲虫卵表现出较强的毒力,且其毒力随菌液浓度的增加而增强。粘质沙雷氏菌通过其分泌的各种代谢产物对寄主昆虫进行侵染,会导致昆虫出现败血症。沙雷氏菌的分泌物中包含蛋白酶和几丁质酶,这些酶类能够有效防治害虫;其中,几丁质酶通过破坏昆虫肠道的围食膜,导致肠上皮细胞结构畸形,从而产生毒害效果[33]。本研究分离获得的粘质沙雷氏菌LL-2菌株不仅对新的虫态具有较强的致病力,还突破了传统生物防治手段的局限,尤其是在白僵菌和绿僵菌等常用生防资源的基础上,提供了新的生物防治方案。此外,如果这些病原体能够成功侵染成虫,并与聚集信息素协同使用,将有助于抑制红棕象甲的种群在田间的发生和发展,为害虫的绿色防控提供新的思路[34]。然而,粘质沙雷氏菌对成虫的致病作用仍需进一步研究和验证。
昆虫能够通过体外免疫防御和体内免疫响应来抵抗病原微生物[35-38]。Wang等[39]和Luo等[40]的研究分别指出,美国白蛾(Hyphantria cunea)和黑胸散白蚁(Reticulitermes chinensis)在抵抗粘质沙雷氏菌时,细胞免疫和体液免疫均发挥重要作用。此外,昆虫与其肠道共生微生物之间的相互作用也对病原体的抵抗起到了关键作用。Steele等[41]的研究发现,粘质沙雷氏菌能够分泌一种具有拮抗作用的效应蛋白T6SS,这种蛋白对蜜蜂具有高度毒性,导致蜜蜂死亡率上升。然而,蜜蜂肠道中的共生微生物能够产生抑制沙雷氏菌生长的代谢物,显示出昆虫共生微生物在宿主免疫防御中的潜在作用。
虽然生物防治被认为是一种具备持续控制潜力的防治手段,但由于昆虫自身免疫系统的运转,病原防治效果不甚理想。本研究发现粘质沙雷氏菌在室内条件下对红棕象甲虫卵具有较强的侵染性,但其在田间的防治效果可能不稳定。单一病原菌在田间常面临见效慢、周期长、防治效果差的问题。为提高昆虫病原菌的杀虫效率,可以考虑将不同作用机制的病原菌进行复配,探讨病原菌联合杀虫效果。
一些研究已证明,沙雷氏菌与绿僵菌混配能够明显提高单一菌株对德国小蠊(Blattella germanica)的致病力;例如,当1.0×109 CFU/mL的粘质沙雷氏菌与绿僵菌复配时,9 d内可以使德国小蠊的致死率达到100%,而单独的粘质沙雷氏菌处理时,9 d内死亡率仅为5%[42];有机硅与生物农药球孢白僵菌与绿僵菌按1∶5混合使用也能显著提高对小云斑鳃金龟(Polyphylla laticolla laticollis)的防治效果[43]。然而,当前针对病原菌混配防治的研究较少,探索病原菌混配以提高单一菌株毒力的策略,在未来的害虫综合治理中具有重要应用前景。
此外,病原菌与化学农药的混合使用在田间也取得了一定的控制效果。例如,博落回生物碱与苏云金芽孢杆菌按照一定质量分数进行混配时,当混配比例为73∶1可提高对小菜蛾(Plutella xylostella)的毒杀能力[44]。
粘质沙雷氏菌不仅在病虫害防治中具有潜力,还能促进植物生长并降解土壤中的农药残留[45]。由此可见,粘质沙雷氏菌在生物防治、农业生产以及土壤修复等方面具有广泛的应用前景,值得进一步研究与开发。然而,本研究中,粘质沙雷氏菌LL-2分离株的生物活性是在严格控制的实验室条件下进行的,田间环境中固有的影响因子及其对该菌株侵染活性的作用尚未明确。因此,未来需要将该菌株引入田间试验,调查其在实际田间环境中的杀虫谱、毒力及应用技术,同时评估其对非靶标生物的安全性,为该菌株作为绿色害虫抑制剂的进一步开发和应用提供理论支持。



 下载:
下载: