-
弛豫法测定铬酸根-重铬酸根离子反应的速率常数是大学物理化学实验中一个基础性实验,该实验的目的是让学生掌握弛豫法测定反应速率常数的原理和方法,加深对反应速率常数(k)的理解和认识.弛豫是指一个因受外来因素快速扰动而偏离平衡位置的体系,在新条件下趋向新化学平衡的过程,是一种常用于研究快速反应的重要手段[1-2].在教材中,该实验通过浓度的突变使得反应的化学平衡发生移动,其实验方法是:在恒温水浴的环境下,通过滴入高浓度重铬酸钾(K2Cr2O7)溶液扰动铬酸根-重铬酸根反应体系,并实时监测反应体系趋向新化学平衡过程中pH值随时间t的变化,进而通过数据处理求得k[3].
在多年的物理化学实验教学中,笔者发现学生测得的实验结果与理论值相差甚远,数据处理的线性相关度也很低,实验结果误差很大,并且实验结果的不理想容易降低学生探索实验的积极性,不利于实验教学的高效开展.实验误差大的原因主要有以下两方面:①扰动程度适中的体系很难建立,扰动过慢则新平衡很难形成,弛豫现象不明显,而扰动过快会导致体系对浓度突变的反应有延迟,数据偏离真实值; ②弛豫过程中测得pH值和时间t的数据非常多,pH值要经过多次变换和作图,才能求得k,因此数据的准确性和数据处理的复杂性导致实验的误差很大,多数学生测得实验结果的相对误差超过20%.然而,文献中关于弛豫法测定反应速率常数的文章很少,已报道的文献主要是通过改变干扰剂的种类缩短弛豫时间,从而提高实验的准确性,但实验结果并不理想[4-6].针对上述问题,笔者对pH计的安装方式、扰动液与被扰动液的浓度比以及数据处理方法进行了系统研究,优化了实验方案,为弛豫法测定反应速率常数的基础物理化学实验的教学提供了参考.
全文HTML
-
铬酸根-重铬酸根在水溶液中的反应机理是[7]:
其中k1和k-1远大于k2和k-2,反应(2)为速率控制步骤.当实验温度为25 ℃,pH值为6.0~7.3,且c(H2O)≫c(Cr2O72-)时,体系可得:
其中:b,c均为常数; τ是弛豫时间,其物理意义就是体系某物质浓度与新平衡浓度之差值Δct减小至Δc0的e-1所需要的时间.用-lnΔc(H+)对时间t作图,斜率即为τ-1,进而以τ-1对c(HCrO4-)作图,通过获取直线的斜率和截距可求得k2和k-2.
-
仪器:HD-501S型超级恒温水槽,PHS-320型pH计,T-A1004A分析天平,CL-2型磁力搅拌器,带恒温夹套的玻璃杯.
试剂:K2Cr2O7(AR),硝酸钾(KNO3,AR),氢氧化钾(KOH,AR),硝酸(HNO3,AR),pH=4.00和pH=6.86的pH计标定液.
-
1) pH计的标定:选用二点法对pH计进行标定,由于铬酸根-重铬酸根反应体系呈弱酸性,故选用pH=4.00和pH=6.86标定液对仪器进行标定.
2) 扰动液和被扰动液的配制:称取K2Cr2O7样品,用0.06 mol/L KNO3溶液配制50 mmol/L K2Cr2O7溶液用作扰动液.取一定体积50 mmol/L K2Cr2O7溶液于50 mL容量瓶,用0.06 mol/L KNO3溶液稀释至刻度,配制浓度分别为2.5,5,10 mmol/L K2Cr2O7溶液用作被扰动液.
3) 测量:打开恒温水槽,将50 mL被扰动液全部倒入带恒温夹套的玻璃杯,开启磁力搅拌,用2.0 mol/L KOH和0.5 mol/L HNO3调节溶液pH值于6.0~7.3,待溶液温度稳定(25±0.1)℃,测定溶液初始pH值.吸取适量扰动液迅速滴入被扰动体系中,记录pH值随时间t的变化,当溶液的pH值不再发生变化,体系就达到新的化学平衡,准确记录新平衡时的pH值.
1.1. 实验原理
1.2. 仪器与试剂
1.3. 实验方法
-
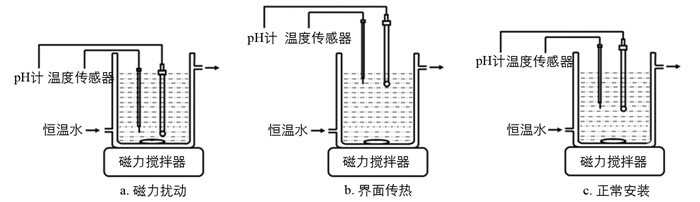
pH值的测定是本实验的关键步骤,pH计的安装不当会导致pH值的测定不准确,从而影响实验结果.实验过程中,学生安装pH计不当的情况主要有两种:① pH计的玻璃电极探头靠近搅拌磁子(图 1a),磁子高速旋转形成强烈对流以促进扰动液迅速扩散的同时,其附近区域的酸度会发生波动,导致pH计的示数不稳定,从而无法获取准确的pH数值和时间t,影响实验数据的采集; ② pH计的玻璃电极探头靠近被扰动液与空气的气液界面(图 1b),反应体系的温度恒定主要靠水平两侧恒温水浴的循环来维持,而垂直方向气液界面处被扰动液与空气的热量交换会使近表面区域的温度偏低(例如室温19.2 ℃,溶液25.1 ℃),导致pH数值发生偏离,引入较大的实验误差.
为减小动态恒温体系中pH值测定带来的实验误差,应将pH计的玻璃电极探头放于带恒温夹套玻璃杯的中心处(图 1c),此处位于带恒温夹套玻璃杯的中心,恒温效果最佳(靠近杯壁处温度会偏高),受到磁力搅拌的扰动较小,pH值比较稳定,能够准确反映本实验体系的酸度变化.
-
为探索扰动程度适中的弛豫过程用于实验教学,研究了扰动液与被扰动液的浓度比对反应速率常数测定的影响.为了确保扰动液的加入不会使体系在扰动前后Cr(Ⅵ)离子总浓度和溶液总体积发生较大变化,实验采用向不同浓度铬酸根-重铬酸根反应体系中逐滴加入50 mmol/L K2Cr2O7扰动液的方式进行,测定扰动液与被扰动液浓度比分别为5∶1,10∶1和20∶1时的实验数据(表 1,以第1个弛豫过程的部分数据为例).随着扰动液与被扰动液浓度比的增加,pH值下降的程度逐渐增大,并且变化速度也加快.
实验数据处理后所得反应速率常数见表 2,浓度比值为10∶1时测定结果具有最小相对误差,因为此时扰动液对反应体系产生的扰动适中,体系能够快速感受到浓度突变,弛豫现象明显,并且pH值变化速度适中,pH值每变化0.001的数据都可以准确记录,数据采集的效果优于教材中要求的每变化0.002记录一次,从而提高了pH值和时间t的准确性.当浓度比值为5∶1时,弛豫过程的扰动太小,学生很难观察到明显的弛豫现象,同时每次弛豫过程的初始与末尾pH值的差值小于0.01,pH计会引入较大误差.当浓度比值为20∶1时,体系对较高浓度突变需要一定的反应时间,在这段时间内pH数值偏离真实值,并且其下降速度非常快,pH值与时间t的测定具有较大操作难度和数据误差.因此,本实验的扰动液与被扰动液的最佳浓度比选择为10∶1.
-
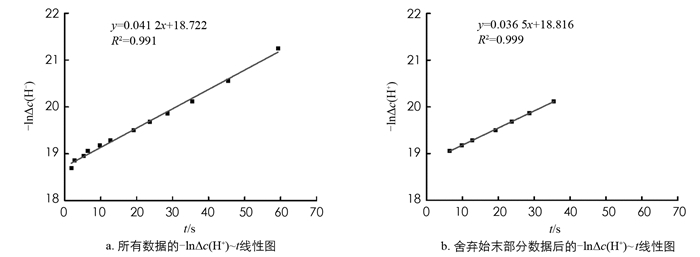
数据处理是本实验教学中的难点,学生掌握的程度较低,很容易导致处理得到错误的实验结果.本实验过程中测得数据量大,并且数据需要经历多次变换和作图,才能求得反应速率常数k,其中-lnΔc(H+)对时间t作图涉及的数据最多,作图量最大,数据处理引起的误差大[8],并且其斜率τ-1会影响τ-1~ c(HCrO4-)的线形拟合,进而决定k2和k-2的数值.因此本文重点讨论-lnΔc(H+)~ t的线性拟合,以扰动液与被扰动液浓度比为10∶1时的实验数据为例,采用Origin软件对数据进行处理[9-12].
所有数据点的线性不是很好,偏差较大的数据点集中在弛豫过程的初始和末尾处(图 2a),其主要原因是:①浓度相差较大组分的滴入使得体系的化学平衡移动,而体系对浓度突变的感应需要短暂时间,正如2.2中所讨论的,弛豫过程初始状态时扰动体系并未稳定,所测得pH值偏离真实值,加之pH值下降迅速,因而测得数据的误差较大; ②弛豫过程的新化学平衡形成时,体系的pH值会出现反复变化,导致时间t的判断不准确,影响数据的准确性.因此,将图 2a中偏离直线较远的最初3个和最末2个数据点舍弃,重新进行线性拟合得到图 2b.比较两张图可以发现,舍弃始末部分数据后所得直线的线性更好,R2达到0.999,直线的斜率τ-1更准确.基于该数据处理方法,将实验数据进行-lnΔc(H+)~ t的线性拟合,其中Δc(H+)=c(H+)平衡-Δc(H+)t,斜率为τ-1,并通过下列公式:
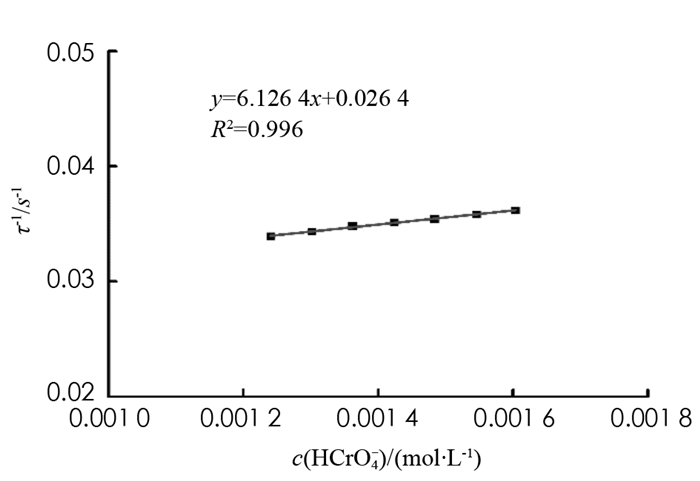
计算得到c(HCrO4-),其中c(H+)为新平衡时H+浓度.每一个弛豫过程,都有与其对应的τ-1和c(HCrO4-),最后将7个弛豫过程的(τ-1,c(HCrO4-))作图,所得直线斜率为6.126,截距为0.026 4(图 3).由于τ-1=4k2·c(HCrO4-)+k-2c(H2O),可计算得到k2=1.53 L/(mol·s),k-2=4.75×10-4 L/(mol·s),相对误差分别为9.29%和10.38%(表 2).按照此方法,在西南大学化学化工学院2017级本科生中开展弛豫法测定铬酸跟-重铬酸根离子反应速率常数的实验,所测得的实验数据的-lnΔc(H+)~ t线性拟合情况非常良好,R2达到0.99的比例占到95%,反应速率常数的相对误差≤10%的实验报告也达到86%,实验可重复性良好,教学成效显著.
2.1. pH计安装方式的影响
2.2. 扰动液与被扰动液的浓度比选择
2.3. 数据处理方法的改进
-
本文对弛豫法测定铬酸根-重铬酸根离子反应速率常数的实验进行了系统研究和改进,通过对pH计的安装方式和扰动液与被扰动液的浓度比的优化,提高了pH值和时间t的数据准确性,同时采取舍弃始末部分数据点的处理方法绘制-lnΔc(H+)~ t的线性图,用Origin处理得到精准的τ-1,提高了数据处理的精度和准确性,减小了实验结果的误差.改进后的实验具有很好的可重复性,实验结果更加准确,可很好地用于弛豫法测定反应速率常数实验的教学.参考文献:



 下载:
下载: