-
开放科学(资源服务)标志码(OSID):

-
烟草属于收获叶片的作物,在我国经济中占有比较重要的地位. 烟草病害发生后对烟叶产量与质量影响很大,严重时会造成毁灭性的经济损失. 目前,烟草赤星病是严重制约我国烟叶生产的一类真菌病害,该病具有潜育期短、爆发快的特点,在温湿度适宜的条件下,短时间内即可大面积流行,给烟叶生产造成巨大损失. 长期使用化学药剂防治该病害会引起环境污染、农药残留、抗药性等问题; 生物防治虽无毒无害无污染,但其作用缓慢、稳定性差、易受外界环境影响等缺点成为开发的难点,因此研究烟草的抗病性和选育抗赤星病烟草品种是防治该病最经济有效的途径[1-2].
目前,对于烟草自身抗病性机理的研究,主要集中在抗病性诱导[3-5]、抗病基因定位[6-7]、分子标记筛选[8-9]及抗性基因的转化[10]. 这些研究都集中在分子水平上,而在蛋白质水平上的研究报道很少. 烟草自身的抗病性与蛋白的表达与调控密切相关,因此本研究从蛋白质水平入手,研究不同烟草品种接种赤星病菌后差异表达的蛋白质,旨在探讨不同抗性烟草品种在蛋白质组学水平上存在的差异及其对赤星病抗性的影响,为进一步明确烟草的抗赤星病机制提供新内容.
全文HTML
-
供试烟草品种为“云烟87” “K326”和“Beinhart1000-1”,由中国农业科学院烟草研究所提供. 播种于温室花盆内,后移栽于温室,常规管理,当8~10片真叶完全展开时接种. 供试菌株在PDA培养基上25 ℃培养7 d后待用.
-
在烟草植株10叶期,选择烟株下部未变黄的叶片接种菌饼,每张叶片上接种2个菌饼,接种3片叶片,接种后25 ℃保湿培养,每天观察叶片受病菌侵染后情况,感染后第6 d取样,取接种叶片的上部第一片叶片,以接种前作空白对照,“云烟87”感染前(Y0d)、“云烟87”感染后第6 d(Y6d)、“K326”感染前(K0d)、“K326”感染后第6 d(K6d)、“Beinhart1000-1”感染前(B0d)和“Beinhart1000-1”感染后第6 d(B6d)共6个样本. 每个样本称取2 g叶片,样品液氮速冻后-80 ℃保存备用.
-
取2 g叶片样品液氮研磨成细粉状,加入10 mL预冷的TCA-丙酮(1∶9),涡旋混匀,置于-20 ℃沉淀过夜,4 ℃离心40 min(6 000 r/min),弃上清. 加入预冷丙酮,洗涤3次. 通风橱中干燥沉淀. 分别加入500 μL 2D裂解液(9.5 mol/L尿素,4% CHAPS,60 mmol/L DTT,体积分数为2%的ampholytes,使用时每500 μL裂解液加入10 μL 50×Protein Inhibitor Cocktail Set I),震荡混匀重悬沉淀,冰浴超声处理(100 W,持续10 s,间隔8 s,重复8次),4 ℃离心30 min(12 000 r/min),取上清,使用Bradford法进行定量,测蛋白质浓度后,分装于-80 ℃冰箱保存. 取处理好的蛋白样品20 μL,使用12% 分离胶,5% 浓缩胶进行SDS-PAGE,再经考马斯亮蓝R-250染色检测.
分别取样品100 μg,进行双向电泳,13 cm IPG预制胶条(pH值为3~10,非线性胶条),采用EttanTM IPGphorTM等电聚焦系统(GE Amersham)进行等电聚焦,IPG胶条在水化缓冲液中再水化12 h,IEF分4步进行:30 V,12 h; 500 V,1 h; 1000 V,1 h; 8000 V,8 h. 等电聚焦结束后,使用两步法进行平衡[11],然后转移到12.5% SDS-聚丙烯酰胺凝胶上之后将条带进行第二维电泳. 使用Hofer SE 600系统(GE Amersham)以15 mA/块凝胶进行电泳30 min,待样品完全转移出IPG胶条,加大电流至30 mA/块凝胶,直到溴酚蓝到达凝胶下沿0.5 cm处,电泳结束.
电泳结束后取出凝胶,加入固定液(40% 乙醇,10% 冰醋酸)固定过夜,再加入浸泡液(30% 乙醇,6.8% NaAc,0.312% NaS2O3·5H2O)处理30 min,倒掉,用MilliQ水冲洗3次,每次5 min; 将清洗后的胶加入染色液(0.25 % 硝酸银)中染色20 min,倒掉染色液,用MilliQ水冲洗2次,每次1 min; 放置于显影液(2.5%无水碳酸钠,0.04%甲醛)中显色,直至蛋白质点清晰可见,加入终止液(1.46% EDTA-2Na·2H2O),终止反应; 加入MilliQ水洗3次,每次5 min,再加入10%冰醋酸保存.
-
使用UMax Powerlook 2110XL(UMax)扫描染色的凝胶,并使用ImageMaster 2D Platinum(版本5.0,GE Amersham)完成图像分析. 手动验证每个配对斑点以确保在3份数据中产生的标准化点胶体之间的高度再现性. 选择重叠测量比以发现蛋白质表达变化,并且具有1.2倍或更大重叠率阈值过滤的蛋白质被认为是差异表达的. 确定差异表达的蛋白质点,并从胶上挖取差异点.
-
将目标蛋白点切下,装入离心管中做好标记,将胶粒切碎后加入50 μL银染脱色液(银染脱色液:V30 mmol/L铁氰化钾∶V100 mmol/L硫代硫酸钠=1∶1混合)脱色,清洗脱色至透明,吸弃上清,再加入100 μL 100 mmol/L碳酸氢铵,室温孵育15 min,吸弃上清冻干,之后加入5 μL 10 mg/L测序级Trypsin(胰蛋白酶,Promega)溶液,37 ℃反应过夜(20 h左右); 将过夜消化的酶解液吸出,转移至新的离心管中,在原管加入100 μL 60% ACN/0.1% TFA,超声溶解15 min,合并酶解液冻干; 若有较多盐分,则用Ziptip(millipore)进行脱盐. 首先用50% 的ACN湿润吸嘴,再用60% ACN/0.1% TFA润洗两次,然后用吸嘴反复吸打样品液,以除去盐类和杂质,最后用60% ACN/0.1% TFA清洗吸嘴两次,将所有溶液合并冻干.
-
将冻干后的酶解样品,取2 μL 20% 乙腈复溶. 取1 μL溶解后的样品,直接点于样品靶上,让溶剂自然干燥后,再取0.5 μL过饱和CHCA基质溶液(溶剂为50% ACN0.1% TFA)点至对应靶位上并自然干燥. 样品靶经氮气吹净放入仪器进靶槽并用串联飞行时间质谱仪(5800 MALDI-TOF/TOF,AB SCIEX)进行测试分析,激光源为355 nm波长的Nd:YAG激光器,加速电压为2 kV,采用正离子模式和自动获取数据的模式采集数据,一级质谱(MS)扫描范围为800~4 000 Da,选择信噪比大于50的母离子进行二级质谱(MS/MS)分析,每个样品点上选择8个母离子,二级质谱(MS/MS)累计叠加2 500次,碰撞能量2 kV,CID关闭.
-
质谱测试原始文件用Mascot 2.2软件检索相应的数据库,最后得到鉴定的蛋白质结果. 搜库参数设置如下:Database:NCBI; Taxonomy:XXX; Type of search:Combined(MS+ MS/MS); Enzyme:Trypsin; Fixed modifications:Carbamidomethyl (C); Dynamical modifications:Oxidation(M); Mass values:Monoisotopic; Protein Mass:Unrestricted; Peptide Mass Tolerance:± 100×10-6; Fragment Mass Tolerance:± 0.4 Da; Peptide Charge State:1+; Max Missed Cleavages:1.
1.1. 供试材料
1.2. 取样
1.3. 双向电泳
1.4. 图像分析
1.5. MALDI-TOF/TOF分析及数据库检索
1.5.1. 胶内酶解及Ziptip脱盐
1.5.2. 质谱分析
1.5.3. 数据库检索
-
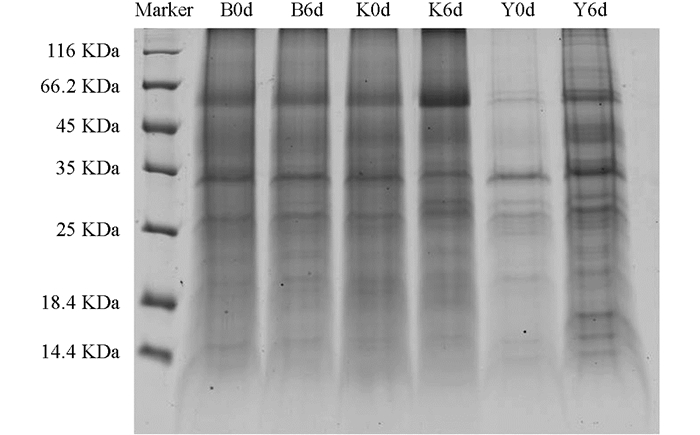
对提取的样品使用Bradford法进行蛋白质含量测定,样品质量浓度见表 1,并进行SDS-PAGE电泳检测(图 1),根据结果显示“云烟87”对照(Y0d)浓度较低,后续双向电泳上样量为100 μg,根据样品质量浓度计算双向电泳上样体积.
-
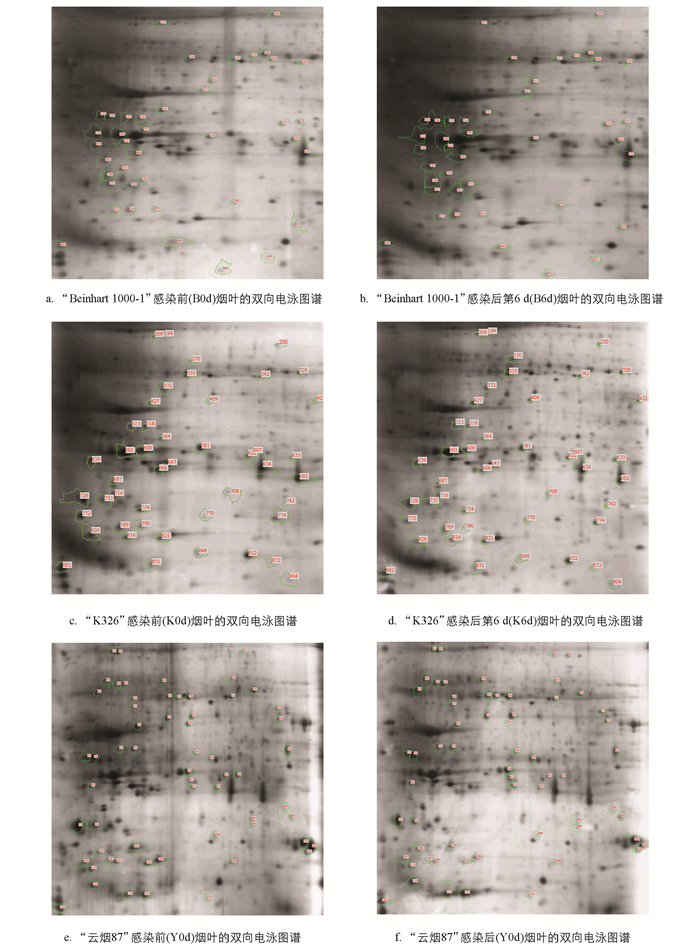
将提取的蛋白进行双向电泳分析,使用pH值为3~10,13 cm的IPG预制胶条,蛋白上样量为100 μg,双向电泳银染结果见图 2,提取的蛋白在各pH段都有分布,蛋白质点较清晰,分离较好.
将蛋白质凝胶双向电泳图谱经Image Master软件分析,通过比较感染前和感染后第6 d的双向电泳图谱,检测差异蛋白点(图 3). 比较B6d和B0d胶图有41个表达差异明显的蛋白质点,比较K6d和K0d胶图有46个表达差异明显的蛋白质点,比较Y6d和Y0d胶图有61个表达差异明显的蛋白质点,共有148个表达差异明显的蛋白质点. 根据软件分析结果,结合电泳图谱,共选取48个表达差异显著的蛋白质点进行质谱分析,其中上调表达的蛋白33个,下调表达的蛋白15个,具体见表 2.
-
对选取的48个差异蛋白点进行质谱鉴定,成功鉴定出38个蛋白质点(质谱匹配肽段得分高于60,并且匹配得分可信度大于95%),结果见表 3,其中上调表达蛋白28个,下调表达蛋白10个. 根据这38个蛋白所参与的代谢途径和生化功能将它们归纳成以下类群:碳代谢途径相关的蛋白质有甘油醛-3-磷酸脱氢酶(B308,K328)和羧甲烯丁烯羟酸内酯酶同系物(B559); 光合作用相关的蛋白质包括铁氧还蛋白酶还原酶(B412,Y607),PsbP结构域蛋白6(B619),类囊体腔15kDa蛋白1(B889),叶绿素a-b结合蛋白8(K581),类PsbP蛋白1(K774),果糖二磷酸醛缩酶1(Y537),类囊体内腔19 kDa蛋白(Y875)和1,5-二磷酸核酮糖羧化酶/加氧酶(RuBisCo)相关蛋白(K820,Y440,Y462,Y1172); 能量代谢相关的蛋白质包括类DNA甲基化因子4(B728),磷酸甘油酸激酶(K270),苹果酸脱氢酶(K342,Y579),PNSL5(K742),ATP合成酶CF1ε亚基(K789),磷酸甘油酸激酶(Y449)和碳酸酐酶(Y769); 防御相关的蛋白质包括过氧化物酶N1(K421),谷胱甘肽S-转移酶(K607),PR-5(K633),GGAT(Y331),PP2-B11(Y1039)和铜/锌超氧化物歧化酶(Y1088); 蛋白合成相关的蛋白质包括2-亚甲基-3-呋喃酮还原酶(B330,Y535,Y538)和FKBP19(Y958); 同时还有5个未知蛋白(B319,B531,K409,K427,Y637).
2.1. 蛋白质定量及SDS-PAGE电泳检测
2.2. 双向电泳图谱及差异点分析
2.3. 差异表达蛋白点的质谱鉴定
-
甘油醛-3-磷酸脱氢酶(GAPDH)是糖酵解反应中一种非常关键的酶,常用作研究其他基因和蛋白表达的内参. 随着研究的深入,越来越多的试验证实GAPDH蛋白功能的多样性,如GAPDH在植物中与各种环境的压力表现出抗逆性有关[12]. 有研究人员在分子水平上检测到马铃薯的GAPDH基因受病原物侵染诱导表达[13],并且在致病疫霉侵染马铃薯最初的24 h内就有反应[14],本研究鉴定到的两个甘油醛-3-磷酸脱氢酶(B308,K328)在受到病原菌侵染后均上调表达,也进一步在蛋白水平上验证了GAPDH蛋白在病原菌侵染过程中发挥作用,另外,根据结果也可以得出在研究病菌侵染过程中GAPDH基因不适合作为基因表达的内参.
本研究共鉴定到12个与光合作用有关的蛋白质,其中有8个上调表达的蛋白:铁氧还蛋白酶还原酶(B412,Y607),PsbP结构域蛋白6(B619),果糖二磷酸醛缩酶1(Y537),类囊体内腔19 kDa蛋白(Y875),1,5-二磷酸核酮糖羧化酶/加氧酶(RuBisCo)相关蛋白(Y440,Y462,Y1172); 4个下调表达的蛋白:类囊体腔15kDa蛋白1(B889),叶绿素a-b结合蛋白8(K581),类PsbP蛋白1(K774)和1,5-二磷酸核酮糖羧化酶/加氧酶小亚基(K820). 其中1,5-二磷酸核酮糖羧化酶/加氧酶(RuBisCo)是光合作用中的一个关键酶,本研究发现4个RuBisCo相关蛋白,其中在“K326”中鉴定到的1,5-二磷酸核酮糖羧化酶/加氧酶小亚基在被赤星病菌侵染后下调表达,“云烟87”中有2个二磷酸核酮糖羧化酶/加氧酶2和1个二磷酸核酮糖羧化酶小链在被赤星病菌侵染后上调表达. 光合作用是植物中最重要的代谢过程,赤星病侵染显著影响光合作用的速率,RuBisCo作为光合作用中的一个关键酶,其表达量增加会增强光合作用以供给更多能量从而抵抗病毒侵染,而酶的减少表明植株在受到病菌侵染后光合作用下降,同时部分蛋白开始降解,植株开始逐渐衰弱,进一步降低了对病原菌的抵抗能力,从而加速了植株的发病,这也表明了“云烟87”和“K326”对赤星病侵染的抗性不同.
本研究共鉴定到能量代谢相关的蛋白质8个,其中有6个上调表达的蛋白:类DNA甲基化因子4(B728),磷酸甘油酸激酶(K270),苹果酸脱氢酶(Y579),PNSL5(K742),磷酸甘油酸激酶(Y449),碳酸酐酶(Y769); 2个下调表达的蛋白苹果酸脱氢酶(K342)和ATP合成酶CF1ε亚基(K789). ATP合成酶是参与能量代谢的关键酶,有研究提出病原菌的侵染初期,作为细胞内能量转换核心酶的ATPase下调表达,表明烟草在被侵染初期电子传递和能量传递能力减弱,即在病原物侵染初期某些生理途径被病原菌破坏,或被病原菌产生的降解酶和毒素抑制从而降低植株呼吸作用强度,触发植物的主动抗病机制,是植株主动防御机制起作用的必要过程[15].
本研究共鉴定到防御相关的蛋白质6个,其中有4个上调表达的蛋白:过氧化物酶N1(K421),谷胱甘肽S-转移酶(K607),PR-5(K633)和GGAT(Y331); 2个下调表达的蛋白PP2-B11(Y1039)和铜/锌超氧化物歧化酶(Y1088). 研究表明,在植物受到外界胁迫时,植株体内的GST活性会显著升高,以保护生物体免受逆境的损害[16]. 本研究也鉴定到了谷胱甘肽S-转移酶(K607)在感染赤星病后上调表达,与前期研究一致. 本研究还鉴定到一个感染赤星病后上调表达的osmotin-like protein(K633)类渗调蛋白(OLP),它属于PR-5蛋白. PR-5蛋白包含了具有多种抗逆功能的渗调蛋白(osmotin)和类渗调蛋白(OLP). 有研究表明,马铃薯被致病疫霉(P. infestans)感染后能检测到OLP蛋白的增加[17]. PR-5蛋白具有抗真菌、抗冻和抗渗透压力等多种生物学活性,参与植物系统获得性反应(SAR)和超敏反应(HR),在植物抵御生物和非生物胁迫中具有重要作用[18]. 当受到病原侵害时植物可以产生系统获得性抗性,发生系统获得性抗性过程时植物的细胞内会发生一系列的生理生化反应,其中就包括PR蛋白表达.
综上所述,在本研究中,接种病菌后烟草叶片中参与各个代谢过程的相关蛋白并不是呈现单一的变化趋势,烟草的抗性机制是十分复杂的,涉及大量基因的诱导表达与调控,这些基因的表达结果往往导致蛋白质的变化. 本研究得到了烟草对赤星病菌应答网络中表达量发生显著变化的差异蛋白,但所得到的差异蛋白在应答机制中的具体作用有待进一步的深入研究. 总之,烟草对赤星病抗性机制复杂,其中涉及众多的信号物质和抗性相关蛋白,随着蛋白质组学等技术的发展和应用,将会有更多的抗性相关基因和蛋白被挖掘,进而大大提高人们对烟草与赤星菌互作机理的认识.



 下载:
下载: