-
开放科学(资源服务)标志码(OSID):

-
白色念珠菌(Candida albicans)是一种常见的条件致病性真菌,广泛分布于人类和犬、猫、猪等动物的口腔、胃肠道表面与生殖器[1]. 在继发感染或者免疫功能低下的动物中,白色念珠菌可传播到血液中,造成危及生命的系统性白色念珠菌病. 据报道,系统性白色念珠菌病的死亡率可超过30%[2]. 此外,临床上发现了多种耐药型的白色念珠菌菌株[3]. 因此,探索具有新化学结构的新型抗白色念珠菌药物变得愈加紧迫.
近10多年来,多吡啶类的过渡金属配合物是化学生物学与药物化学领域的研究热点. 其中,铱和钌的多吡啶类配合物的空间结构、电子性质可以通过其结构配体和辅助配体的修饰而进行分子设计,并且它们还可以与特定的生物分子发生配体交换反应,因而被广泛运用于抗微生物和抗癌药物的研究中[4]. 研究发现,多吡啶铱配合物具有较强的抑制金黄色葡萄球菌和铜绿假单胞菌等细菌生长的作用[5-6]. 然而,鲜有关于多吡啶铱配合物尚有抗白色念珠菌活性的报道.
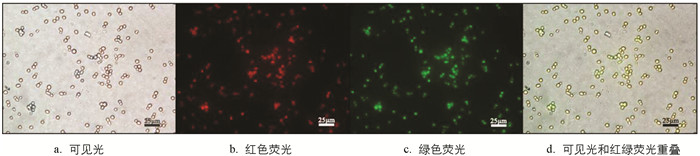
本研究在以往合成的一系列金属配合物的工作基础上,筛选出了一种新型结构的多吡啶铱配合物,该配合物在激发光下,可显示出黄色荧光(图 1). 在抗菌功能检测中,确定了它们对白色念珠菌的最小抑菌质量浓度(minimum inhibitory concentration,MIC)和最小杀菌质量浓度(minimum fungicide concentration,MFC),并且研究发现该配合物在动物体内对白色念珠菌也有显著的杀灭作用.
全文HTML
-
电子分析天平(瑞士METTLER TOLEDO公司),倒置荧光显微镜(重庆奥特光学仪器有限责任公司),酶标仪(美国Hercules公司),恒温箱(湖南湘仪公司),荧光分光光仪(日本HITA-CHI公司),高速台式冷冻离心机(湖南湘仪公司),冷冻切片机(德国得卡公司).
-
本课题组根据文献[7]合成一系列配合物,氟康唑购于北京索莱宝科技有限公司,亚甲基蓝购于上海阿拉丁公司.
-
白色念珠菌(ATCC 90029)购于北京百欧博伟生物技术有限公司. 将购得的白色念珠菌培养于SDA琼脂平板(含有1%蛋白胨、4%葡萄糖、2%琼脂)上,在28 ℃恒温培养.
-
从SDA琼脂平板上挑取白色念珠菌单菌落,于培养基中过夜培养. 离心收集真菌细胞,用磷酸缓冲盐溶液(phosphate buffered saline,PBS)洗涤2次,并于RPMI 1640培养基中调整菌落浓度为1×106 CFU/mL,然后加入4 μg/mL的配合物,在28 ℃孵育2 h. 使用荧光倒置显微镜观测白色念珠菌对配合物的摄取情况.
-
由于亚甲基蓝不能进入活细胞但可进入死亡的细胞,因此可用亚甲基蓝染色鉴定配合物杀灭真菌细胞的效果. 收集对数生长期的白色念珠菌,重悬于RPMI 1640培养基中,使其浓度为5×105 CFU/mL. 加入4 μg/mL或8 μg/mL的配合物,在28 ℃孵育24 h,离心收集细胞,用PBS洗涤与重悬,取1滴于载玻片上用亚甲基蓝染色3 min,在显微镜下进行观察. 使用氟康唑(4 μg/mL)作为阳性对照.
-
将白色念珠菌分别与不同质量浓度的配合物(0,2,4 μg/mL)在28 ℃孵育0,4,8,12,24,36,48 h,然后吸取100 μL培养液,平铺于YPD平板上,在28 ℃培养24 h,根据单菌落数来确定活细胞数量,并使用GraphPad Prism 7.0绘制出时效曲线.
-
参照CLSI M27-A3标准[8],采用微量肉汤稀释法测量配合物对白色念珠菌的MIC和MFC. 离心收集处于对数生长期的真菌细胞,重悬于RPMI 1640培养基中,使其终浓度为1.5×103 CFU/mL,然后加入质量浓度为64~0.125 μg/mL的配合物. 培养48 h后,得到最低药物质量浓度和抑制率大于50%的药物质量浓度.
-
雄性健康Balb/c小鼠(6~8周),购于重庆恩斯维尔生物科技有限公司,饲养在SPF级实验室中. 每只小鼠每天腹腔注射80 mg/kg环磷酰胺一次,连续3 d,以降低机体免疫力[9]. 然后每只小鼠经尾静脉注射给予对数生长期的白色念珠菌(5×105 CFU)进行感染[10-11].
-
在白色念珠菌感染1 d后,将感染模型小鼠平均分为3组(每组6只小鼠):模型组、氟康唑阳性药治疗组和配合物治疗组. 配合物治疗组小鼠经腹腔注射4 mg/kg配合物. 阳性药治疗组小鼠腹腔注射4 mg/kg氟康唑,模型组给予同等剂量的生理盐水. 连续给药3 d后处死小鼠,分离出肾脏,分别进行高碘酸-席夫碱(PAS)和苏木素-伊红(HE)染色[12],同时测定肾组织菌落负荷量. 测定菌落负荷量时,在无菌条件下将肾组织匀浆,然后涂布于培养板上. 在28 ℃培养48 h后,得到单菌落数,计算菌落负荷量(菌落数/肾脏质量).
-
所有数据均采用GraphPad Prism 7.0进行统计分析. 两组数据间的比较使用t检验,ANOVA用于多组数据的分析. p<0.05被认为具有统计学意义.
1.1. 材料和仪器
1.1.1. 仪器
1.1.2. 试剂
1.1.3. 菌株与培养条件
1.2. 方法
1.2.1. 白色念珠菌对配合物的摄取实验
1.2.2. 亚甲基蓝染色
1.2.3. 时效曲线研究
1.2.4. MIC和MFC的测定
1.2.5. 动物感染白色念珠菌模型的制作
1.2.6. 体内抗菌实验
1.2.7. 数据分析
-
为证明配合物能够进入白色念珠菌细胞,将白色念珠菌与配合物同孵育2 h,然后用荧光显微镜观察白色念珠菌对配合物的摄取情况. 由于白色念珠菌自身没有荧光,而配合物在激发光下可显示出荧光,若白色念珠菌能够摄取配合物,那么在激发光下白色念珠菌能够呈现荧光. 结果表明,在激发波长下白色念珠菌显示出强烈的红色与绿色的荧光(图 2),当可见光荧光重叠时,真菌呈现出黄色荧光,说明白色念珠菌能够有效摄取配合物.
-
亚甲基蓝是一种生物染料,能够鉴别活细胞与死亡细胞,因此本实验通过亚甲基蓝染色鉴别白色念珠菌的活菌和死菌. 将白色念珠菌分别与不同质量浓度的配合物(4 μg/mL和8 μg/mL)、氟康唑(4 μg/mL)共同孵育24 h后,用亚甲基蓝染色观察Ir-5配合物的杀菌活性. 结果显示,未加药物的空白对照组细胞存活良好,氟康唑处理组出现了少量的蓝色死菌,而配合物处理组出现了大量的蓝色死菌,并且随着质量浓度增高,死亡细菌越多(图 3),说明配合物具有杀菌作用,并且在同等质量浓度下其杀菌能力高于氟康唑.
-
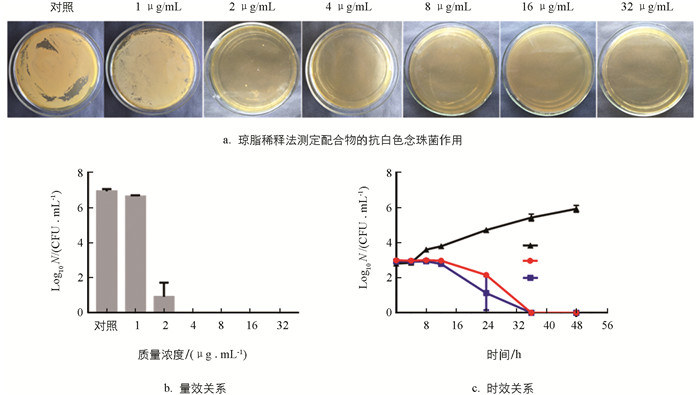
为了进一步验证配合物的杀菌活性,进行了时效和量效关系的研究. 将真菌分别与不同质量浓度的配合物(0,1,2,4,8,16,32 μg/mL等)在RPMI 1640培养基中孵育,在不同时间点(0,4,8,12,24,36,48 h)分别取100 μL培养液涂布于平板上,培养48 h后,根据菌落形成单位计算出活菌数N. 结果见图 4,真菌与配合物共同孵育后,活菌数逐渐降低,在孵育36 h后能完全杀死白色念珠菌;此外,剂量为4 μg/mL的配合物的杀菌效率明显高于2 μg/mL的配合物,呈现出量效关系.
-
根据CLSI M27-A3标准,测定的配合物抗白色念珠菌的MIC值为1 μg/mL. 而相同条件下氟康唑的MIC为1 μg/mL,说明配合物对白色念珠菌的抑制作用要优于氟康唑. 此外,配合物对白色念珠菌的MFC为2 μg/mL,明显低于氟康唑的MFC(10 μg/mL).
-
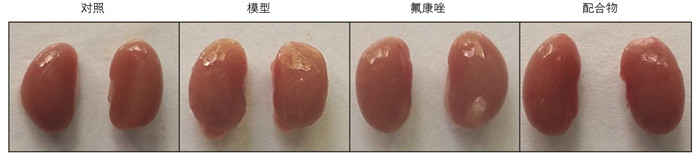
未经药物处理的小鼠在全身感染白色念珠菌4 d后,身体蜷缩,活动减少,肾脏出现水肿和明显肉芽(图 5). 而经过配合物连续3 d的治疗后,小鼠活动增多,行为基本恢复正常,肾脏没有明显的肉芽肿,表明配合物对白色念珠菌引起的感染具有良好的治疗效果.
为进一步检测各组小鼠肾脏的菌落负荷量,采用了组织切片高碘酸-席夫碱(PAS)染色法和平板计数法. 由于白色念珠菌的细胞壁中含有大量的葡聚糖和甘露聚糖,PAS能够使多糖着红色,组织中的白色念珠菌将会被染成红色. 肾组织经PAS染色后,模型组与正常小鼠肾脏(空白对照)相比,出现了明显的白色念珠菌菌落,但经过配合物治疗后,菌落明显减少(图 6). 在肾组织菌落负荷量测定中,配合物治疗组能显著降低肾组织的菌落负荷量(图 7).
-
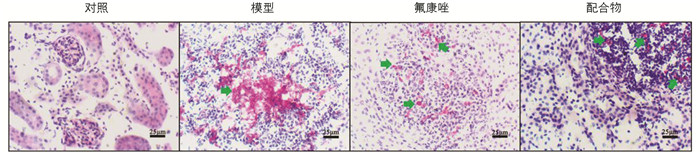
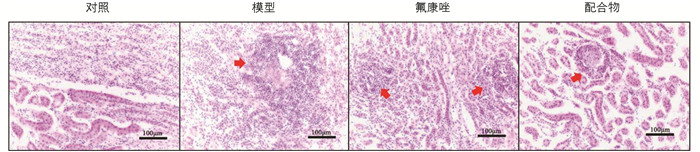
在HE染色中,模型组小鼠的肾脏出现了明显的炎症区域,说明白色念珠菌感染可引起肾组织的炎症损伤. 但经配合物治疗后,肾组织的炎症区域有明显的减少(图 8),表明配合物在体内能通过在体内杀灭白色念珠菌、降低肾组织的菌落数,以减少由白色念珠菌感染引起的炎症,从而起到治疗的作用.
2.1. 白色念珠菌对配合物的摄取
2.2. 亚甲基蓝染色
2.3. 配合物杀灭白色念珠菌的时效和量效关系
2.4. MIC和MFC的测定
2.5. 配合物体内抗菌实验
2.6. 配合物减轻肾组织炎症损伤
-
在目前真菌感染引起的发病率和死亡率均上升的趋势下,研制新型抗真菌药物是一个重要的课题. 本实验研究了八面体型的铱(Ⅲ)配合物的抗白色念珠菌活性,发现这类金属配合物可能具有研究价值和应用空间. 从中筛选得到的配合物对于白色念珠菌具有良好的杀菌活性,其MIC和MFC分别为1 μg/mL和2 μg/mL,活性高于临床抗真菌药物氟康唑. 在系统性白色念珠菌感染的动物模型中,配合物也表现出一定的治疗效果. 本研究可为合成新型的多吡啶铱配合物抗菌药物提供有效结构,也可为开发新型金属抗菌剂提供参考.




 下载:
下载: