-
狼毒大戟为大戟科植物狼毒大戟(Euphorbia fischeriana Steud.)的干燥根,被《中华人民共和国药典》(2015年版)收载为中药狼毒的原植物之一,具有散结、杀虫之功效,临床上常用于治疗肿瘤患者、结核病、慢性支气管炎、皮肤病、乳腺增生和癫痫等,为单味制剂结核灵片的原料药[1-3].现代生物活性研究表明,狼毒大戟具有抗肿瘤、抗结核杆菌、抗白血病、细胞毒、免疫调节等生物活性[3-5].
现行版《中华人民共和国药典》以狼毒大戟中醇溶性浸出物(稀乙醇)的质量分数来控制狼毒药材的质量,规定其质量分数不得少于18.0%,但未明确特征性活性成分的鉴别和质量分数测定[1].据文献报道,狼毒大戟含有萜类、苯乙酮类、鞣质、酚酸类、黄酮类、蒽醌类等化合物[3-6].而蒽醌类化合物是一类重要的次生代谢产物,具有抗肿瘤、抗菌、抗病毒等多种生物活性,是一类潜在抗肿瘤分子[7-10],与狼毒大戟的生物活性具有一定的关联性,可作为狼毒药材的质量评价指标之一.目前未见狼毒大戟中5种蒽醌类化合物质量分数的同时测定报道.为此,本实验采用HPLC法同时测定云南省不同产地、不同部位狼毒大戟中5种蒽醌类物质的质量分数,以期为全面客观地认识狼毒药材物质基础、丰富和发展狼毒药材多指标评价体系研究提供科学的依据.
全文HTML
-
日本岛津LC-20A型高效液相色谱仪;宁波新芝SB-5200DTN型超声波清洗机;德国赛多利斯CP225D型分析天平.
芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚对照品(中国食品药品检定研究院,批号分别为110795-201609,110757-201607,110756-201512,110796-201621,110758-201616);德国默克产色谱纯甲醇,水为娃哈哈牌纯净水,甲醇、盐酸均为分析纯.
狼毒大戟于2016年10月采自云南省香格里拉市小中甸等地,经大理大学药学与化学学院张德全副教授鉴定为大戟科植物狼毒大戟(Euphorbia fischeriana Steud.)的干燥根(表 1),留样凭证存放于重庆市抗肿瘤天然药物工程技术研究中心.
-
色谱柱为Venusil MP C18(2)柱(4.6 mm×250 mm,5 μm);流动相为甲醇-0.2%磷酸溶液(79: 21);检测波长:254 nm;流速:1.0 mL/min;进样量:10 μL;柱温:30 ℃.
-
分别精密称取减压干燥至恒质量的芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚对照品适量,加甲醇溶解并稀释至刻度,摇匀,制得各对照品储备液质量浓度分别为芦荟大黄素600 μg/mL,大黄酸500 μg/mL,大黄素200 μg/mL,大黄酚400 μg/mL,大黄素甲醚500 μg/mL.分别量取上述对照品储备液适量,逐级稀释,加甲醇制成每1 mL各含60,50,20,40,25 μg的混合溶液(Ⅰ).分别量取上述对照品储备液适量,并逐级稀释,加甲醇制成每1 mL各含4,5,2,0.4,0.5 μg的混合溶液(Ⅱ).
-
游离蒽醌供试品溶液:取狼毒大戟粉末(过3号筛)约2.0 g,精密称定,置150 mL具塞锥形瓶中,加入甲醇60 mL,室温浸泡2 h,密塞,超声45 min,滤过,减压回收溶剂至干,残渣用甲醇溶解并定容至10 mL,即得.
总蒽醌供试品溶液:取狼毒大戟粉末(过3号筛)约2.0 g,精密称定,置150 mL具塞锥形瓶中,加入甲醇-盐酸(10: 0.4)60 mL,室温浸泡2 h,密塞,超声45 min,滤过,减压回收溶剂至干,残渣用甲醇溶解并定容至10 mL,即得.
-
分别精密吸取1.3.1项下混合溶液(Ⅰ)1,2,5,10,15,20 μL和混合溶液(Ⅱ)1,2,5,10,15,20 μL,注入液相色谱仪,记录色谱图,以各对照品的峰面积(y)与其相应的对照品质量浓度(x)进行线性回归,得回归方程、相关系数和线性范围.
-
分别取1.3.1项下混合溶液(Ⅰ),按1.2项下的条件连续进样6次.通过各对照品所得的峰面积来计算RSD,以此考察仪器的精密度.
-
取S4-4(根)号样品,依1.3.2项下方法平行制备供试品溶液各6份,依1.2项下条件进行测定与分析.记录各对照品的峰面积并计算其RSD,以此来考察本实验方法的重复性.
-
取S4-4(根)号样品,依1.3.2项下方法制备供试品溶液各1份,室温条件下密闭放置,分别在0,4,8,12,16,24 h依1.2项下条件进行测定与分析,用于考察样品的稳定情况.
-
精密称取已知质量分数的S4-4(根)号样品约1.0 g,共12份,分别依次精密量取1.3.1项下芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚对照品储备液适量,依1.3.2项下方法平行制备供试品溶液各6份,依1.2项下条件进行测定与分析,计算各成分的加样回收率和RSD,并验证本方法的准确性.
-
取16份不同产地、不同部位的狼毒大戟,按1.3.2项下方法制备供试品溶液,平行3份,按1.2项下条件进行测定,测定狼毒大戟中5种蒽醌类化合物的质量分数.
1.1. 仪器、试剂与材料
1.2. 色谱条件与系统适用性实验
1.3. 溶液制备
1.3.1. 对照品溶液制备
1.3.2. 供试品溶液制备
1.4. 标准曲线的制备
1.5. 精密度实验
1.6. 重复性实验
1.7. 稳定性实验
1.8. 加样回收率实验
1.9. 样品质量分数测定
-
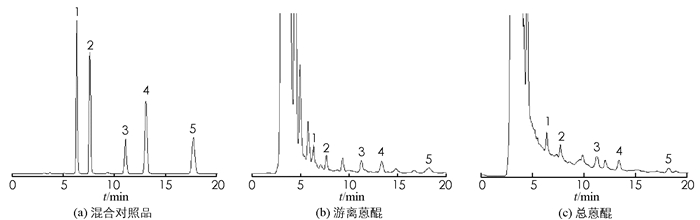
按照1.2项下色谱条件进行分析,芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚能在18 min内分析完毕,峰形较好,并与其他化合物分离完全(R>1.5),理论塔板数按大黄素甲醚峰计算不低于5 000,说明此色谱条件具有可行性,结果见图 1.
-
5种蒽醌类成分的线性回归方程、相关系数、线性范围结果见表 2.
-
芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚的RSD分别为0.22%,0.23%,0.23%,0.26%,0.26%,证明本方法精密度良好.
-
游离蒽醌中芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚的RSD分别为2.06%,2.33%,2.25%,2.50%,1.65%,总蒽醌中芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚的RSD分别为2.71%,2.06%,2.22%,2.31%,2.69%,证明该样品制备方法的重复性良好.
-
游离蒽醌中芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚的RSD分别为2.75%,2.13%。1.76%,1.50%,1.38%,总蒽醌中芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚的RSD分别为2.63%,1.41%,2.85%,2.24%,1.30%,证明该供试品溶液在24 h内稳定性良好.
-
由表 3、表 4可知,狼毒大戟S4-4(根)中5种游离蒽醌的平均回收率在96.59%~99.13%,RSD 0.80%~1.36%,符合分析要求;狼毒大戟S4-4(根)中5种总蒽醌的平均回收率在97.60%~99.46%,RSD 0.72%~1.52%,符合分析要求.表明上述实验方法的准确度较高,能应用于狼毒大戟中游离蒽醌和总蒽醌的检测与分析.
-
用标准曲线法计算芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚的质量分数,结果见表 5.
-
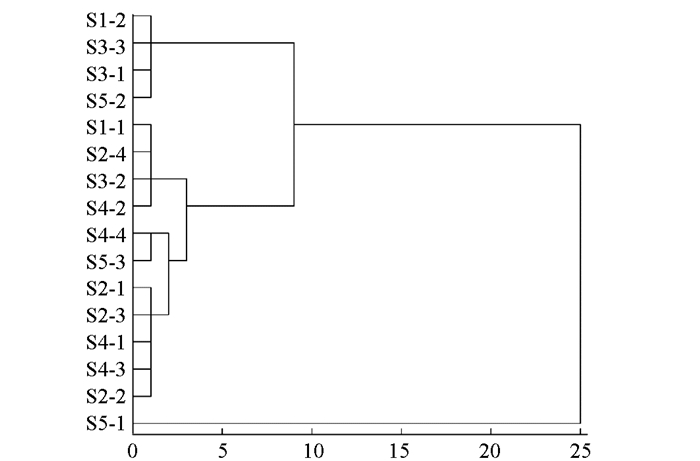
取5个采集地点16个居群狼毒大戟根的总蒽醌结果进行聚类分析.以表 5中狼毒大戟根的总蒽醌为依据,通过SPSS 23.0版本软件欧式距离平方(squared Euclidean distance)计算样品间的相似系数,并用离差平方和法(Ward法)进行系统聚类,结果见图 2.
由图 2知,当分类距离为5时,可分为3类:第一类有4份样品,即S1-2,S3-1,S3-3,S5-2;第二类有11份样品,即S1-1,S2-4,S3-2,S4-2,S4-4,S5-3,S2-1,S2-3,S4-1,S4-3,S2-2;第三类有1份样品,即S5-1.
2.1. 对照品和供试品色谱分离图
2.2. 线性回归方程
2.3. 精密度实验
2.4. 重复性实验
2.5. 稳定性实验
2.6. 加样回收率实验
2.7. 样品质量分数测定
2.8. 聚类分析
-
以狼毒大戟的供试品溶液为研究对象,考察了甲醇-磷酸和甲醇-水不同比例的等度与梯度洗脱,结果显示采用甲醇-0.2%磷酸溶液(79: 21)为流动相系统时,目标峰分离度良好,且峰形对称、无拖尾,故甲醇-0.2%磷酸溶液系统较适合狼毒大戟中蒽醌类成分的分析. 5种蒽醌类物质均在254 nm波长下有较大的吸收,故选定254 nm为本实验检测波长.
-
为了快速从狼毒大戟中提取尽可能多的蒽醌类化合物,本实验采用文献中常见的超声提取法[11]和回流提取法[12],以获得最佳的提取量,结果显示超声波辅助提取法的提取率较佳.比较了不同体积分数提取溶液(三氯甲烷、甲醇、乙醇、甲醇-盐酸)、提取时间(15,30,45,60 min)、料液比(1: 30,1: 60,1: 120,1: 240 g/mL)及提取次数(1,2,3次)的提取率效果.结果表明狼毒大戟中游离蒽醌以甲醇为提取溶液,料液比1: 30 g/mL,超声提取1次,提取45 min,即可将5种游离蒽醌类成分基本提取完全;狼毒大戟中总蒽醌以甲醇-盐酸(10: 0.4)为提取溶液,料液比1: 30 g/mL,超声提取1次,提取45 min,即可将5种总蒽醌类成分基本提取完全.
-
本实验以狼毒大戟中5种蒽醌类化合物进行质量综合评价,由表 5可知,16份狼毒大戟均含有芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚成分,表明不同产地、不同部位狼毒大戟中蒽醌类化合物较为相似,说明该样品所含的蒽醌类化合物分布及比例较稳定.狼毒大戟根中游离蒽醌的质量分数是结合蒽醌质量分数的0.23~1.02倍,表明不同产地狼毒大戟根中游离蒽醌和结合蒽醌的质量分数存在一定差异,但部分产地游离蒽醌质量分数超过或接近结合蒽醌质量分数,可能与S3(云南省香格里拉市格咱乡)、S1(云南省香格里拉市小中甸)的生长环境为灌丛、海拔较低有关[12],其原因有待进一步研究.狼毒大戟地上部位中游离蒽醌的质量分数是结合蒽醌的0.37~0.90倍,表明不同产地狼毒大戟地上部位中游离蒽醌和结合蒽醌的质量分数差异较大,且结合蒽醌的质量分数均大于游离蒽醌的质量分数.
因药用植物的不同植株即使是同一采收期其质量分数也有所差异,故本实验采用单株采样分析,以减少样品导致的实验误差[11].由表 5可知,5个不同产地、不同部位各16份狼毒大戟药材中5种蒽醌类成分的量各不相同,其中S5样品根中总蒽醌质量分数最高、S3样品根中总蒽醌质量分数最低,而S3样品地上部位中总蒽醌质量分数最高、S1样品地上部位中总蒽醌质量分数最低,且不同产地、不同部位中芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚5种成分间量的比(内在的结构比)均有较大差异;同样,由聚类分析结果(图 2)可知,同一产地不同居群没有全部聚集在一枝上,这2项结果都进一步说明狼毒大戟药材因产地、居群不同其蒽醌类成分量及结构比均具有较大差异,5种蒽醌类化合物质量分数存在显著性差异,这种成分结构比的差异可能是造成狼毒药材生物活性差异的根本原因.
前期文献报道,狼毒大戟中大黄素甲醚对人体宫颈癌细胞具有较强的抑制作用[6]、大黄素甲醚对耐药型和非耐药型结核杆菌均有显著的抑制作用[4],与狼毒大戟药效(抗肿瘤、抗结核杆菌等)具有一定的关联性[3-5].因此,狼毒大戟中蒽醌类物质质量分数可作为其质量控制指标之一.由表 5可知,狼毒大戟地上部位的游离蒽醌、结合蒽醌和总蒽醌质量分数部分超过传统入药部位根的质量分数,如果在充分利用狼毒药材传统入药部位的同时,再充分利用地上部位的生物资源,将对有限的生物资源的节约产生重要价值,这也为狼毒大戟地上部位资源的合理利用和开发创造了可能性.
本实验建立同时测定狼毒大戟不同产地、不同部位中芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚5种蒽醌类成分的HPLC法,不仅简单可靠,且方法学验证结果符合分析要求,可为狼毒大戟质量的综合评价提供参考依据.



 下载:
下载: