-
随着校园足球的逐步推进,女子足球运动员数量不断增加,女子足球的受关注程度不断提高,近年我国女足在世界大赛当中的成绩也在逐渐回升.世界女足有强对抗、高速度的发展趋势,我国女足技战术水平与世界一流球队没有明显差距,但身体对抗、速度比拼却落下风,要弥补这一差距需要在日常训练中加入更多的高强度训练.在上世纪80年代我国推崇“三从一大”的训练原则,虽然取得一定成绩,但是也让许多运动员受到伤病困扰,女性运动员尤为明显.高强度运动除了对运动系统造成较大负担外,对运动氧化伤害也是不可避免的.有研究显示,在高强度训练后,女性运动员与男性运动员相比,氧化伤害更为严重,身体的炎体反应也更为明显,最终导致疲劳恢复需要更长时间[1].通过运动补剂的摄入降低高强度运动对女性运动员肌肉损伤和氧化伤害,缩短疲劳恢复时间已经成为重要研究课题[2]. L-肌肽(L-肌肽nosine)在体内是学名β-丙氨酰-L-组氨酸,是β-丙氨酸与L-组氨酸联合构成的二肽体,为固体结晶状态.人体内脑组织和骨骼肌中均有高浓度肌肽存在,β-丙氨酰-L-组氨酸的合成过程主要发生在肝脏内,特异的发生于肝实质细胞,能够提升骨骼肌咪唑二肽水平、降低抗氧应激、增加肌肉对乳酸的中和能力和抗疲劳能力[3].先前研究显示,若人体每日直接摄取L-肌肽持续4周,能直接增加人体骨骼肌内的肌肽(肌肽nosine,肌肽)浓度,且肌肽中的有效成分咪唑环结构可与铜离子结合,进而降低铜离子催化脂质过氧化效率,同时咪唑环结构能够降低铁离子与过氧化氢的活化程度,从而抑制强氧化物氢氧自由基的生产[4-5].目前国内有关L-肌肽对运动能力、疲劳恢复、抗氧化能力的研究基本停留于动物实验[6],以运动员为对象的较少,国外有部分有关L-肌肽对运动员抗氧化和肌肉损伤方面的研究,但是其运动干预主要以大质量抗阻训练为主[7].本研究以女子足球运动员为研究对象,对其进行为期8周的天然L-肌肽补充,以高强度跑步运动为训练方式,观察L-肌肽补充对女足运动员高强度运动后氧化伤害和肌肉损伤恢复的影响,为L-肌肽作为运动补剂进行使用提供理论依据.
全文HTML
-
本研究对象为西南大学高水平女子足球运动队运动员和西南大学运动训练专业足球专项的女性运动员,共30人,所有受试者均为国家二级运动员以上水平的运动员,其中国家一级运动员12人,平均年龄20.3±3.1岁,身高162.3±8.6 cm,体质量54.6±5.3 kg.
-
满足以下所有条件进入本研究受试者范围:足球训练年限3年以上,每周训练次数2次以上,总时长大于5 h.
-
符合以下条件其中一项被排除本实验受试者范围:患有心脑血管疾病;患有糖尿病;半年内运动系统重大损伤;对L-肌肽.
-
本研究中30名受试者在实验期间,全部按照分组要求按时定量进行摄入L-肌肽或安慰剂,无错服、漏服,无受试者退出实验,所有数据来自全部30位受试者.
-
将受试者随机分为对照组(P组,n=10)、摄入低剂量L-肌肽(low-BETA,LL组,n=10)、摄入高剂量L-肌肽(heigh-BETA,HL组,n=10),具体方案参照如表 1.
-
美国Biodex公司产Biodex-325型等速肌力测试仪,荷兰lode公司产906900型负坡度跑步机;德国AWARENESS公司产AS536紫外分光光度计,日本日立公司产7000型全自动生化分析仪,德国西格玛公司产3k30低温高速离心机,美国布隆伯格公司产CytationTM 5酶标仪,武汉默沙克科技公司产谷胱甘肽酶联免疫分析检测试剂盒,武汉默沙克科技公司生产超氧歧化酶酶联免疫分析检测试剂盒,武汉默沙克生技公司生产谷胱甘肽过氧化酶(Glutathione peroxidase,谷胱甘肽过氧化酶)酶联免疫分析检测试剂盒,武汉默沙克科技公司生产过氧化氢酶酶联免疫分析检测试剂盒,武汉默沙克科技公司生产肌酸激酶酶联免疫分析检测试剂盒,武汉默沙克科技公司生产尿素氮酶联免疫分析检测试剂盒,武汉默沙克科技公司生产乳酸脱氢酶酶联免疫分析检测试剂盒,武汉默沙克科技公司生产谷丙转氨酶活性试剂盒,美国GNC健安喜膳食营养补充剂公司产L-肌肽胶囊,美国GNC健安喜膳食营养补充剂公司植物纤维安慰剂胶囊.
-
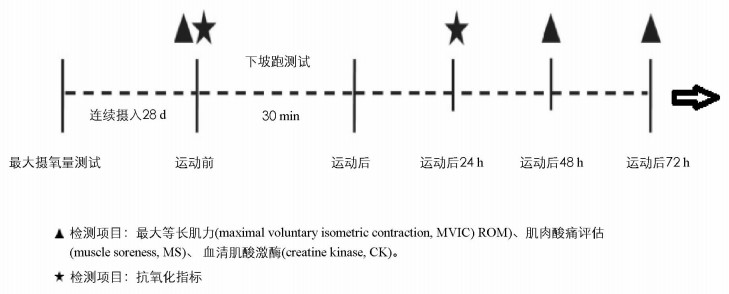
本研究利用平行对照实验进行研究,受试者接受基本身体指标检测后,所有受试者按次序进行最大摄氧量测试,根据个人最大摄氧量表现进行配对分组,参照Kim于2011年的研究,三组受试者分别进行高剂量L-肌肽、低剂量L-肌肽和安慰剂补充,具体方案参照表 1.持续补充28 d后,在下坡跑运动前24 h检测受试者生理指标:最大等长收缩肌力、视觉模拟评分和肌肉损伤指标、氧化应激指标,次日再进行以70%最大摄氧量强度在-15%坡度进行30 min下坡跑运动,在运动后48 h分别检测视觉模拟评分、最大等长收缩肌力、肌酸激酶,谷胱甘肽等指标,实验流程如图 1.
-
受试者在利用持续斜坡方案测验最大摄氧量结束后,绘制摄氧量数据区,通过回归分析确定每位受试者70%最大摄氧量下对应跑速.接着将跑步机坡度调为-15%,再让受试者以个人70%最大摄氧量强度相对跑步速度进行30 min的下坡跑运动.
-
本研究均由执业护士进行血液采集,在下坡跑运动结束后24,48,72 h内对受试者取10 mL上臂静脉血,置于含EDC抗凝管中,常温静置30 min后,置入4 ℃低温高速离心机,在6 000 r/min离心8 min.
-
1) 最大等长收缩肌力
本研究利用美国产Biodex等速肌力测试评估系统检测受试者惯用腿的膝伸肌最大等长收缩肌力.设定受试者膝关节活动范围为0~90°,接着将膝关节弯曲在70°的测试位置(膝关节起始角度水平伸直为0°)后,受试者进行3次测量且每次作最大等长收缩3 s,每次间隔1 min,并取3次的平均值作为受试者最大等长收缩肌力数据.
2) 视觉模拟评分测验
在视觉评估量表上划一条长度10 cm的横线,横线的左端为“0”表示无痛感,右端为“10表示痛感剧烈,中间部分表示不同程度的痛感.受试者根据自身股四头肌感觉在横线上划标记,表示疼痛的程度,测试人员通过测量标记,对痛感进行评分.
3) 抗氧化和肌肉损伤血液指标
利用日本产日立-7000全自动生化分析仪进行肌酸激酶检测,采用酶联免疫法-酶联免疫分析酶法检测谷胱甘肽、谷胱甘肽过氧化物酶、过氧化氢酶和超氧化物歧化酶血尿素氮、肌酸激酶、乳酸脱氢酶和谷丙转氨酶水平的浓度.
-
本研究利用美国IBM公司生产SPSS23.0对所有实验数据进行数理统计,本文数据以Mean±SD进行表达,利用描述性分析对受试者基本信息进行分析,并利用独立样本T检验和单因素方差分析检验各项检测指标组间差异.本研究统计学意义定为p=0.05.
1.1. 研究对象与材料
1.1.1. 纳入条件
1.1.2. 排除条件
1.1.3. 完成情况
1.1.4. 实验分组
1.1.5. 试剂与设备
1.2. 研究方法
1.2.1. 实验设计
1.2.2. 下坡跑测试
1.2.3. 血样采集
1.2.4. 检查项目
1.3. 数理统计分析
-
表 2显示:1)前测P组、LL组、HL组的最大等长收缩肌力、视觉模拟评分前测结果组间没有统计学意义,p>0.05,前测结果不会对干预后结果造成影响. 2)LL组和HL组最大等长收缩肌力后测结果显著高于P组,p < 0.05. 3)LL组和HL组视觉模拟评分后测结果显著低于P组,p < 0.05.
-
表 3显示:1)前测P组、LL组、HL组的尿素氮、肌酸激酶、乳酸脱氢酶、谷丙转氨酶前测结果组间没有统计学意义,p>0.05,前测结果不会对干预后结果造成影响. 2)LL组、HL组的尿素氮、肌酸激酶、乳酸脱氢酶、谷丙转氨酶后测结果显著低于P组,p < 0.05;LL组与HL组的尿素氮、谷丙转氨酶后测结果没有统计学意义,p>0.05;HL组肌酸激酶、乳酸脱氢酶后测结果显著低于LL组,p < 0.05.
-
表 4显示:1)前测P组、LL组、HL组的谷胱甘肽、谷胱甘肽过氧化酶、谷胱甘肽—S转移酶、超氧歧化酶前测结果组间没有统计学意义,p>0.05,前测结果不会对干预后结果造成影响. 2)LL组、HL组的谷胱甘肽、谷胱甘肽过氧化酶、谷胱甘肽—S转移酶后测结果显著低于P组,p < 0.05;HL组谷胱甘肽过氧化酶后测结果显著低于LL组,p < 0.05. 3)LL组、HL组的超氧歧化酶后测结果显著高于P组,p < 0.05,HL组超氧歧化酶后测结果显著高于于LL组,p < 0.05.
2.1. 肌肉疲劳测试结果
2.2. 肌肉损伤指标测试
2.3. 抗氧化指标测试结果
-
目前关于L肌肽对于运动损伤的作用机制的研究中,咪唑环结构与金属离子结合的理论得到较多的认同.持续摄入L肌肽,能够提升人体肌肉组织和血液中的肌肽水平,肌肽中存在的咪唑环结构,通过与铜离子的结合,抑制铜离子对于脂质过氧化物的催化作用,从而减少脂质过氧化物的产生,咪唑环结构与铁离子结合可以减缓过氧化氢的活化,减少体内氢氧根离子,进而抑制活性氧物种的产生,降低体内细胞或组织受到氧化伤害的程度[8].本研究认为通过持续摄入L-肌肽,提升肌肉组织肌肽浓度,肌肽中咪唑环结构与金属离子结合会抑制活性氧化物、脂质过氧化物等氧化应激及炎性物质的生成,减少此类物质诱发的肌肉损伤,降低高强度运动后肌肉损伤表现.目前尚无相关研究探讨摄入L-肌肽对EIMD的影响.本研究结果发现摄入L-肌肽能显著降低下坡跑运动后72 h血清尿素氮、肌酸激酶、乳酸脱氢酶、谷丙转氨酶肌酸激酶的浓度,提升下坡跑运动后最大等长收缩肌力的恢复和降低视觉模拟评分的效果.大负荷向心运动或持续离心等长运动过程中,肌肉产生较大的收缩张力,会导致肌细胞内部微结构受到破环发生损伤,肌节、肌浆网等结构是损伤多发位置.当肌浆网发生机构破坏后,附着其上的钙离子被释放于肌浆中,钙离子则无法返回肌浆网终池进行附着储存,此时容肌肉细胞内钙离子浓度异常升高,会使得肌纤维因持续过度兴奋而发生收缩失调,收缩能力下降,最终体现为最大等长收缩肌力下降[9-10].有研究发现[7],受试者在进行30 min中高强度的离心运动后的48 h内,运动产生的肌肉损伤会影响运动部位最大等长收缩肌力的表现,本研究结果与此相近,受试者完成下坡跑运动后的48 h内最大等长收缩肌力明显低于前测,表示受试者进行下坡跑运动后诱发出肌肉损伤的现象,进而影响肌力.而摄入L-肌肽组HL组和LL组最大等长收缩肌力虽出现下降但是显著高于P组,说明摄入L-肌肽对于疲劳后肌力恢复具有显著作用,而高低剂量间没有显著差别.本研究中,在运动损伤发生后,引起钙离子失衡,并且超出肌肽对钙离子的调节能力,表现为肌肉损伤后最大等长收缩肌力下降,但L-肌肽仍能对此现象有所改善.本研究实验设计中未安排检测肌肉组织肌肽和钙离子水平,所以该机制仍需要进行分子层面研究.有研究显示,进行持续离心运动后,肌纤维会产生损伤,嗜中性白细胞会麇集于损伤部位进行修护[9-11],同时也会诱导活性样物种的产生,进而造成肌肉细胞破坏,导致细胞膜通透性的增加,会造成肌肉细胞内的液体溢出至细胞外围堆积,使肌肉出现肿胀的情况并让肌肉产生发炎反应[12],刺激肌肉细胞内部痛觉神经末梢,引起肌肉产生酸痛感,进而增加视觉模拟评分.
孙景权等研究指出,人体在进行高强度大负荷运动或离心运动后,出现的延迟性肌肉疼痛,一般是肌纤维损伤的表现症状,肌纤维在持续张力中内部微结构受到破坏,会产生趋化性物质,诱导单核细胞、巨噬细胞以及中性白细胞对损伤的结构进行修复,巨噬细胞的聚集会产生前列腺素-E2的释放,前列腺素-E2会刺激肌腱处的痛觉感受端,从而使人感受到来自肌肉的痛感[13]. MENINI S研究中,让受试者在跑步机上进行下坡跑运动,结果发现受试者在停止运动后24,48 h明显增加肌肉酸痛感[14].本研究受试者的视觉模拟评分于下坡跑运动后显著高于基准值,受试者完成下坡跑运动后的24~28 h内皆有明显肌肉疼痛,这说明类似下坡跑等离心运动后容易诱发肌肉损伤.本研究结果发现,摄入L肌肽的受试者视觉模拟评分明显低于服用安慰剂的受试者,表示摄入L-肌肽能够降低下坡跑运动后所产生的肌肉酸痛感.因此推测,持续摄入L-肌肽对下坡跑运动后所引起视觉模拟评分下降可能是由于肌肉L-肌肽浓度抑制运动后肌肉损伤后所引起炎症因子细胞和前列腺素-E2分泌,因而能够显著降低受试者的运动后肌肉痛感.
在评估运动诱发肌肉损伤的程度时,除了测量最大等长收缩肌力、视觉模拟评分外,也可通过测量运动后肌酸激酶的浓度来评估,主要是因为在从事高强度运动或离心运动后,肌纤维产生细微的损伤,会伴随着肌肉细胞膜通透性的增加,使得肌肉细胞内的肌酸激酶会释放至血液中.国外学者在研究中发现,受试者在进行负坡跑运动后,肌酸激酶浓度在运动后48 h达到血样峰值[15].而本研究也发现相同的结果,两组受试者下坡跑运动后肌酸激酶浓度在运动后48 h也达到最高峰,表示受试者皆诱发出肌肉损伤的现象.尽管两组受试者肌酸激酶浓度皆于下坡跑运动后48 h达到最高峰,但下坡跑运动后,HL组、LL组的肌酸激酶浓度显著低于P组的肌酸激酶浓度,摄入L-肌肽可以使下坡跑运动后肌酸激酶浓度提升.虽然目前尚未有研究探讨摄取L-肌肽对离心运动后肌酸激酶的影响,但本研究推测可能的机制,主要通过4周摄入L-肌肽后,增加了肌肉内肌肽浓度,通过肌肽的作用降低了自由基的增加,进而减缓了运动后肌肉细胞膜被破坏的程度,最后减缓下坡跑运动后肌酸激酶浓度的提升.尽管本研究并未测量肌肽的浓度,但根据过去的文献指出,每日摄取2~6 g的L-肌肽,并持续4周以上的摄入,确实能提升肌肉中肌肽的含量[15],未来的研究在探讨L-肌肽摄入与下坡跑运动的相关研究时,应加入测量肌肽含量,以确认L-肌肽摄入可以减缓肌酸激酶浓度的生理机制.在进行完离心运动后,除了会引起肌肉损伤与酸痛的症状之外,另一方面,由于嗜中性白血球大量聚集于损伤部位,同时会产生大量的ROS,但如果人体内抗氧化能力无法缓冲过多的ROS时,肌肉组织内部或细胞膜会遭受到氧化伤害,进而使得细胞脂质被氧化最终形成谷胱甘肽,因此,可以通过检测谷胱甘肽来评估组织或细胞受到氧化伤害的程度[16-17].虽然至今尚未有研究针对L-肌肽摄入对离心运动后引起氧化伤害的影响进行探讨,但一般而言,在进行完离心运动后血浆谷胱甘肽浓度会迅速增加并持续提升至运动后24 h.本研究结果发现,不论是HL组、LL组或P组,在运动后24 h的谷胱甘肽浓度显著低于运动前的谷胱甘肽浓度,推测可能与本研究受试者是有规律运动习惯的关系,所以受试者体内可能有较高的抗氧化能力,因此,谷胱甘肽浓度在运动后24 h并没有提升,甚至谷胱甘肽浓度已经开始下降.另外,本研究结果发现,摄入L肌肽的受试者谷胱甘肽浓度显著低于未摄入L-肌肽受试者的谷胱甘肽浓度,这说明L-肌肽的摄入可以显著降低谷胱甘肽的浓度.先前许多研究中,肌肽中的咪唑环结构能与铜离子结合,能够抑制脂质过氧化的生产,咪唑环结构也能抑制铁离子和过氧化氢的催化作用,减低氢氧根离子产生,减少ROS的大量产生,能防止体内细胞或组织受到氧化伤害[18-20].因此认为持续摄入L-肌肽,能够减少体能自由基生产增加机体抗氧化能力,降低高强度运动后谷胱甘肽的生成速度,使得L-肌肽的摄入可以显著降低谷胱甘肽的浓度.
-
女足运动员连续摄入L-肌肽28 d,有助于高强度运动后缓解肌力减退、肌肉疼痛,改善肌肉疲劳和肌肉损伤现象,降低谷胱甘肽、谷胱甘肽过氧化酶、谷胱甘肽—S转移酶血清浓度,提升超氧歧化酶浓度,增强机体抗氧化作用.此外研究发现,摄入低剂量L-肌肽与高剂量L-肌肽相比在衡量肌肉疲劳损伤和抗氧化等关键指标上没有明显差异.



 下载:
下载: