-
运动员在高海拔地区训练生活,能够增加肌肉线粒体产生三磷酸腺苷(Adenosine triphosphate,ATP)的效率[1];能够有效提升肌氧饱和度(Saturation muscle oxygen,SmO2),也能显著促进无氧运动能力[2],所以高原训练一直被认为是提升运动表现、有氧能力、无氧速度的有效方式.有研究发现长期高原训练,机体血液循环处于低氧再充氧的剧烈变化状态,在低氧再充氧的刺激下,对红细胞可能造成较严重的氧化伤害[3].为避免长期低氧暴露造成的氧化伤害,许多运动员采用高住低训或高训低住的方式进行高原训练,该方法能够减少在高海拔地区的滞留时间,并充分利用高原训练急性效应,达到提升体能的目的[4].目前大部分有关急性高原训练的研究主要集中在正面训练效应,但在有关实地单次高原耐力运动氧化伤害或氧化压力方面却鲜被提及.短时间低氧环境能够诱发红细胞的氧化压力增加和氧化伤害发生[5],持续高氧化压力会提升细胞癌变、心血管疾病、细胞脱氧核糖核酸损伤的发生概率[4],在高原进行急性耐力运动可导致低氧灌注的次数增加,进而诱发氧化伤害,对运动者运动后恢复和身体状况产生不利影响.本研究组织受试者分别在高原地区和低海拔环境进行力竭性功率车耐力运动,比较运动后对人体氧化代谢压力变化差异.进而探讨高原耐力运动诱发人体急性氧化代谢压力的原因和评价单次高原力竭性耐力运动的危险性,为教练员更科学合理地实施高原计划提供理论参考.
全文HTML
-
本研究招募全日制在校大学生38名(男生20人,女生18人,平均年龄21.5±1.5岁,平均身高168.9±10.5 cm,平均体质量59.3±12.6 kg;最大功率:183.5± 32.5 W,最大摄氧量(maximal oxygen intake,VO2max):45.8±11.8 mL/(min·kg).在正式实验前10 d,所有受试者均须填写实验知情同意书和本人健康状况调查表,购买运动意外险.在整个实验过程中禁止服用任何药物以及补充含有抗高原反应、抗氧化成分的添加剂如红景天、维生素D、葡萄籽等.
-
1) 没有规律运动健身习惯,没有运动员经历;2)17 kg/m2 < BMI < 24 kg/m2;3)年龄大于18岁;4)半年内没有运动系统严重伤害.
-
1) 患有慢性疾病包括代谢率和心脑血管疾病;2)患有肺、肝、肾脏疾病;3)患有运动系统伤病;4)长期服用抗氧化剂类补剂;5)生源地为西藏、青海、云南以及家乡海拔大于1 800 m地区的学生.
-
在实验前2周内完成所有受试者最大运动功率负荷测定后,受试者分组进行低海拔环境(海拔600 m以下)或高原(海拔2 400 m)进行竭性耐力蹬功率车测试,全部受试者均需在低海拔地区和高原环境下完成,两次测试的清除期至少为7 d,以消除之前的训练效应.耐力运动测试须由专业护士采集受试者运动前(Pre)、运动后即刻(Post)、运动后10 min (Post10)、运动后60 min(Post60)、运动后120 min(Post120)、运动后240 min(Post240)血液,进行生化分析(图 1).
受试者在进行耐力运动负荷前3 d到训练结束,由实验组织者对受试者进行配餐供给,其中糖类占55%~64%,脂肪占20%~23%,蛋白质占18%~19%,总热量约10 465~11 721 kJ.在运动前2 h实行禁食禁水,其余时间水分自由摄入[6].在高原进行耐力运动前至少进行48 h适应.
-
本研究利用荷兰产LODE功率车和美国产AEI MAX Ⅱ运动心肺测试系统进行递增负荷直至力竭,测得受试者最大摄氧量(VO2max)和最大功率(Wmax).力竭判断标准为,负荷其中一项可判断为力竭:1)呼吸交换率大于1.1以上;2)心率大于220减去年龄;3) VO2增加率小于2 mL/(min·kg),呈现持平状态;4)受试者无法在当前功率下完成60~70 r/min的踩踏频率.
-
本研究在低海拔环境下利用LODE功率车和美国产AEI MAX Ⅱ运动心肺测试系统进行递增负荷测试,利用AcqKnowledge软件计算出每位受摄者VO2max,VO2max对应功率;70% VO2max,70% VO2max对应功率;90% VO2max,90% VO2max对应功率等指标.而受试者高原环境摄氧量,根据刘宪瑞[4]研究,海拔高度大于1 500 m后,高度每上升300 m,人体VO2max下降3%的计算原则进行推算;本研究中高原环境海拔为2 388 m,所以受试者高原VO2max较低海拔地区VO2max下降9%,受试者高原VO2max ,VO2max对应功率;70% VO2max,70% VO2max对应功率;90% VO2max,90% VO2max对应功率等指标也依此推算.
-
随机选取1/2受试者进行低海拔环境力竭性耐力蹬功率车测试,其余受试者则进行高原力竭性耐力蹬功率车测试,测试结束后7 d两组受试者进行调换.在低海拔环境与高原环境,利用荷兰产LODE功率车模式进行次最大强度运动,受试者70% VO2max所对应的功率车负荷为初始功率,受试者进行45 min运动后,运动负荷增加至90% VO2max所对应的功率车负荷,运动持续直至受试者出现力竭.
-
本研究利用美国产AEI MAX Ⅱ心肺功能测试系统对运动负荷进行控制.在耐力运动组受试者佩戴呼吸面罩、流量传感器、气体采集线,将运动中呼出气体至混合箱利用4.2L混合气体法进行分析.本研究利用AcqKnowledge软件作为实时信息监控,依据当次环境数据计算其标准状态下的摄氧量.在70%最大摄氧量阶段:功率车初始负荷设定为受试者70% VO2max 对应负荷.主试在运动过程中进行负荷监控,每3 min可以对功率车负荷进行调整,使运动强度始终保持在70%~75% VO2max范围内.在90% VO2max至力竭阶段:采用90% VO2max强度负荷直至力竭,运动过程中不对运动负荷进行修正.
-
由专业护士采集受试者Pre,Post0,Post10,Post60,Post120,Post240的血液置于含有肝素钠抗凝剂试管中.将所有血样利用国产润华80-2台式离心机以4 000 r/min离心10 min,后置于-80 ℃冰箱.
-
红细胞比容(hematocrit,Hct):本研究利用吸管吸取血样,进行密封并利用OptimXPN超速离心机再以14 000 r/min离心10 min,后测其Hct.
乳酸浓度(lactate,LT):本研究抽取2 μL血浆样本,利用美国产SpectraMax iD3多功能酶标仪进行检测分析.
尿酸浓度(lithic acid,UA):本研究抽取3 μL血浆样本,利用美国产SpectraMax iD3多功能酶标仪进行检测分析.
葡萄糖浓度(glucose,GLU):将反应液与检体以4.5:1比例于37 ℃反应15 min,利用美国产SpectraMax iD3多功能酶标仪进行检测分析.
-
羰基蛋白(carbonyl protein)浓度:从总血样中抽取50 μL血浆样本,利用美国产SpectraMax iD3多功能酶标仪进行检测分析.
硫代巴比妥酸反应物质(thiobarbituric acid-reactive substance,TBA-RS)浓度:从总血样中抽取50μL血浆样本,利用美国产SpectraMax iD3多功能酶标仪进行检测分析.
氮氧化物(nitrogen oxides,NOX)浓度:从总血样中抽取10 μL血浆,滴入60 μL硫酸锌溶液(0.3 N)、100 μL纯水.均速震荡后,常温环境静置10 min.利用湘仪-gf-8高速低温离心机,4 ℃环境下6 000 r/min离心3 min,取上清液100 μL,在室温下,置于震荡器内反映12 h,后再次离心,取上清液65 μL放入微盘.取50 μL磺胺加入,高速震荡1 min,加入50 μL 0.1% N-1-萘基乙二胺盐酸盐,震荡5 min,利用多功能酶标仪检测NOX浓度.
-
过氧化氢酶(catalase,CAT):利用吸管吸取20 μL血样,利用美国产SpectraMax iD3多功能酶标仪进行检测分析,依据标准曲线计算CAT活性.
超氧歧化酶(superoxidase dismutase,SOD):利用吸管吸取20 μL血样,利用美国产SpectraMax iD3多功能酶标仪进行检测分析,并依照标准曲线计算其活性.
谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px):利用吸管吸取20 μL血样,利用美国产SpectraMax iD3多功能酶标仪进行检测分析,通过5次连续测量,计算出斜率,换算出GSH-Px活性.
-
本研究使用SPSS 13.0统计软件进行数理统计,利用描述性分析(Descriptive Statistics)、双因素方差分析(Two-way ANOVA)对本实验所有数据进行统计分析,本研究显著水平为α = 0.05.
1.1. 研究对象
1.1.1. 准入标准
1.1.2. 排除标准
1.2. 实验设计
1.3. 负荷与功率测定
1.3.1. 力竭运动测试
1.3.2. 低海拔环境与高原的耐力负荷
1.3.3. 力竭性耐力蹬功率车测试负荷
1.4. 运动负荷控制
1.5. 采血与血液生化分析
1.5.1. 血本采集和红细胞比容(Hct)测量
1.5.2. 代谢指标检测分析
1.5.3. 氧化压力指标检测分析
1.5.4. 抗氧化酶活性分析
1.6. 数据处理与统计
-
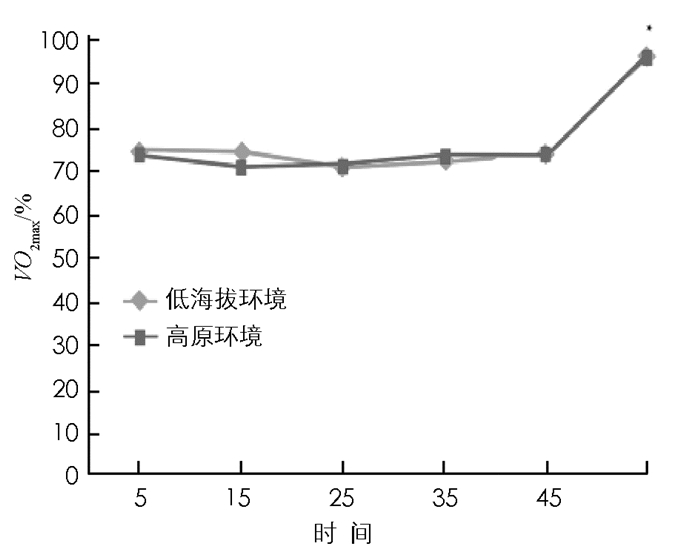
由图 2可知,在耐力训练中低海拔环境和高原环境耐力训练的运动强度控制基本一致.低海拔环境和高原环境耐力运动力竭时的运动强度,均显著高于运动第5 min时的运动强度(p < 0.05).表明本实验的耐力训练较好地控制了运动强度,运动干预手段可靠.
-
表 1显示:在高原环境进行耐力运动前、运动后即刻、运动后240 min 3个时刻中,男性与女性在血浆蛋白浓度、红细胞比容、乳酸、尿酸、葡萄糖浓度、羰基蛋白、硫代巴比妥酸反应物、氮氧化物浓度、超氧歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶活性指标数值上差异均无统计学意义(p < 0.05).
表 2显示:在低海拔环境进行耐力运动前、运动后即刻、运动后240 min 3个时刻,男性与女性在血浆蛋白浓度、红细胞比容、乳酸、尿酸、葡萄糖浓度、羰基蛋白、硫代巴比妥酸反应物、氮氧化物浓度、超氧歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶活性指标数值上差异无统计学意义(p < 0.05).
本研究中代谢压力指标和氧化压力指标在不同性别间没有显著性差异,能够将男、女各项指标合并进行分析.
-
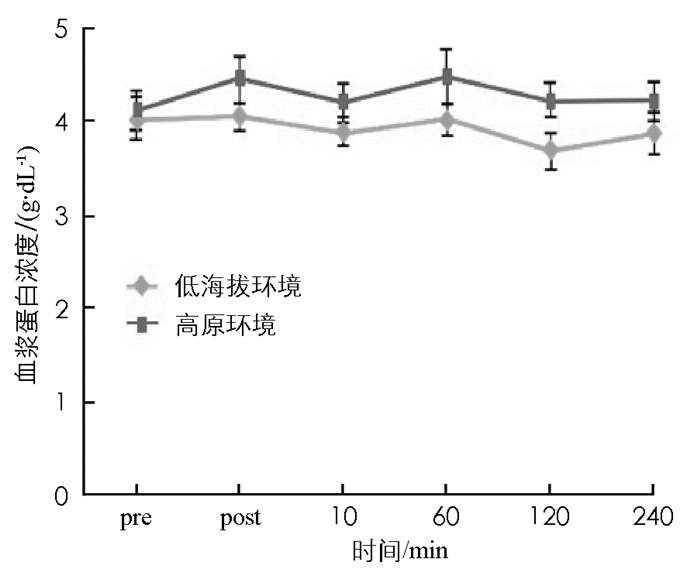
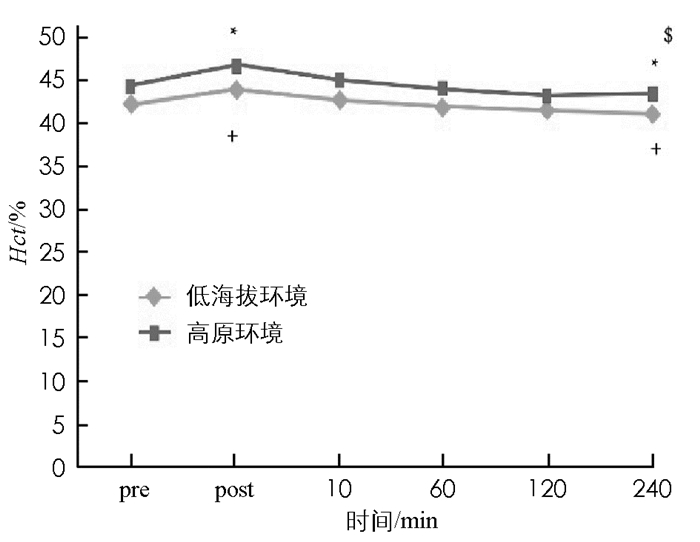
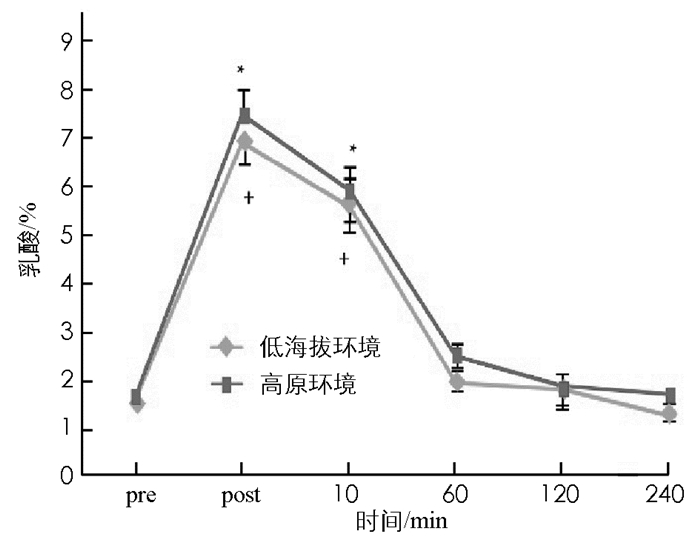
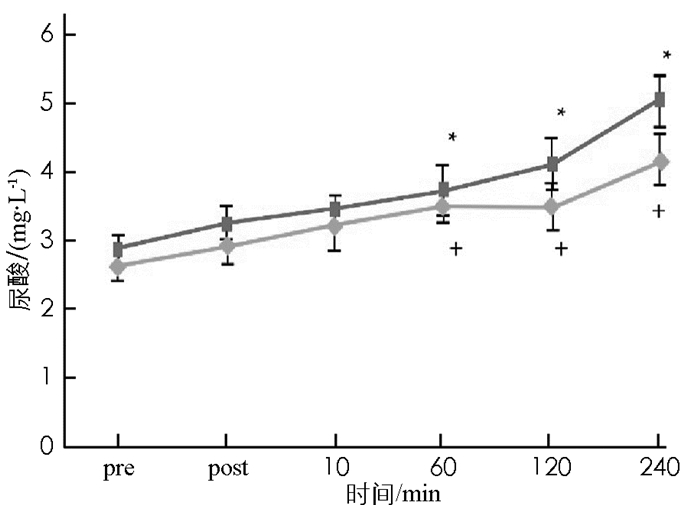
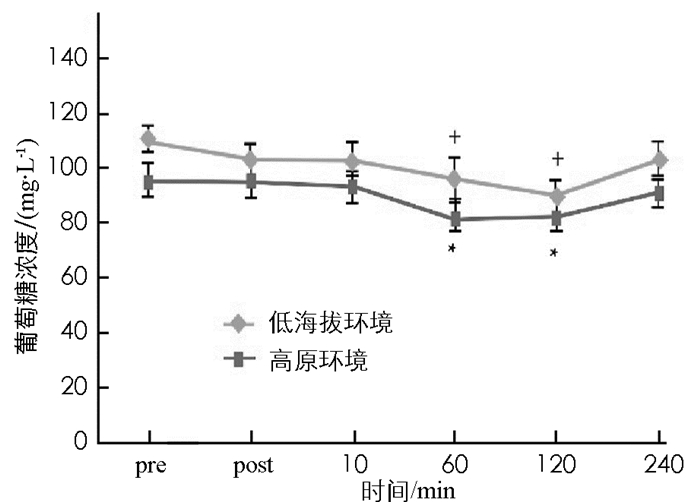
图 3至图 7显示:1)受试者在低海拔环境和高原环境进行耐力运动,血浆总蛋白浓度差异无统计学意义(p>0.05).表明高原环境耐力运动不会造成血浆总蛋白浓度的显著改变. 2)高原环境和低海拔环境耐力运动后即刻红细胞比容(Hct)均显著高于运动前(p < 0.05),后均呈逐步下降趋势,直至运动后240 min,两者Hct显著低于运动前(p < 0.05).组间比较显示,高原环境Hct显著高于低海拔环境(p < 0.05). 3)受试者在完成高原环境和低海拔环境耐力运动后即刻和运动后10 min的乳酸(LT)浓度均出现显著上升,明显高于运动前的LT浓度(p < 0.05),低海拔环境耐力运动后受试者LT浓度变化明显小于高原环境. 4)受试者完成高原环境和低海拔环境耐力运动后的60 min,120 min以及240 min的尿酸(UA)浓度仍持续上升,显著高于运动前UA浓度(p < 0.05),组间比较表明,高原环境UA浓度显著高于低海拔环境(p < 0.05). 5)受试者在完成高原环境和低海拔环境耐力运动后60 min,120 min后其葡萄糖(GLU)浓度显著低于运动前(p < 0.05).组间比较显示高原环境GLU浓度显著低于低海拔环境(p < 0.05).
-
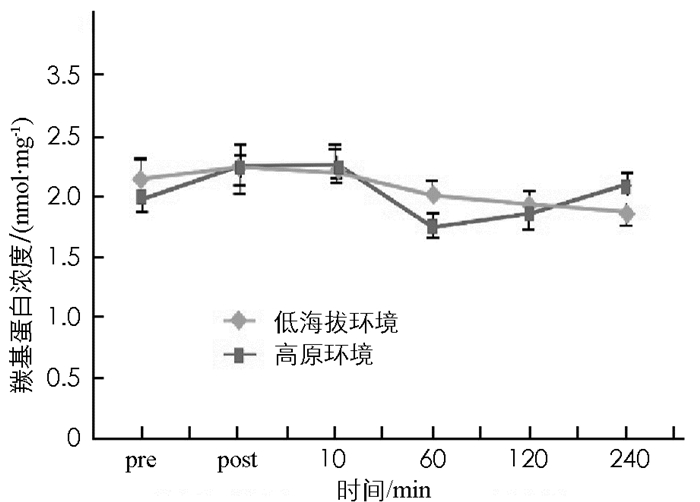
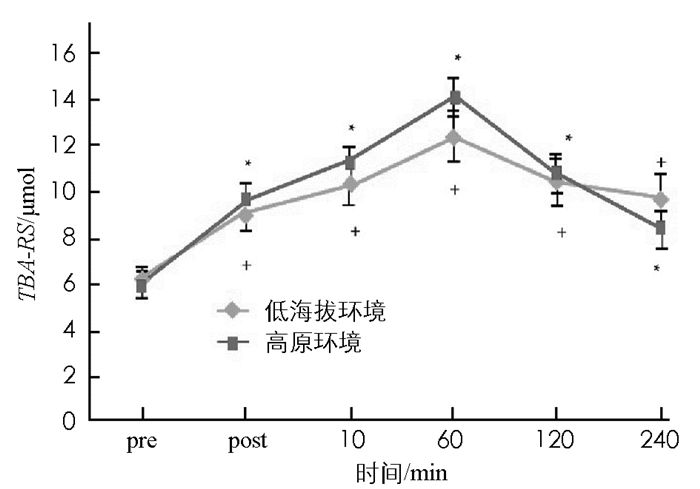
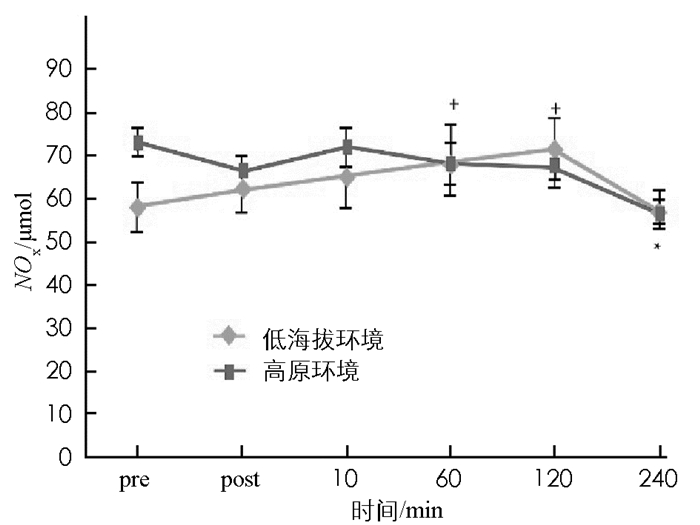
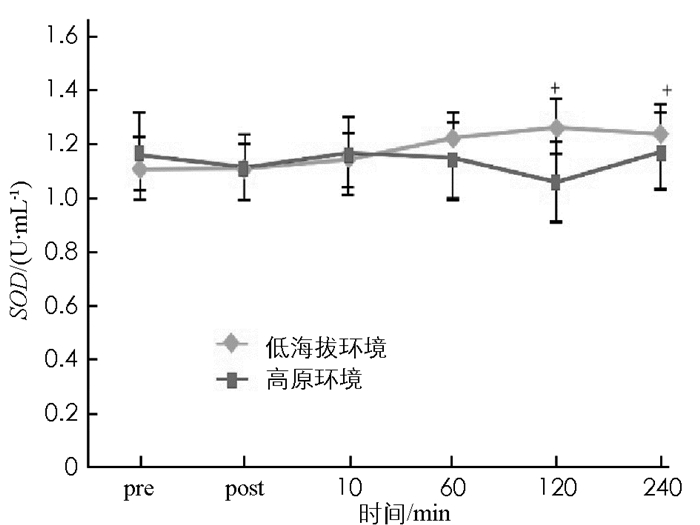
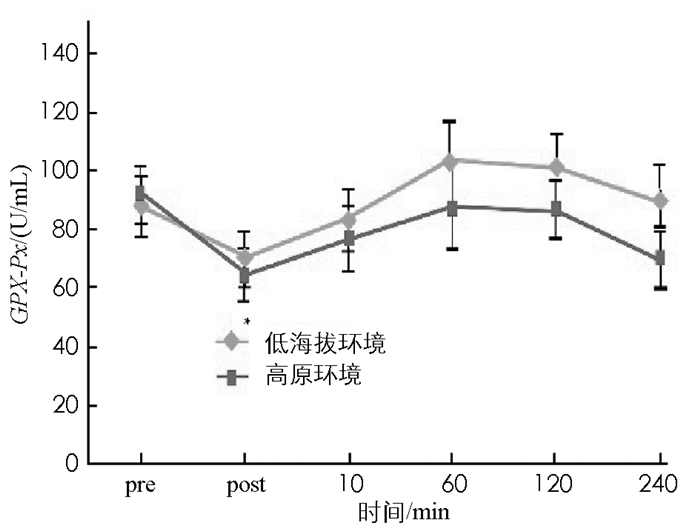
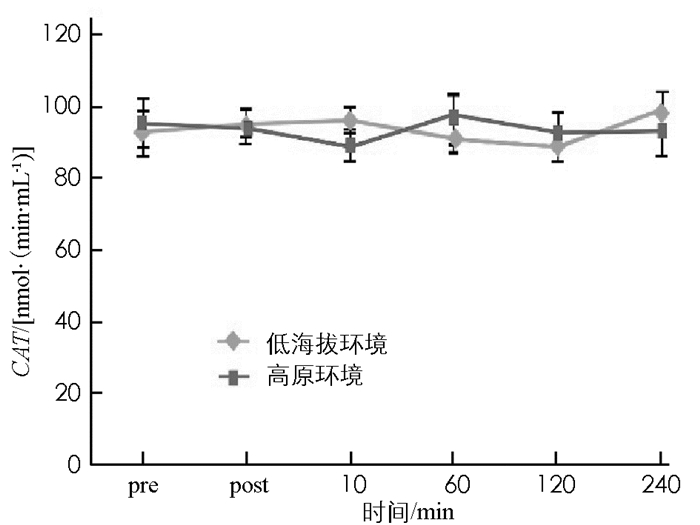
图 8至图 13显示:1)受试者完成高原环境和低海拔环境耐力后,羰基蛋白浓度变化无统计学意义(p>0.05). 2)高原环境和低海拔环境耐力运动后10 min,60 min,120 min,240 min的TBA-RS浓度显著高于运动前(p < 0.05).高原环境和低海拔环境耐力运动后TBA-BS浓度组间差异无统计学意义(p>0.05). 3)低海拔环境耐力运动完成后60 min,120 min的氮氧化物NOX浓度,显著高于运动前NOX浓度(p < 0.05).高原环境完成耐力运动后240 min的NOX浓度显著低于运动前NOX(p < 0.05),高原环境和低海拔环境耐力运动后NOX浓度组间差异无统计学意义(p>0.05). 4)低海拔环境耐力运动后120 min,240 min的超氧歧化酶(SOD)活性显著高于运动前(p < 0.05).高原耐力运动后与运动前差异无统计学意义(p>0.05),高原环境和低海拔环境耐力运动后SOD活性组间差异无统计学意义(p>0.05). 5)低海拔环境耐力运动后各时刻谷胱甘肽过氧化物酶(GSH-Px)与运动前差异无统计学意义(p>0.05).高原环境耐力运动后即刻GSH-Px显著低于运动前(p < 0.05),高原环境和低海拔环境耐力运动后GSH-Px组间差异无统计学意义(p>0.05). 6)低海拔环境和高原环境耐力运动后的过氧化氢酶(CAT)活性差异无统计学意义,组间差异亦无统计学意义(p>0.05).
2.1. 运动中运动强度(VO2max)的控制
2.2. 不同性别代谢压力和氧化压力指标比较结果
2.3. 不同环境耐力运动代谢压力指标比较结果
2.4. 不同环境耐力运动氧化压力相关指标变化
-
本次实验以海拔2 400 m高度作为干预环境,该高度符合国际通常认为2 100~2 500 m适宜的高原训练环境,研究发现不论是在高原还是低海拔地区,男性与女性在耐力运动前、后的代谢和氧化压力差异无统计学意义.在高原进行单次耐力运动,对羰基蛋白、硫代巴比妥酸反应物、氮氧化物浓度、超氧歧化酶等氧化压力指标并无显著的影响,但对于乳酸、尿酸、萄萄糖等人体代谢的指标与低海拔环境的耐力运动后相比差异具有统计学意义,以上现象表明单次高原耐力运动与低海拔环境耐力运动后的人体代谢状况差异明显,单次高原耐力运动会导致代谢压力剧增.本研究认为单次高原急性的耐力运动,对于机体造成的氧化压力与在低海拔环境差异无统计学意义.
-
本研究发现不论在高原环境还是低海拔坏境进行耐力运动前、运动后即刻、运动后240 min 3个时刻,男性与女性在血浆蛋白浓度、红细胞比容、乳酸、尿酸、葡萄糖浓度、羰基蛋白、硫代巴比妥酸反应物、氮氧化物浓度、超氧歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶活性指标数值上差异无统计学意义(p < 0.05).与甘春龙等[2]发现的男、女在高原训练后尿酸、葡萄糖浓度、乳酸等指标没有显著差异;与康喜来[5]研究发现在急性高原运动后,不同性别运动员羰基蛋白、氮氧化物浓度、超氧歧化酶测试结果基本一致. TSOLAKIS等[7]指出首次高原运动后男性与女性在血浆蛋白浓度、红细胞比容以及过氧化氢酶活性指标没有显著差异,变化趋势基本一致.以上研究与本研究结果高度相似,这说明性别不是代谢压力指标和氧化压力指标的主要因素,且不同性别间测试结果差异无统计学意义,可以将男、女数据合并进行分析.
-
本研究的所有受试者皆为健康的青年,排除了代谢疾病潜在的患者.控制饮食和部分时段饮水前提下,高原环境血糖浓度显著低于低海拔环境.周磊[8]研究发现糖尿病患者短期在高海拔地区进行定量运动,可以控制血糖、降低血液总胆固醇、缓解胰岛素抵抗等现象.高原环境被认为能够改变糖类的代谢,可能是由于低氧刺激使人体产生应激,导致体内胰岛素样生长因子-1(insulin like growth factor,IGF-1)、白细胞介素-3((interleukin-3,IL-3)、干细胞生长因子(Stem Cell Growth Factors,SCGF)浓度增加,而诱导活性氧物种的生成[2,7-9],而活性氧物种能促进细胞对葡萄糖的摄取[10],从而增加运动系统无氧糖酵解.也有研究认为低氧的环境诱发缺氧诱导因子-1生成,进而增加糖转运酶和无氧解酶的活性[11],使糖的转运速度和分解速度增加[5,12].本研究中受试者在高原环境进行耐力训练后,血糖浓度明显低于低海拔地区,再次证实高原环境中低氧刺激可以使人体糖代谢发生变化,糖的利用速率高于人体在低海拔地区.此外本研究中受试者在高原耐力运动后尿素会出现显著升上,刘宪瑞[4]研究认为在高原人体尿酸浓度变化受氧浓度和体力活动量双因素的控制.尿酸常作为人体产生氧化应激的早期标志物,因为当超氧离子浓度升高时,尿酸浓度也会随之上升,具有较好的参照性[13].人体内的鸟嘌呤、次黄嘌呤可以氧化成为黄嘌呤,进一步氧化后生产尿酸[14];机体缺血性再灌流情况下,辅酶Ⅰ和氧分子作为电子的受体,生成活性氧物种,在代谢过程中产生氧自由基,并生成尿酸.尿酸是活性氧物种变化的指示物,同时尿酸亦是抗氧化物[4,15],GARRY等研究证实尿酸能够缓解运动诱发的氧化伤害[15].运动刺激增加体内尿酸浓度,可能是人体防止氧化伤害的生理反馈机制[4].过去研究发现高海拔与低海拔环境进行耐力运动后,其乳酸浓度没有差异;这与本研究结果有所不同,本研究中高原环境进行耐力运动后,乳酸浓度远高于低海拔环境对应时刻的乳酸浓度.这可能与高原氧浓度低,机体在运动中产生大量氧债,在运动后进行机体偿还有关.沈艳梅等[16]研究中也证实高原环境下运动能够增加糖的消耗,运动后血乳酸上升明显.本研究中Hct受到环境和运动双因素影响,高原环境Hct显著高于低海拔环境;运动后即刻Hct,高原和低海拔环境均显著高于运动前.长期低氧刺激下,心房促进血浆量降低形成较高血浓度,同时血浆蛋白也随之增加[13],人体若接受低氧刺激时间较短,可能此机制对血浆浓度和血浆蛋白影响不大;过去探究中发现短时间低氧刺激后,Hct增加的原因是总血浆量减少造成的[17],因此推论,高原环境Hct增加的原因可能是高原低压环境引起脱水,进而造成总血浆量的减少,导致较高的Hct.本研究认为环境所造成的代谢压力造成葡萄糖、尿酸、乳酸与Hct的改变.
-
先前研究认为高海拔攀登活动显著增加人体氧化压力[18].但类似结果均为与低海拔环境运动作为对照,所以不能证明高原的环境是导致其氧化压力增加的因素.也有研究认为高氧化压力会造成蛋白羰基浓度上升,因此认为其是蛋白质遭受氧化伤害的生物指标;TBA-RS可作为机体脂质遭受氧化伤害的指标,是细胞受脂质氧化伤害的重要表征.本研究中高原环境与低海拔环境下进行耐力运动后其羰基蛋白浓度、TBA-RS浓度差异无统计学意义,因此可以认为在海拔2 400 m的高原进行急性耐力运动,不会比低海拔地区做相同运动产生更多的氧化伤害.
本研究结果表明高原环境并不会诱发体内羰基蛋白浓度和TBA-RS浓度上升,反而竭性耐力运动则会导致TBA-RS浓度发生变化.可以认为耐力运动会增加体内脂质氧化伤害,且影响时长达240 min.本研究耐力运动后脂质氧化伤害情况,与先前研究结果相似,脂质氧化伤害的峰值一般出现于运动后60 min. NOX是一氧化氮的产物,NO作为自由基,能造成人体氧化伤害,但可促进循环和内分泌调节[19-20].本研究中,低海拔环境与高原环境的NOX浓度差异无统计学意义,但受耐力运动刺激后,其变化趋势却不相同.低海拔环境NOX浓度在耐力运动后60 min,120 min较运动前显著提升,在运动后120 min达到血样峰值;而高原环境耐力运动完成后NOX浓度虽不稳定,但总体呈持续下降趋势,在完成运动后240 min左右其浓度低于运动前水平.有学者认为NO的浓度上升与急性高原反应有关[21-22].高原反应易感人群,体内NO浓度显著低于未发生高原反应人群;人体受到低氧刺激后内皮细胞释放NO进行调节.据此推断,本实验中受试者初入高原,产生低氧应激,导致NOX基础值明显上升,在进行耐力运动后,由于有较高的NOX基础值,受运动调节后NOX的浓度呈下降趋势;而低海拔环境中,受试者安静状态下,NOX基础值低,在耐力运动后,由于氧亏或氧债导致机体产生低氧刺激,而使机体有产生较高NOX浓度.
-
抗氧化酶活性变化与机体受到的氧化压力直接相关.人体受到适当氧化压力,会促进机体产生氧化防御机制即抗氧化反应,当氧化压力过大时反而会有抑制的作用.有研究认为剧烈运动产生ROS能促使SOD活性增加,产生激效作用.长期接受高强度训练的耐力运动员,体内CAT活性与运动训练量呈负相关[23].蒋丽等[24]研究发现生活和居住在高海拔地区的居民中,有高原肺水肿病史的居民体内SOD活性显著低于无高原肺水肿病史居民.目前对人体内抗氧化酶活性产生变化的解释说法不一,但大部分学者均认同抗氧化酶活性变化是一种机体为应对氧化压力增加而进行的调节[25].本结果显示,受试者在低海拔环境与高原环境接受耐力运动后,其SOD,GSH-Px,CAT活性并未呈现显著差异.综上分析可得,进行单次的高原耐力运动后其抗氧化酶活性与在低海拔地区进行耐力运动后水平基本一致,不会产生抗氧化酶活性大幅提升的现象.
3.1. 性别对于代谢压力和氧化压力的影响
3.2. 高原运动对葡萄糖、尿酸、乳酸浓度、红细胞比容、血浆总蛋白的影响
3.3. 高原运动对氧化压力与伤害的影响
3.4. 高原运动对抗氧化酶活性影响
-
急性高原耐力运动与在低海拔环境进行的耐力运动对机体造成的氧化压力基本一致,但代谢压力远大于低海拔环境.高原环境下耐力运动会使葡萄糖浓度显著降低,Hct显著上升,其可能与低氧环境下机体水分大量散失、造成血浆总量下降有关.在低氧环境下,糖类与水分增量补充非常必要,能够有效改善人体的运动表现.



 下载:
下载: