-
中国的甘薯种植面积占世界50%以上,是全球的甘薯生产大国[1-2].甘薯富含纤维、淀粉、维生素和蛋白质等[3].甘薯淀粉生产会产生大量废水,废水中富含水溶性物质,如β-淀粉酶(1,4-α-D-glucan maltohydrolase EC3.2.1.2)的含量非常高[4],回收该β-淀粉酶可创造巨大的经济效益.我国甘薯消费以鲜食和加工为主,由于甘薯品种多元化,因此推广面积有所增加.研究和利用高淀粉甘薯品种的一个重要任务就是探究β-淀粉酶性质. β-淀粉酶是一种外切酶,在高等植物内比较常见,断裂淀粉的非还原性末端的α-1,4糖苷键,逐个除去二糖单位,最后形成大约50%的麦芽糖和大分子核心—β-极限糊精[5]. β-淀粉酶多用于医药、酿造、纺织以及食品加工行业[6],在食品发酵方面可以作为饮料、啤酒等生产的糖化剂;在啤酒酿造上,利用β-淀粉酶代替麦芽,可节约麦芽用量,辅料比可提高50%~75%[7];在食品行业,主要用来生产麦芽糊精、麦芽糖和麦芽糖浆.不同物种、同物种不同品系来源的β-淀粉酶,其特点和含量差别较大[8-9];不同的提取分离纯化方法其纯化效果也有较大差别[10-11].本实验以重庆市甘薯工程研究中心综合应用型甘薯品种“渝薯17”为实验材料,分离纯化β-淀粉酶并研究其酶学性质,为综合利用和深度开发β-淀粉酶奠定理论基础.
全文HTML
-
新鲜“渝薯17”块根,由重庆市甘薯工程研究中心实验基地提供.
DEAE-Sepharose、Superdex-200、蛋白质SDS-PAGE Marker标准品、Superdex-200凝胶层析分子质量标准品(美国GE Healthcare公司);葡聚糖2000(瑞典Pharmacia公司);甲叉-双丙烯酰胺、丙烯酰胺(瑞士Fluka公司);考马斯亮蓝R-250(美国Bio-Rad公司);考马斯亮蓝G-250(美国Sigma公司).其他试剂均为国产分析纯.
-
精密电子天平(瑞士Mettler-Toledo公司);多功能食品加工机(德清拜杰电器有限公司);pH计(上海理达仪器厂);高速冷冻离心机(美国Thermo Scientific公司);电泳仪、蛋白质纯化收集系统、垂直电泳槽(美国Bio-Rad公司);冷冻干燥机(德国Uni Equip公司);超纯水仪(美国Millipore公司);紫外分光光度计UV-2550(日本岛津公司);恒温水浴锅(常州易晨仪器制造有限公司)等.
-
β-淀粉酶酶活力测定采用DNS法[12]:反应体系2.05 mL,1 mL 0.05 mol/L pH值5.6柠檬酸缓冲液,0.5 mL 1%可溶性淀粉,50 μL酶液,37 ℃保温3 min,0.5 mL终止液DNS,沸水浴5 min,冷却至室温,加15 mL去离子水,混合均匀,测OD 540 nm吸光值.对照组先加DNS后加酶液.酶活力单位(U)定义:在实验条件下(37 ℃,pH值5.6),以每分钟催化底物(淀粉)产生1 mg麦芽糖所需的酶量为1个酶活力单位(U).
-
在凝胶层析前采用紫外分光光度法测蛋白质浓度,凝胶层析后用考马斯亮蓝法测定蛋白质浓度[13].
-
取10 g新鲜“渝薯17”样品,按1:10(m/V)加入预冷的0.05 mol/L pH值7.0 Tris-HCl匀浆,4 ℃抽提2 h,纱布过滤,离心30 min(4 ℃,4 700 r/min),上清液即为β-淀粉酶的粗酶液.
-
向粗酶液中加入预冷乙醇至乙醇浓度为40%,静置2 h(4 ℃),4 700 r/min(4 ℃)离心30 min,继续向上清液中加预冷乙醇至乙醇浓度60%,4 ℃静置2 h,4 700 r/min(4 ℃)离心30 min,弃上清,沉淀用10 mL 0.05 mol/L pH值7.0 Tris-HCl溶解,即为β-淀粉酶初酶液.
-
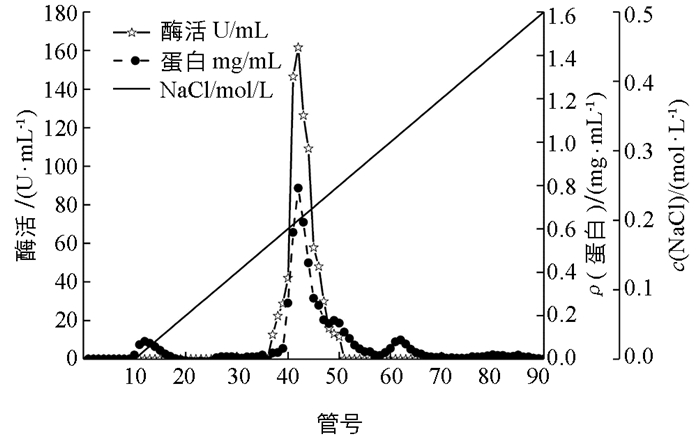
用0.05 mol/L pH值7.0 Tris-HCl(含1 mol/L NaCl)缓冲液洗脱DEAE-Sepharose离子交换层析柱300 mL(3~4个柱床体积),再用0.05 mol/L pH值7.0 Tris-HCl平衡300 mL,流速1 mL/min.取10 mL初酶液上样,用0~0.5 mol/L NaCl(0.05 mol/L pH值7.0 Tris-HCl配制)进行线性洗脱,流速0.5 mL/min,每管收集5 mL.测每管β-淀粉酶活力和蛋白含量.
-
用0.05 mol/L pH值7.0 Tris-HCl缓冲液平衡Superdex-200凝胶过滤层析柱2~3个柱床体积.将DEAE-Sepharose酶活管浓缩成5 mL样品上样,0.05 mol/L pH值7.0 Tris-HCl缓冲液洗脱,流速0.3 mL/min,每管收集3 mL.测每管酶活力及蛋白含量.收集酶活峰酶液,去离子水透析48 h(4 ℃)后冷冻干燥.
-
用SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行β-淀粉酶亚基分子量计算和纯度鉴定. SDS-PAGE分离胶和浓缩胶质量分数分别为12%和5%,上样量10 μL.通过SDS-PAGE测定β-淀粉酶亚基分子量,通过Superdex-200测定其全酶分子量.
-
取经“1.3.6”步骤纯化并稀释一定倍数的酶液,在pH值5.6、不同温度(25~70 ℃)下测定β-淀粉酶活力,最高酶活力设置为100%,计算各温度下β-淀粉酶的相对酶活力,确定最适反应温度.将纯化的酶液稀释,置于不同温度条件(20~60 ℃)下,按照“1.3.1”方法,每隔30 min测一次酶活,未保温的酶活力设置为100%,计算不同时间及不同温度条件下β-淀粉酶的相对酶活,研究该酶的热稳定性.
-
取纯化并稀释一定倍数的酶液,在37 ℃、不同pH值(3.0~10.0)下测定β-淀粉酶活力,最高酶活力设定为100%,测定各pH值下β-淀粉酶相对酶活力,确定最适反应pH值.将纯化的酶液稀释,取100 μL与不同pH值(4.0~10.0)缓冲液等体积混合,静置3 h(4 ℃),每隔30 min测一次酶活力,以相同酶液与去离子水等体积混合测得的酶活力为100%,计算不同pH值、不同时间β-淀粉酶的相对酶活力,研究该酶的pH值稳定性.
-
将不同浓度(10~50 mmol/L)、不同金属离子和稀释一定倍数的β-淀粉酶纯化酶液1:1混合,静置30 min(4 ℃)后测酶活力.以等体积的酶液与去离子水混合作为对空白对照,酶活力设为100%,测不同浓度以及不同金属离子对β-淀粉酶的相对酶活.
-
以去离子水与稀释一定倍数的酶液等体积混合作对照,酶活力设定为100%,将不同浓度(5~25 mmol/L)的抗坏血酸(Vc)、尿素、乙二胺四乙酸(EDTA)、草酸、十二烷基硫酸钠(SDS)分别与相同酶液等体积混合,静置30 min(4 ℃)后测相对酶活力,研究不同浓度、不同化合物对β-淀粉酶的影响.
-
将不同体积分数(10%~50%)的甲醇、乙醇、正丙醇、正丁醇和稀释一定倍数的β-淀粉酶酶液1:1混合,对照组同“1.3.11”,静置30 min(4 ℃)后测相对酶活力,研究不同浓度、不同有机物浓度对β-淀粉酶的影响.
-
配制不同浓度(0.1%~0.8%)的可溶性淀粉溶液,在最适反应条件下测β-淀粉酶活力,采用双倒数(Lineweaver-Burk)作图法,求β-淀粉酶的Km值和Vmax.
1.1. 材料与试剂
1.2. 仪器与设备
1.3. 实验方法
1.3.1. β-淀粉酶活力测定
1.3.2. 蛋白质浓度测定
1.3.3. β-淀粉酶粗酶液的制备
1.3.4. 乙醇分级沉淀
1.3.5. DEAE-Sepharose离子交换层析
1.3.6. Superdex-200凝胶过滤层析
1.3.7. β-淀粉酶纯度鉴定与全酶分子量测定
1.3.8. 最适反应温度与温度稳定性
1.3.9. 最适反应pH值与pH值稳定性
1.3.10. 不同金属离子对β-淀粉酶活性影响
1.3.11. 不同化合物对β淀粉酶活性影响
1.3.12. 不同有机物对β-淀粉酶活性影响
1.3.13. β-淀粉酶最大反应速率(Vmax)与米氏常数(Km)的测定
-
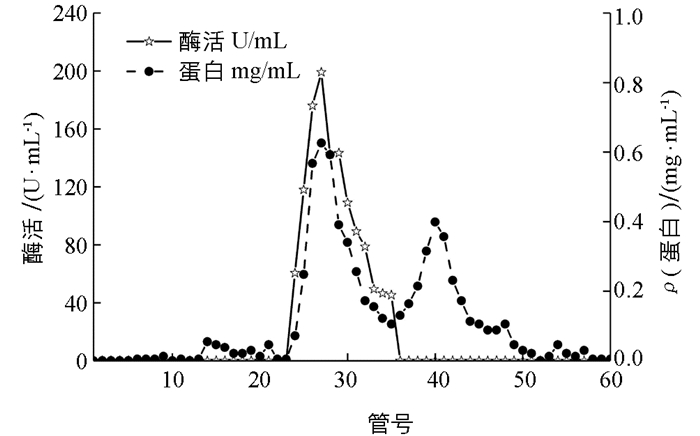
β-淀粉酶经DEAE-Sepharose离子交换层析后,酶活峰主要集中在38-49号管(图 1),42管酶活性最高,收集酶活性较高管的酶液浓缩上样,经Superdex-200凝胶过滤层析后,酶活峰集中于24-35号管(图 2),27管酶活最高,用去离子水透析48 h,冷冻干燥后进行SDS-PAGE,结果显示单一条带(图 3),说明该β-淀粉酶已经达到电泳纯. 10 g鲜质量甘薯的β-淀粉酶纯化结果如表 1所示.
-
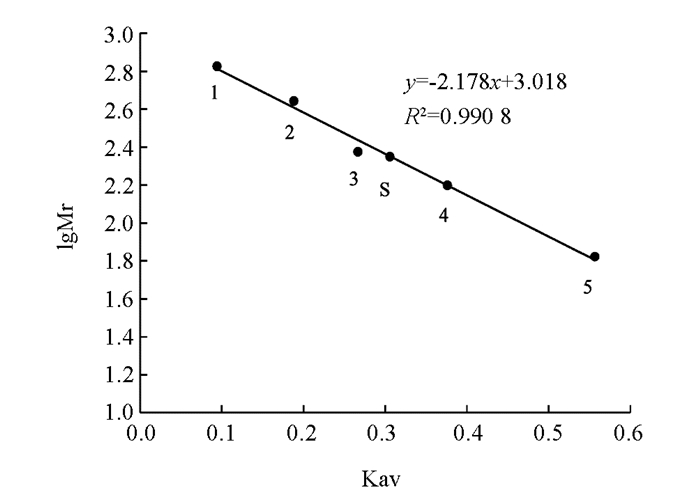
经SDS-PAGE测得β-淀粉酶的亚基分子量约为55.12 kD(图 3),经过Superdex-200测得全酶分子量约为223.54 kD(图 4),推算β-淀粉酶由4个相同的亚基构成.
-
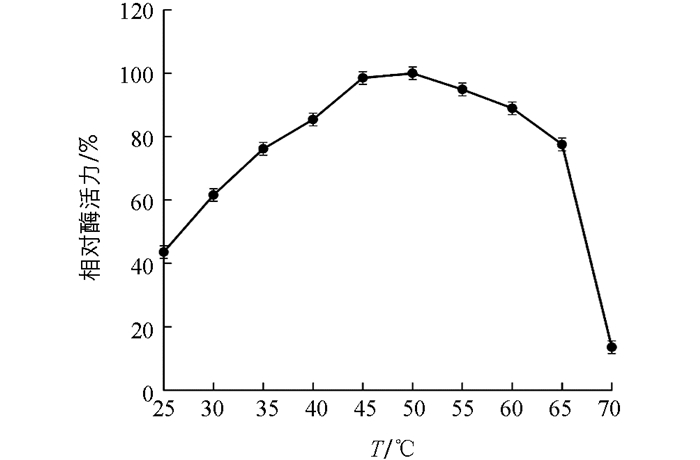
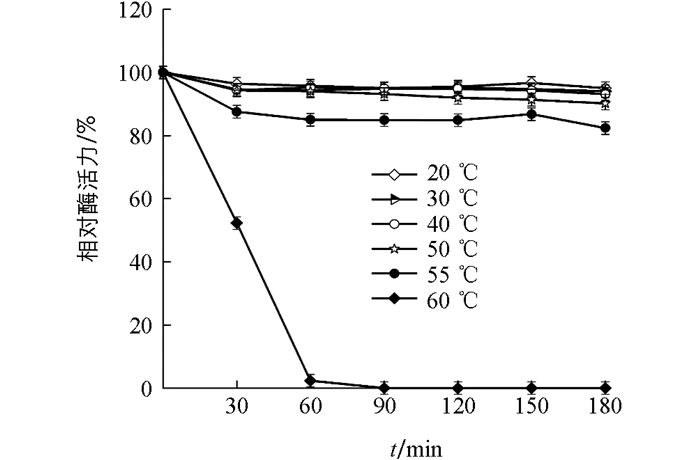
实验结果表明,“渝薯17”β-淀粉酶最适温度为50 ℃(图 5).将酶放置在不同温度条件下孵育,随时间增长,20~50 ℃条件下相对酶活力基本不变;55 ℃相对酶活力80%以上;60 ℃条件下酶活力迅速降低,30 min时相对酶活力52.30%,60 min时几近失活.因此“渝薯17”β-淀粉酶在50 ℃以下具有良好的热稳定性(图 6).
-
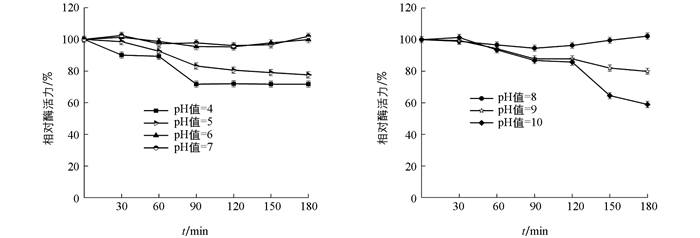
为更准确研究“渝薯17”β-淀粉酶最适pH值,本实验pH值选择3~5、7~10(间隔梯度1),5.4~6.8(间隔梯度0.2)[14].结果表明,此酶最适pH值为6.2(图 7). pH值3,酶无活力,随pH值增大,相对酶活力先升高后降低. pH值5.8~6.6范围内相对酶活力可达90%以上;pH值6.8时,相对酶活力力低于80%;pH值10时,相对酶活力仅17.4%.将酶于不同pH值条件下保温,随时间延长,pH值4,5,9,10相对酶活力逐渐降低;180 min时pH值4,5,9相对酶活力不及80%,pH值10仅58.94%;pH值为6~8时相对酶活力保持在100%左右.因此,pH值为6~8时β-淀粉酶具有较好稳定性(图 8).
-
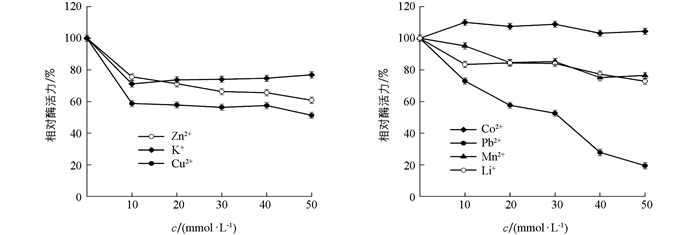
结果表明(图 9),Co2+对该酶具有一定程度的激活作用;Mn2+,Pb2+,Li+,Zn2+,K+,Cu2+对该酶有不同程度的抑制作用.其中,Pb2+的抑制作用最大,随其浓度增大,相对酶活力逐渐降低,当浓度达50 mmol/L时,相对酶活力不足20%.
-
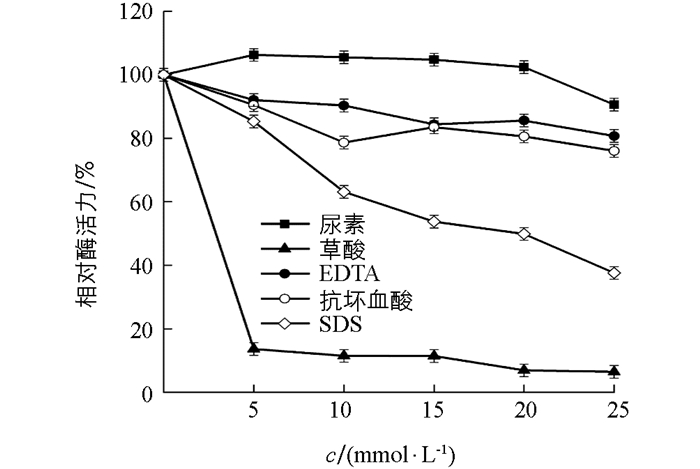
结果显示(图 10),草酸对β-淀粉酶有明显的抑制作用,5 mmol/L时,相对酶活力13%;25 mmol/L时,接近失活. SDS对该酶也具一定的抑制作用,25 mmol/L时,相对酶活力为37%.低浓度尿素对β-淀粉酶有激活作用,5 mmol/L时,相对酶活力超过100%;10~20 mmol/L时,酶活力保持相对稳定;25 mmol/L时,相对酶活力仍有90.6%. EDTA和抗坏血酸对该酶的影响作用不明显.
-
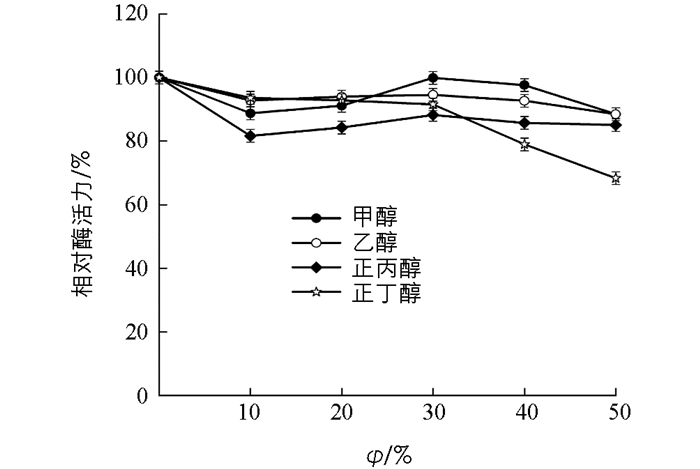
4种不同的有机溶剂对β-淀粉酶有不同程度的影响(图 11).甲醇、乙醇、正丙醇对酶活力影响不大,正丁醇体积分数为40%时,酶活性骤然下降,体积分数为50%时,相对酶活力仅有68%.
-
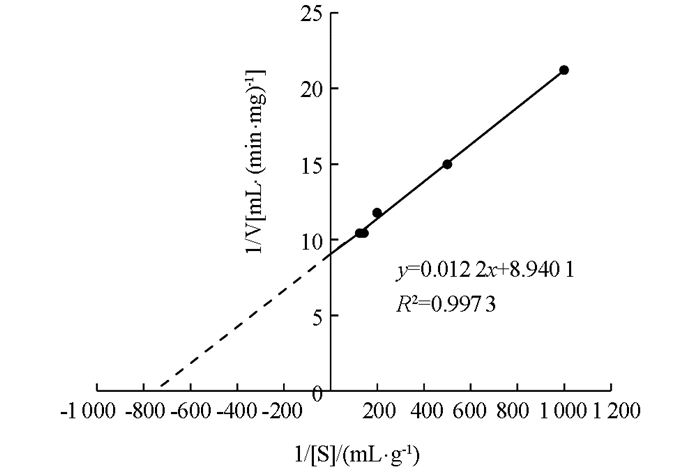
在最适反应条件下(50 ℃,pH值6.2),以不同质量分数的可溶性淀粉作为β-淀粉酶反应底物,测定其反应速率(V),利用双倒数(Lineweaver-Burk)作图法计算1/V与1/S的关系(图 12),β-淀粉酶的Km值为0.001 36 g/mL,Vmax为0.112 mg/mL·min.
2.1. β淀粉酶的分离纯化
2.2. β淀粉酶全酶分子量测定与纯度鉴定
2.3. β淀粉酶的部分酶学性质研究
2.3.1. 最适反应温度与温度稳定性
2.3.2. 最适反应pH值与pH值稳定性
2.3.3. 不同金属离子对β-淀粉酶活性影响
2.3.4. 不同化合物对β-淀粉酶活性影响
2.3.5. 不同有机物对β-淀粉酶活性影响
2.3.6. β-淀粉酶米氏常数(Km)与最大反应速率(Vmax)的测定
-
本实验以10 g“渝薯17”样品1:10(m/V)提取比例分离出β-淀粉酶,粗酶液总酶活5 667.53 U,比活力33.53 U/mg.经乙醇沉淀、DEAE-Sepharose和Superdex-200层析后得到电泳纯酶,总酶活3 774.57 U,比活力333.15 U/mg,高于市售枯草杆菌来源酶活(50 U/mg),高于紫甘薯Superdex-200层析比活力35.50 U/mg[15]以及“宁紫1号”Superdex-75层析12.34 U/mg[16];纯化倍数为9.93倍,高于“宁紫1号”(7.2倍)[16],低于“徐薯18”(11.85倍)[17]和大豆乳清废液(16.49倍)[18].本实验酶回收率为66.60%,高于紫甘薯(0.92%)[15]、麦芽(41.1%)[19]、大豆乳清(17.32%)[18]和“宁紫1号”(16.7%)[16].
“渝薯17”β-淀粉酶的酶学性质与其他来源的有所不同[17].该β-淀粉酶的最适反应温度和pH值分别是50 ℃和6.2.最适温度高于紫甘薯(40 ℃,pH值6.8)[15],低于大豆乳清(55 ℃,pH值6.0)[18],同麦芽(50 ℃,pH值5.5)[19]、甘薯(50 ℃,pH值5.0)一致[4];最适pH值高于麦芽[19]、甘薯[4]、大豆乳清[18],低于紫甘薯[15].亚基分子量约为55.12 kD,全酶分子量约为223.54 kD,与“徐薯18”、大豆、紫甘薯和麦芽等[16-19]的结果接近.
金属离子Co2+对酶有一定的激活作用,原因可能是酶与金属离子、底物形成的三元复合物降低了反应活化能,进而提高反应速率[25];Mn2+,Pb2+,Li+,Zn2+,K+和Cu2+对酶有不同程度的抑制作用.其中,Pb2+抑制作用最大.原因可能是在该金属离子影响下,酶的空间结构受到较严重影响,构象中心发生变化,使酶活降低[20].
草酸对β-淀粉酶的抑制作用很明显. 5 mmol/L时,相对酶活只有13%;浓度为25 mmol/L时,几乎失活. SDS在一定程度上对该酶也有抑制作用,可能原因是SDS破坏酶分子中的氢键和疏水键,降低酶活性.低浓度尿素对β-淀粉酶有激活作用. EDTA是金属螯合剂,能阻止Pb2+等金属离子对酶的抑制作用,同时也阻止Co2+等对酶的激活作用,故EDTA对β-淀粉酶的影响不明显.
本实验提取了高纯度、高回收率、高纯化倍数的甘薯β-淀粉酶,对甘薯淀粉生产中的废水利用可提供一定的技术指导.实验过程统一使用同一缓冲液,操作更简便,适合于规模化生产.



 下载:
下载: