-
开放科学(资源服务)标志码(OSID):

-
水稻是世界上最重要的粮食作物之一,其产量与世界粮食安全问题息息相关. 水稻产量由单位面积有效穗数、每穗粒数以及千粒质量决定,其中,由籽粒长、宽、厚决定的籽粒形态可以通过影响千粒质量进而影响水稻产量.
近年来,与水稻籽粒形态发育相关的基因逐渐被克隆,遗传调控网络也逐渐完善. 在已克隆出的粒型发育基因中,GW2,GW5/GSE5,GS5,GW8和TGW2等基因主要控制粒宽,其中GW2编码一个RING-like E3泛素连接酶,通过将底物锚定到蛋白酶体进行降解,从而负调节细胞分裂,突变后增加了颖壳细胞的数目,导致粒宽和粒质量增加[1]. GW5/GSE5编码一个钙调素结合蛋白,是BR信号传导的正调控因子,通过影响颖壳的细胞数目来控制粒型;其与OsGSK2互作,抑制GSK2的自磷酸化及GSK2对OsBZR1和DLT的磷酸化,从而影响细胞核中未磷酸化的OsBZR1和DLT蛋白的积累[2-3]. GW8编码一个包含SBP结构域的转录因子OsSPL16,该基因的高表达能促进细胞分裂和灌浆从而促进水稻粒宽增加和增产;进一步发现GW8/OsSPL16直接与GW7启动子结合并抑制它的表达,从而增加横向细胞分裂正向调控水稻粒宽[4-6]. GS3,TGW6,OsLG3,GLW7,GL4,qGL3/GL3.1,qLGY3/OsLG3b,TGW3和GL6等基因主要控制粒长,其中GS3编码非典型的G γ亚基,与DEP1或GGC2竞争性结合Gβ亚基,负向调控籽粒长度[7-8]. GLW7编码SBP结构域的转录因子OsSPL13,正向调控颖壳细胞的扩展,从而提高了水稻的粒长和产量[9]. OsLG3编码AP2/ERF类乙烯反应元件结合蛋白,通过促进细胞增殖正向调控粒长,且在不影响稻米品质的情况下提高水稻产量[10]. GL2/GS2,GL7/GW7,GW6a和GS9等基因同时控制粒长和粒宽,其中GL2/GS2编码的转录因子OsGRF4属于GRF家族蛋白成员,主要通过促进细胞扩张和少量细胞增殖正调控籽粒大小[11-12]. GL7/GW7编码一个TONNEAU1募集基序蛋白,表达量上调能增加颖壳细胞的纵向分裂并减少横向分裂[8]. GW6a编码一个具有组蛋白乙酰转移酶活性的类GNAT蛋白OsglHAT1,通过增加细胞数和增大颖壳,同时加速籽粒灌浆速率,正向调控籽粒大小和粒质量[13]. 综上,参与水稻籽粒大小调控的基因较多,涉及了多种信号转导以及生化代谢途径.
本研究报道了一个与水稻籽粒发育相关的突变体,主要表现为细胞增殖与细胞扩展异常导致的籽粒变小. 遗传分析表明该突变性状受1个单隐性基因控制,我们将其命名为small grain 2(smg2). 通过BSA法,我们将SMG2定位在水稻第1染色体上IN/DEL标记A-0.85和A-1.05之间,物理距离大约为200 kb. 测序发现定位区间内编号LOC_Os01g02890基因的第1个外显子上第153位碱基胞嘧啶(C)缺失,从而导致移码突变和蛋白翻译提前终止,最终将候选基因定为LOC_Os01g02890. 本研究为SMG2基因后续调控籽粒形态发育的分子机制解析奠定了基础.
HTML
-
水稻smg2突变体来源于甲基磺酸乙酯(EMS)诱导的西大1B(XD1B)诱变群体,经过多代自交进行分离纯化后,突变性状得到稳定遗传. 选用粳稻品种中花11(ZH11)与smg2突变体杂交,播种杂交产生的F1种子,F1群体自交,得到分离群体F2的种子并播种,将F1和F2群体用作进行遗传分析和基因定位的材料.
-
挑取野生型和smg2突变体成熟期的籽粒,用扫描电镜(日立SU3500,日本株式会社)和体视镜(NIKON SM1500,NIKON CORPORATION Shlnagawa Interclty Tower C,2-15-3,Konan,Minato-ku,Tokyo 108-6290 Japan)观察表型并拍照. 在抽穗期选取野生型和突变体的小穗,置于FAA固定液(50%无水乙醇,0.9 mol/L的冰乙酸和3.7%甲醛)中4 ℃,16 h以上固定细胞形态;后依次使用乙醇进行梯度脱水,二甲苯进行透明处理并浸蜡,用石蜡包埋处理. 使用石蜡切片机切出12 μm厚的蜡带,轻挑蜡带平放于载玻片上,经过展片、烘片后,进行染色并用中性树脂封片,用光学显微镜(NIKON E600,NIKON CORPORATION Shlnagawa Interclty Tower C,2-15-3,Konan,Minato-ku,Tokyo 108-6290 Japan)观察制作好的石蜡切片并拍照.
-
统计分析于2021年夏的水稻抽穗期与成熟期进行,随机选取抽穗期的野生型和突变体各10个小穗进行石蜡切片观察,每张切片统计小穗外稃横向细胞数量;随机选取成熟期的野生型和突变体各10个籽粒进行扫描电镜观察,统计外稃纵向细胞数量;随机选取10株野生型和10株突变体,统计穗长、一次枝梗、二次枝梗、穗粒数、结实率、粒长、粒宽和粒质量等农艺性状.
-
以smg2突变体和ZH11杂交获得F1,F1自交后代种植获得F2群体,观察F1表型和F2表型的分离情况,并对F2群体中具有突变体表型植株和正常单株进行统计,对分离比例进行卡方测验.
-
在ZH11/smg2杂交构建的F2群体中选取突变单株作为定位群体,使用BSA法进行目标基因的定位[14]. 根据F2植株表型,分别选取10株正常单株和10株突变单株,剪取等量叶片,构建正常基因池和突变基因池. 用CTAB法提取亲本、基因池和定位群体单株的DNA[15]. 定位引物选用SSR和IN/DEL引物,由北京擎科生物科技有限公司合成. PCR总体系为15.0 μL,含2.0 μL 10×PCR buffer,0.4 μL 2.5 mmol/L dNTPs,10.3 μL ddH2O,10 μmol/L的前后引物各0.5 μL,1.0 μL模板DNA,0.3 μL 5 U/μL Taq酶. PCR程序为94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃复性1 min,35个循环;72 ℃延伸10 min. PCR产物经2.5%琼脂糖凝胶电泳后观察. 将只呈现ZH11带型的单株记为A,只呈现smg2带型的单株记为B,同时呈现双亲带型的单株记为H,用Mapmaker3.0软件分析数据并作图,根据Gramene网站(http://www.gramene.org/)的水稻基因组信息构建物理图谱,基因定位所用引物见表 1.
-
注释基因信息从Gramene网站(http://www.gramene.org/)上查询所得,根据从网站下载的注释基因序列,用PrimerPrimer5.0软件设计特异性扩增引物[16]. 分别以野生型和smg2突变体DNA为模板扩增目标序列,由测序公司进行测序分析,扩增引物序列见表 2.
1.1. 试验材料
1.2. 形态与组织学分析
1.3. 统计分析
1.4. 遗传分析
1.5. 分子标记定位及连锁图谱构建
1.6. 候选基因分析
-
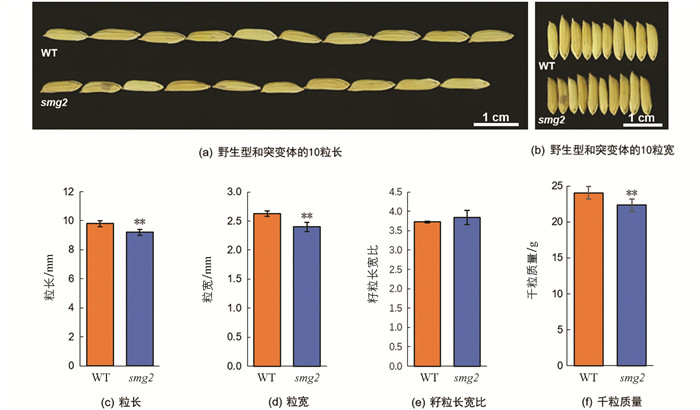
与野生型(WT)相比,突变体smg2籽粒显著变小(图 1a,b),粒长、粒宽分别只有9.20 mm和2.41 mm,为野生型的93.88%和91.25%(图 1c,d),而长宽比差异无统计学意义(图 1e). 由于突变体粒长粒宽均减小,导致千粒质量也有显著降低,统计结果表明,smg2突变体千粒质量为22.22 g,相较于野生型下降了7.67%(图 1f).
-
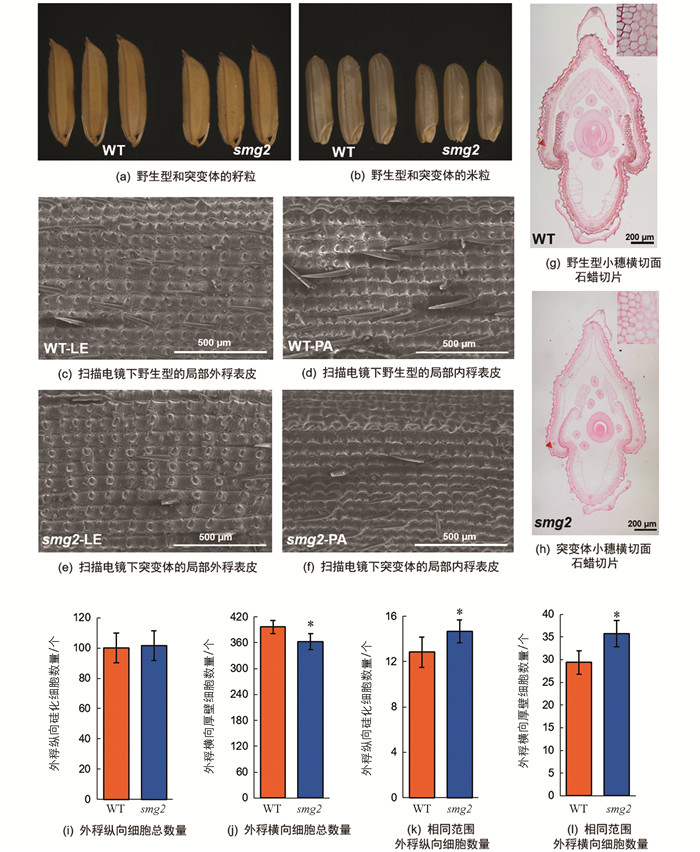
为了探究籽粒变小的具体原因,我们对smg2突变体成熟籽粒的颖壳进行了细胞学分析(图 2).
首先,通过扫描电镜观察发现,在相同范围内smg2突变体内、外稃上的纵向硅化细胞数量显著多于野生型(图 2c,d,e,f,k),这说明突变体颖壳纵向细胞长度变短,但整个外稃纵向上硅化细胞的总数量在野生型与突变体间差异无统计学意义(图 2i). 两方面的数据综合表明,smg2突变体籽粒变短的主要原因是颖壳细胞纵向扩展不足. 通过石蜡切片分析开花期小穗的颖壳横向细胞数目和特征,统计发现野生型的细胞数量为396个,突变体的细胞数量为362个,突变体相对于野生型减少了8.59%(图 2g,h,j),表明smg2突变体颖壳横向细胞增殖受到了抑制. 统计切片中相同视野范围内的横向细胞数量,发现突变体的细胞数量显著多于野生型,增加了22.60%(图 2l),这说明smg2突变体颖壳横向细胞的扩展也受到了抑制. 以上分析表明,SMG2基因一方面通过调控细胞扩展影响籽粒长度的发育,另一方面通过调控细胞增殖和细胞扩展影响籽粒宽度的发育.
-
smg2突变体表现为半矮化性状(图 3a),其茎秆倒1节和倒2节明显短于野生型(图 3b). 由于倒1节变短,突变体还表现出明显的包穗性状,大部分分化后发育成熟的穗被包裹于剑叶内,无法正常抽穗(图 3c). 突变体穗长仅为19.53 cm,极显著短于野生型(图 3d);一次枝梗数量减少26.17%,极显著低于野生型(图 3e);二次枝梗数量极显著高于野生型,增加了46.30%(图 3f);每穗颖花数和每穗粒数均极显著低于野生型,分别降低了26.30%和41.40%(图 3g,h);突变体结实率仅为65.80%,极显著低于野生型(图 3i).
-
smg2突变体与ZH11杂交F1与野生型的表型一致,而F2出现性状分离. 对F2群体进行统计,其中正常表型植株140株,smg2突变表型植株44株,分离比为3.18∶1,经卡方测验其分离比符合3∶1(χ2=0.045<χ0.052=3.84),结果表明smg2突变性状受1对隐性单基因控制.
-
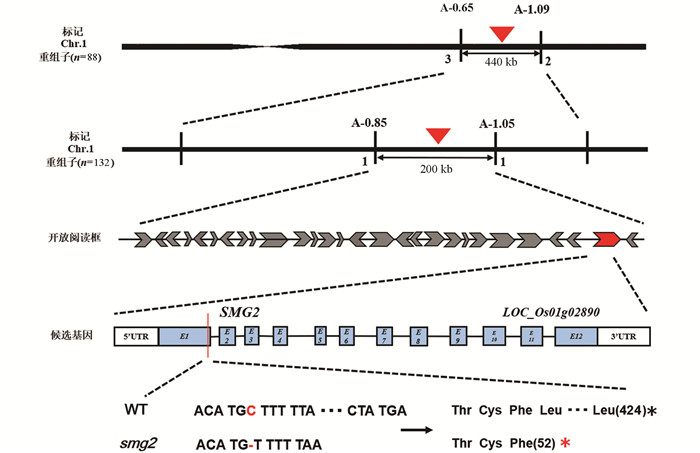
定位群体选择F2分离群体中表现出突变体性状的植株. 随机选取F2群体中野生型和突变体各10株,提取DNA构建基因池. 以父本ZH11和母本smg2为模板,选用200对平均分布于水稻所有染色上的SSR引物和IN/DEL引物,对亲本进行多态性分析,发现位于第1染色体长臂端的IN/DEL标记A-0.65,A-1.09,A-1.67,A-2.35,A-2.40以及SSR标记RM10445R在两个基因池中具有多态性,用这6对标记分析F2中的44株突变单株,重组子个数分别为3,2,6,9,10,25,初步将smg2定位在A-0.65和A-1.09之间;在这两个引物之间进行区间缩进,发展了3对IN/DEL引物筛选66株突变单株,重组子个数分别为2,1,1. 根据重组子数目和相互关系,最终将SMG2基因定位在IN/DEL标记A-0.85和A-1.05之间,物理距离200 kb(图 4).
-
根据测序品种日本晴的序列和基因注释信息(http://www.gramene.org/和http://rice.plantbiology.msu.edu/),在定位区间内(物理距离约200 kb)共有28个注释基因(表 3). 在这些注释基因中,有5个编码具有蛋白激酶结构域的蛋白质,5个编码逆转录转座子蛋白,4个基因编码抗性相关的受体蛋白,3个基因编码激酶相关的受体蛋白,其余11个基因编码一些不同类型的蛋白质(表 3),其中LOC_Os01g02890基因编码1个磷脂酰丝氨酸合酶. 先前有报道该基因发生突变后穗颈节极度缩短从而产生包穗性状[17],这与本研究中smg2突变体表型类似,猜测LOC_Os01g02890可能是SMG2的候选基因. 对该基因进行PCR测序分析,LOC_Os01g02890包含12个外显子,编码框基因组全长6 563 bp,CDS全长1 275 bp,编码包含424个氨基酸的蛋白质. 测序结果表明,在突变体中,LOC_Os01g02890基因的第1个外显子的第153位碱基发生了单碱基缺失,相比野生型缺失1个胞嘧啶(C),移码突变后导致第52位氨基酸由亮氨酸变成终止密码子,蛋白翻译提前终止,因此将LOC_Os01g02890基因暂定为SMG2基因的候选基因(图 4).
2.1. smg2突变体的籽粒表型观察
2.2. smg2突变体颖壳的细胞学观察
2.3. smg2突变体的植株形态观察
2.4. smg2突变体的遗传分析
2.5. SMG2基因的定位
2.6. SMG2候选基因的分析
-
籽粒形态是水稻产量和稻米外观品质的主要影响因素之一,因此水稻粒型发育基因的克隆与分子机制研究对于水稻高产育种研究具有重要意义. 然而影响籽粒形态的基因涉及多个调控途径且数量庞大,为了深入研究水稻籽粒形态发育调控机制,本研究从籼稻保持系XD1B诱变群体中鉴定了一个小粒突变体smg2,通过图位克隆将候选基因暂定为LOC_Os01g02890. 该基因先前报道了多个等位突变体,其中sui1-1,sui1-2,sui1-4等位突变体性状均表现为抽穗期最上部节间显著缩短,导致整穗或者部分穗被剑叶包裹而不能正常发育[17-19]. 在本研究中,smg2突变体除了表现出矮化包穗外,还具有粒长、粒宽、结实率均显著降低等性状,因此我们推测smg2应为LOC_Os01g02890的一个强等位突变体. 在以前的研究中,Yin等[18]研究表明突变体节间缩短是由于节间中Intercalary meristem(IM)未启动发育,认为SUI1家族基因通过调控水稻节间IM的发育和穗茎轴的细胞扩张来影响水稻的节间发育;Ma等[19]研究认为SUI1基因通过调控细胞壁成分的分泌来控制水稻特别是穗颈节间的细胞伸长. 本研究中我们详细分析了smg2突变体颖壳的发育特征,发现SMG2基因通过调控细胞扩展来影响颖壳的纵向和横向发育,这与先前的研究是一致的. 我们还发现SMG2也作用于细胞增殖来影响颖壳的宽度发育,这暗示其在籽粒形态发育中的功能与其在上部节间发育中的功能可能并不完全一致.
-
水稻籽粒的粒型和粒质量一方面由颖壳大小和形状限制,另一方面与其内部组织,尤其是胚乳生长发育密切相关. 水稻籽粒最外层被一层坚硬的颖壳包裹,由外稃和内稃组成的颖壳在很大程度上限制了籽粒的生长能力,因此颖壳细胞的数量、大小能够影响水稻粒长、粒宽和粒厚,进而决定水稻籽粒大小. 近年来,人们鉴定了许多与水稻籽粒大小发育相关的基因,它们中绝大多数都是通过调控颖壳的细胞增殖或(和)扩展,进而决定籽粒形态,最终在水稻的产量和品质构成中发挥重要作用,但其中大部分基因都是单独通过影响细胞扩展或细胞增殖来影响籽粒形态发育,如RGA1,RGB1基因均通过控制细胞增殖对水稻籽粒大小进行正向调控[20-22];GSK2,SRS5控制细胞伸长,对籽粒长度负向调控[23-24]. 在本研究中,通过细胞学观察分析发现,smg2突变体纵向上细胞总数量与野生型差异无统计学意义,而相同视野范围内纵向细胞数量显著增多,表明SMG2基因在纵向上通过影响细胞扩展调控籽粒长度. 在横向上突变体细胞总数量显著低于野生型,同时相同视野范围内细胞数量多于野生型,说明SMG2基因通过影响细胞增殖和细胞扩展调控籽粒宽度,因此SMG2基因能同时通过两种方式调控籽粒的形态发育. 结果表明,进一步克隆SMG2基因,并进行功能分析,阐述SMG2基因的分子机制,对于完善水稻粒型调控网络具有重要意义.
3.1. smg2是突变体sui1的等位突变体
3.2. SMG2通过调控颖壳细胞发育控制籽粒大小
-
本研究从籼稻保持系XD1B的EMS诱变群体中鉴定了1个小粒突变体smg2. 相比野生型,smg2突变体粒长、粒宽和千粒质量均降低,同时具有植株矮化、短穗、一次枝梗减少、二次枝梗增多、每穗粒数减少和结实率降低等表型. 遗传分析结果表明,该突变体性状受隐性单基因控制,被精细定位在第1染色体上A-0.85和A-1.05之间,物理距离约为200 kb的范围内,测序发现定位区间内LOC_Os01g02890基因第1个外显子上第153位碱基缺失,相较野生型缺失了1个胞嘧啶(C),导致移码突变,最终将候选基因定为LOC_Os01g02890. 本研究进一步丰富了与籽粒形态相关的突变体材料,为深入理解水稻粒形遗传调控网络提供了基因资源.







 DownLoad:
DownLoad: