-
化学反应中的能量变化是中学化学教学的重点和难点. 人教版高中化学必修第二册第六章“化学反应与能量”从镁条与盐酸的放热反应和八水合氢氧化钡晶体与氯化铵晶体的吸热反应这两个演示实验入手,通过粗略的温度变化和结冰现象让学生定性地认识化学反应中伴随着的能量变化. 选择性必修I设计了盐酸与氢氧化钠溶液反应的中和热测定实验,其采用传统的实验方法,用简易量热计作为反应装置测定温度变化,从而定量计算出中和热,使焓变(或反应热)的教学重点落脚于定量分析及计算的层面. 中和热测定实验是高中化学教学的重要实验,也是为数不多的定量实验之一,但因为简易量热计的热散失较多而导致测定准确度差. 教材中针对反应热设计的所有实验都只有三重表征(宏观、微观、符号)效果,如果能够借助连续、实时、动态的温度变化曲线,则可以帮助学生更好地理解化学反应伴随着能量变化这一基本特征,从而实现教学的四重表征(宏观、微观、符号、曲线)效果.
数字化实验是教育信息化发展的必然趋势[1],其借助实时直观的动态变化曲线可实现四重表征效果,强化教学重点,突破教学难点,提高化学实验水平,已被广泛用于滴定分析、反应速率、化学平衡移动等教学实践探究[2-11]. 多类型的化学反应对应着多类型的反应热. 中和热的数字化实验测定是数字化实验在中学化学教学实践中的典型应用,其研究相对较多和较早. 利用手持技术或传感器技术可以方便获得实时直观的温度变化曲线,以提高中和热测定的直观性和准确度[12-13],其他反应热如解离热或燃烧热的数字化实验测定也有报道[14]. 盐酸与碳酸氢钠的复分解反应是中学化学教学中涉及的为数不多的吸热反应之一,其热效应小,反应前后温度变化较小,传统的实验设计难以获得理想的结果. 其数字化实验设计虽有报道[15],但其侧重点是考察碳酸钠和碳酸氢钠分别与盐酸反应的热效应的差异,仅粗略地通过温度升高或降低的情况理解前者是放热反应后者是吸热反应,并未对反应热进行定量测定和计算. 置换反应属典型的氧化还原反应,也是中学教学的重点,其反应热测定与中和热测定同等重要. 到目前为止,未见关于置换反应热测定的数字化实验设计的研究报道,也未见利用某一装置探究系列典型反应包括中和反应、置换反应和复分解反应体系的反应热测定的数字化实验报道.
基于中学化学反应热及其测定的教学实际和目前反应热测定的数字化实验研究现状,针对系列典型的化学反应(中和反应、置换反应和复分解反应)体系进行反应热测定的数字化实验设计是很有价值的. 它可系统全面呈现不同反应类型、不同反应热效应、不同物态参与的反应体系的反应热变化情况,可作为中学化学反应热定量实验教学的重要参考,也可弥补目前置换反应热数字化实验设计的空白. 本研究针对镁与盐酸置换反应体系,利用盖斯定律计算了其反应热的理论值,以衡量实验测定误差,这对学生理解和掌握盖斯定律在反应热计算中的应用这一教学重点和难点具有积极作用.
HTML
-
以盐酸与氢氧化钠溶液中和反应、镁条与盐酸置换反应、锌粉与硫酸铜溶液置换反应、碳酸氢钠与盐酸复分解反应等四类典型反应体系为研究对象,利用本课题组自制的MXLab21先进数字化化学实验系统,以简易保温装置为反应容器,在无需对反应器、温度传感器和搅拌子的吸热进行处理或校正的情况下,借助系统软件自动进行雷诺温度校正以消除反应系统的热散失,准确给出反应的温升或温降,显著提高各类化学反应热测定的准确性、实时性、操控性和可视性.
-
化学反应在等压条件下进行时,其反应的热效应称为等压反应热,用反应体系焓(H)的变化ΔH来表示. 所考察四类体系的化学反应方程式通式表达为:
反应体系的反应热(ΔHm)分别称为中和反应热、置换反应热和复分解反应热. 在不考虑反应器、温度传感器和搅拌子吸热的情况下,可由如下公式计算求得:
式中:ΔHm为反应热(或摩尔焓变)(kJ/mol);Cp为反应溶液的定压比热容(近似用水的比热容4.18 J/(g/K)代替);ΔT为温升或温降(反应前后溶液的温度变化值)(K);m为反应体系总质量(g);n为完全反应那种反应物的物质的量(mol).
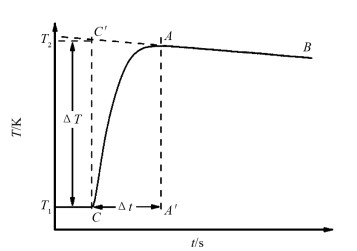
能量守恒定律指出,化学反应放出的热量等于其周围环境吸收的热量. 反应体系与外界环境之间的热交换会导致实验误差,反应体系的热散失可以通过雷诺温度校正得以补偿. 以放热反应为例,其雷诺温度校正原理如图 1所示. 图中所示曲线为反应温度T随反应时间t变化的关系曲线. 保持一定的搅拌速度不变,待反应溶液(如盐酸或硫酸铜溶液)温度基本平稳后,加入另一反应物(如氢氧化钠溶液、镁条、锌粉或碳酸氢钠),反应开始(C点),溶液温度迅速上升,达到最高值(A点,即观察到的最高温度). 之后,由于反应体系与周围环境的热交换,溶液温度会缓缓下降,对降温曲线进行线性拟合,得到切线(BA),延长切线BA与反应起始时刻C点所做的横坐标的垂线CC′相交于C′点,C′C间的温度差即为经过雷诺温度校正的温升(ΔT). CA′间的差值为反应达到最高温度所需要的时间,视为反应时间(t).
本实验通过数字化实验系统软件自动进行雷诺温度校正,以准确测得反应的温升或温降(ΔT),再利用上述公式(1)计算出反应热(ΔHm).
1.1. 实验方案的设计
1.2. 实验原理
-
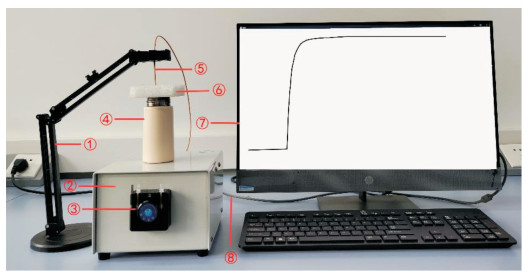
MXLab21先进化学实验系统如图 2所示,其为本研究组研制的一种新型综合性数字化实验仪器.
其他实验仪器:保温装置(150 mL的保温杯,用泡沫隔热板代替保温杯盖子);移液管(20 mL,25 mL和50 mL);容量瓶(250 mL,500 mL和1 000 mL);量筒(50 mL和200 mL);搅拌子;烧杯(50 mL);试剂瓶(500 mL和1 000 mL);电子天平(0.01 g);分析天平(0.1 mg).
-
浓盐酸(HCl的质量分数约为37%);氢氧化钠(分析纯);无水碳酸钠(基准物质,于270~300 ℃干燥至恒重);甲基橙指示剂;镁条(用砂纸打磨光亮);五水硫酸铜(分析纯);锌粉;碳酸氢钠(分析纯);去离子水.
1) 1.00 mol/L盐酸溶液的配制:用量筒量取41.8 mL浓盐酸,用去离子水稀释至500 mL,转移到试剂瓶中保存备用. 用分析天平准确称取无水Na2CO3基准试剂2.0 g左右于250 mL锥形瓶,用去离子水溶解后,加入甲基橙指示剂2滴,用待标定的盐酸滴定至终点,记录消耗盐酸的体积. 平行测定3次,计算出所配制盐酸的准确浓度.
2) 1.10 mol/L氢氧化钠溶液的配制:用电子天平称取氢氧化钠试剂22.00 g,用500 mL去离子水溶解并转移至试剂瓶中保存备用. 3) 2.00 mol/L盐酸溶液的配制:用量筒量取167.0 mL浓盐酸,加去离子水稀释至1 000 mL,转移到试剂瓶中保存备用.
4) 硫酸铜溶液(0.200 0 mol/L)的配制:用分析天平准确称取五水硫酸铜(w≥99.0%)49.938 0 g,用去离子水溶解并定容为1 000 mL,转移至试剂瓶中保存备用.
-
为统一描述操作步骤,将四类反应的反应物均分为A和B,具体情况见表 1.
四类反应的实验操作步骤如下:
1) 用移液管或MXLab21的输液泵准确移取反应物A于150 mL保温杯中.
2) 将保温杯置于数据采集器中央,为操作方便,在其上面盖一薄的泡沫隔热层代替保温杯盖子以防止热散失,并在保温杯中放入磁力搅拌子,插入温度传感器.
3) 按图 2所示连接好仪器装置,将温度传感器连接到数据采集器的相应接口,并将数据采集器与计算机连接,然后打开ACE系统,设置所需搅拌速度(如600 r/min)并开启搅拌.
4) 点击开始测定按钮,系统将自动记录溶液温度(T)随时间(t)变化的曲线. 当溶液温度在30 s内基本保持不变时,将反应物B快速加入保温杯中,待溶液温度达到最高或最低并下降一段时间,约3 min左右结束测量.
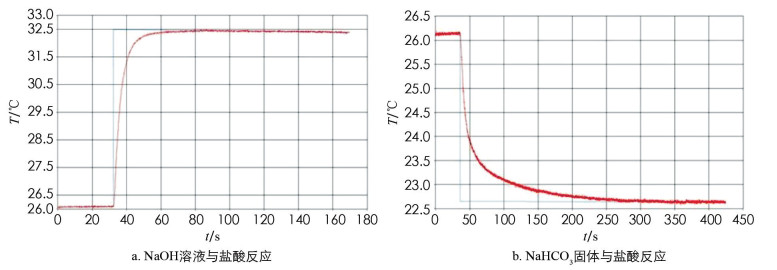
5) 从系统记录的T~t曲线上读取反应开始至反应达到最高或最低温度所需的时间,视为反应时间(t). 利用系统程序进行雷诺温度校正,在温度变化值中读取该反应的温升或温降(ΔT). 以NaOH溶液与盐酸反应及NaHCO3固体与盐酸反应体系为例,实验系统直接记录并导出的T~t曲线分别示于图 3A和3B中.
6) 保存图像,清洗反应装置及温度传感器,关闭系统,结束实验.
2.1. 实验仪器
2.2. 实验试剂
2.3. 实验方法
-
反应物浓度或用量会直接影响ΔT,搅拌速度会影响T~t曲线的形貌,对ΔT也有一定影响. 因此,需优化这些参数. 由于各反应体系的情况不同,优化的细节不再详细讨论.
-
首先按照2.2中1)所描述的方法,用Na2CO3基准试剂标定盐酸(约1.00 mol/L),其准确浓度为0.981 9 mol/L.
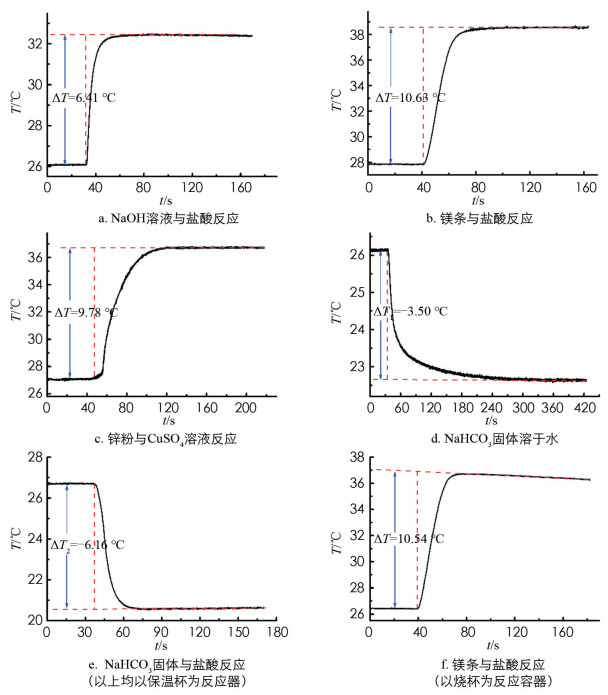
在优化的搅拌速度(600 r/min)下,测定25.00 mL盐酸(0.981 9 mol/L)与25.00 mL NaOH溶液(1.10 mol/L)反应的温升(ΔT),平行测定5次,实验结果列于表 2中,其T~t曲线之一呈现于图 4a中. 由式(1)计算出中和反应热(ΔHm),所用反应体系的总质量m为25.00 mL盐酸(0.981 9 mol/L)与25.00 mL NaOH溶液(1.10 mol/L)的总质量,通过分析天平准确称量得到,其5次测定的平均值为51.028 3 g.
如表 2所示,在不对反应容器、温度传感器和搅拌子进行吸热校正的情况下,NaOH溶液与盐酸中和反应热的平均值为-55.9 kJ/mol,接近该反应热的理论值(-57.3 kJ/mol)[16]. 根据如下公式(2)计算ΔHm平均值的相对误差为-2.4%,5次测定的相对标准偏差(RSD)为0.5%,表明测定的准确度和精密度高,且反应时间短(不超过2 min).
-
根据盖斯定律计算镁与稀盐酸置换反应热的理论值,计算公式如下:
各物质的标准摩尔生成焓数值来自大学基础化学[17]教材附录,计算所得镁与稀HCl置换反应热ΔHm的理论值为-466.9 kJ/mol.
在优化的搅拌速度(600 r/min)和镁条质量(约为1.2 g)下,测定镁条与50.00 mL 2.00 mol/L盐酸的反应温升(ΔT),平行测定5次,实验结果列于表 3中,其T~t曲线之一呈现于图 4b中. 由公式(1)计算反应热(ΔHm),所用反应体系的总质量m为镁条与50.00 mL 2.00 mol/L盐酸的总质量(忽略生成H2的质量),通过分析天平准确称量得到,其5次测定的平均值为51.400 1 g.
如表 3所示,在不对反应容器、温度传感器和搅拌子进行吸热校正的情况下,镁条与盐酸置换反应热的平均值为-463.7 kJ/mol,接近该反应热的理论值(-466.9 kJ/mol). 根据公式(2)计算ΔHm平均值的相对误差为-0.7%,5次测定的相对标准偏差为0.8%,测量的准确度和精密度高,且反应时间短(不超过2 min).
-
在优化的实验条件下,即控拌速度为900 r/min,锌粉质量为1.5 g时,测定锌粉与50.00 mL CuSO4溶液反应的温升(ΔT),平行测定5次,实验结果列于表 4中,其T~t曲线之一呈现于图 4c中. 由公式(1)计算反应热(ΔHm),所用反应体系的总质量m近似等于50.00 mL CuSO4溶液的总质量,通过分析天平准确称量得到,其5次测定的平均值为51.294 2 g.
如表 4所示,在不对反应容器、温度传感器和搅拌子进行吸热校正的情况下,反应热的平均值为-208.2 kJ/mol,接近该反应热的理论值(-216.8 kJ/mol)[18]. 根据公式(2)计算ΔHm平均值的相对误差为-4.0%,5次测定的相对标准偏差为1.1%,且反应时间短(不超过2 min).
-
在优化的搅拌速度(900 r/min)下,分别测定4.200 0 g NaHCO3固体溶于50.00 mL去离子水中的温降(ΔT1)和50.00 mL 2.00 mol/L盐酸中的温降(ΔT2),各平行测定5次,结果分别列于表 5和6中,相应的T~t曲线之一分别呈现于图 4d和4e中. 二者差值(ΔT2-ΔT1)即为NaHCO3固体与盐酸复分解反应的温降(ΔT)(注:由ΔT2和ΔT1的平均值计算). 由公式(1)计算置换反应热(ΔHm),反应体系的总质量m为NaHCO3固体与50.00 mL盐酸的总质量,通过分析天平准确称量得到,其5次测定的平均值为55.600 1 g.
如表 6所示,NaHCO3固体与盐酸复分解反应热的平均值为12.1 kJ/mol,接近该反应热的理论值(12.5 kJ/mol)[15]. 根据公式(2)计算ΔHm平均值的相对误差为-3.2%,5次测定的相对标准偏差为1.9%. 反应时间ΔT2小于2 min.
-
由于简易保温杯不透明,不利于学生观察反应体系的变化,为更好拓展该实验在中学化学教学中的应用,我们探究了以烧杯替代保温杯进行该系列实验的可行性. 以镁条与盐酸置换反应热的测定为例,控制搅拌速度为600 r/min,镁条质量约为0.12 g,盐酸浓度为2.00 mol/L时,以敞置的烧杯作为反应容器,测定反应的温升(ΔT),平行测定5次,结果列于表 7中. 其T~t曲线之一呈现于图 4f中.
相较于保温杯作为反应器(图 4b),以敞置的烧杯作为反应器时,反应温度达到最高值后,其温度下降趋势更明显,缘于敞置烧杯使得反应体系与外界环境的热交换更明显. 而且可以非常明显观察到镁条表面有大量气体生成,镁条体积越来越小直到完全消失,表明反应完全. 由公式(1)计算出置换反应热(ΔHm),其平均值为-456.4 kJ/mol,相对误差为-2.2%,5次测定的相对标准偏差为1.0%,结果列于表 7中.
还以敞置烧杯为反应器,测试了锌粉与CuSO4溶液的置换反应热,实验结果为:反应热的平均值为-206.4 kJ/mol,测定的相对误差为-4.8%,5次测定的相对标准偏差为0.7%. 以烧杯为反应器,可以非常直观地观察到CuSO4溶液的蓝色随反应进行逐渐变浅,直到完全消失,最后烧杯中有大量褐色沉淀,为没反应完的锌粉和置换生成的单质Cu的混合物,如图 5所示.
实验结果表明该数字化实验系统的雷诺温度校正能较好弥补烧杯反应器所导致的热散失,也表明了以烧杯替代保温杯作为反应器在反应热测定实验中的可行性. 以烧杯作为反应器,其最大优点是反应器非常简单,易于实验且便于观察,在中学化学实验教学中具有很好的适用性.
3.1. 氢氧化钠溶液与盐酸中和反应热测定
3.2. 镁条与稀盐酸置换反应热测定
3.3. 锌粉与硫酸铜溶液置换反应热测定
3.4. 碳酸氢钠与盐酸复分解反应热测定
3.5. 以烧杯替代保温杯的实验可行性探究
-
反应热数字化实验设计有利于中学化学学科核心素养的发展和培养,具体分析如下.
培养“宏观辨识与微观探析”的素养. 以典型放热反应(NaOH+HCl,Mg+HCl,Zn+CuSO4)及吸热反应(NaHCO3+HCl)体系为研究对象设计反应热测定的数字化实验,利于引导学生从不同反应类型(中和反应,置换反应和复分解反应)的实质分析化学能与热能转化的微观本质,理解化学反应与体系能量变化是同时发生的;有助于学生利用观察到的微观反应本质对宏观现象进行辨析和探索,丰富学生对化学变化的视觉体验,增强学生对不同热效应的微观本质的理解和对微观世界的好奇,更好地搭建宏观与微观之间的桥梁,激发学生学习兴趣.
培养“证据推理与模型认知”的素养. 数字化实验系统所测T~t曲线连续、直观,所得数据准确. 不同类型反应,不同热效应和不同物态参与的反应体系的T~t曲线各有其特点,当其全面系统呈现给学生时,更有利于学生总结热效应的变化规律,收集证据,分析推理,形成对反应热的认知模型. 通过收集不同反应体系的T~t曲线,可以更好理解不同反应的微观本质对反应温升或温降的影响规律,运用已有知识推理解释所得规律变化. 如对比NaHCO3固体溶于水和盐酸中的温度变化,有助于学生更好理解NaHCO3固体的溶解热和NaHCO3溶液与盐酸的反应热,均为吸热反应;其溶解时的温度变化测定可以推广到其他溶解热的测定中. 此外,本实验中形成的雷诺温度校正思维模型,根据过去和现在的发展趋势推断未来的结果,可以推广到其他反应热测定实验中.
培养“科学态度”与“创新精神”. 数字化实验显著提高了化学反应热测定的准确性、实时性、操控性和可视性. 通过探究以烧杯替代保温杯进行实验的可行性,帮助学生形成严谨的科学态度及尊重客观事实的实验品质,激发学生对科学现象的探究欲,培养学生的创新意识,提高学生解决问题的能力.
-
1) 利用本研究组自制的MXLab21先进数字化化学实验系统,以简易保温装置为反应器,在不对反应器、温度传感器和搅拌子的吸热进行校正的情况下,利用软件系统自主进行的雷诺温度校正,即可得到满意的ΔHm测定结果. 且装置简单,操作简便,测试时间短.
2) 该数字化实验设计不仅适合于中和反应热、置换反应热、复分解反应热的测定,还适用于不同反应热效应,不同物态参与的反应体系的反应热的测定,可作为中学化学反应热定量实验教学的重要参考.
3) 利用盖斯定律计算镁与盐酸置换反应热的理论值,有助于学生理解和掌握盖斯定律在反应热计算中的应用这一教学重点和难点.
4) 系列反应热的数字化实验设计对中学化学学科核心素养培养和发展具有重要价值.







 DownLoad:
DownLoad: