-
化学是一门实验科学,实验教学是化学教学中的重要组成部分.如何利用化学实验课程的教学激发学生学习化学的兴趣,培养学生的综合实验能力、创新意识和创新思维是实验教学中值得探讨的课题.武汉大学化学与分子科学学院实验中心历年来非常重视实验课程的教学,一方面注重对学生基础知识、基本操作技能的训练,注重对学生独立分析问题、解决问题的综合实验技能的培养;另一方面特别注重激发学生对科学研究的兴趣,即通过在实验教学的后期,设计一些与当今化学研究前沿密切相关的实验课题,将化学中的一些重要反应以及重要的合成思想融入设计实验、开放实验等多个实验教学环节中,激发学生学习热情,同时培养学生的创新意识、创新精神和创新能力.将科研前沿研究热点纳入基础实验教学中正逐步成为各高校实验教学改革的热点[1].
本文介绍的实验属于有机化学设计实验,素材来源于笔者自身的科研经历.武汉大学化学与分子科学学院基地班的有机化学实验课程的学时为144学时,设计实验安排在最后30学时.该实验以教科书中经典的安息香缩合反应为基础,结合有机合成化学的最新研究进展,利用氮杂环卡宾催化剂代替传统的腈化物,使安息香缩合反应更加绿色环保.该设计实验涉及“极性翻转”这一重要的合成思想以及氮杂环卡宾催化这一研究热点,有利于学生在进一步巩固和熟练运用基本合成技能的同时了解重要的合成思想以及化学前沿.此外,该设计实验包括氮杂环卡宾前体盐的合成以及氮杂环卡宾催化的安息香缩合反应研究,涉及学生已经学习过的蒸馏、萃取、重结晶和色谱分离等基本操作技能,可操作性强,因而从催化剂的制备到应用均由学生独立完成,成功率高,可以让学生体验到合成的乐趣,有利于培养学生科研兴趣和探索精神.此外,在实验过程中引入了对文献的检索,实验方案的设计及筛选,实验用仪器及药品的统计,反应的薄层色谱(TLC)实时跟踪,产物的分离纯化、表征,报告撰写及汇报等多个环节,将综合实验技能与实际科学研究相结合,提高了学生的综合实验能力,达到了设计实验的教学目标.
HTML
-
通过查阅文献,掌握“极性翻转”及安息香缩合反应的基本原理;根据设计实验的基本要求,确定合适的实验方案;掌握咪唑型氮杂环卡宾前体盐的制备方法;进一步熟练薄层色谱(TLC)监测反应进程与柱色谱分离反应粗产物的操作,巩固展开剂、淋洗剂的选择方法;掌握熔点仪、红外光谱仪、核磁共振仪等仪器的基本操作以及相应谱图的解析.
-
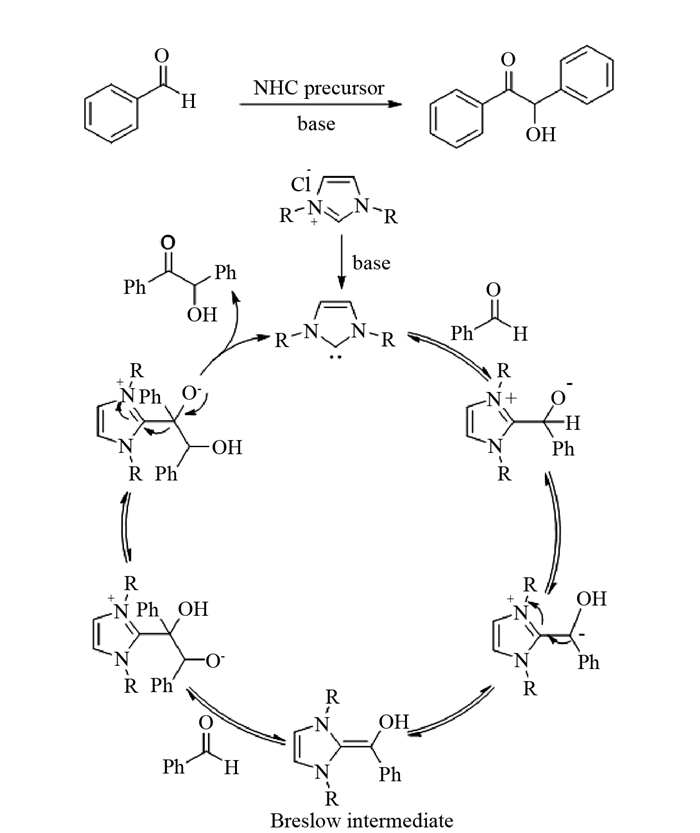
安息香又称苯偶姻,是一种无色或白色晶体,系统命名为2-羟基-1,2-二苯基乙酮.安息香作为一种重要的有机合成中间体,传统的制备方法是用剧毒的氰化钠或氰化钾作为催化剂,在碱性条件下,由两分子的苯甲醛缩合而成.在该反应中,催化量的CN-对一分子苯甲醛中的羰基(C = O)亲核加成,由于氰基较强的吸电子效应促使分子内质子转移,使传统的电正性的羰基碳转变成电负性的羰基碳(即苯甲醛中的羰基发生了“极性反转”),从而可以对另一分子的苯甲醛进行亲核加成,生成安息香产物[2-3].
1943年Ukai等发现环境友好的维生素B1(硫胺素)也可以催化苯甲醛发生安息香缩合反应,因此成为氰化物的替代试剂[4].很多文献对该实验进行了改进,并被广泛收录在各大专院校的实验教材中[5].
维生素B1催化安息香缩合反应机理与CN-的催化作用类似,维生素B1噻唑环C-2位上的氢在相邻氮原子和硫原子的影响下具有一定的酸性,在碱的作用下失去质子形成N-杂环卡宾,卡宾具有很强亲核性,可以对一分子的苯甲醛进行亲核加成,再经质子转移生成噻唑-烯胺中间体(也称为Breslow中间体)[6],使得苯甲醛中的羰基碳由亲电性变为亲核性(“极性反转”),从而可以对另一分子的苯甲醛进行亲核加成.在该反应中实际起催化作用的是噻唑环在碱性条件下形成的N-杂环卡宾,因此由一系列噻唑型和咪唑型氮杂环卡宾催化的安息香缩合反应引起了人们的广泛兴趣[7-8].
由于氮杂环卡宾独特的催化性能,氮杂环卡宾催化的有机合成反应被广泛研究并成为有机化学的研究前沿及热点之一[9-10].笔者根据近几年来从事N-杂环卡宾催化的不对称合成反应的研究,并结合近几年有机化学实验教学工作的要求和特点,设计了从2,4,6-三甲基苯胺来制备咪唑盐(氮杂环卡宾前体:NHC precursor)催化的安息香缩合反应,该反应作为本科有机化学实验素材还鲜有报道.由该咪唑盐催化的苯甲醛安息香缩合反应及机理见图 1.
-
试剂:所用试剂均为市售分析纯,并直接使用.
仪器:ZF-7A手提式紫外检测灯(上海宝山固村电光仪器厂:365 nm,254 nm),RY-1熔点仪(天津市天分分析仪器厂),Nicolet IS 10傅里叶变换红外光谱仪(KBr压片法),Varian-600 MHz核磁共振波谱仪.
-
反应方程式为:
往装有温度计和回流冷凝管的50 mL三口瓶中加入2.70克(0.02 mol)2,4,6-三甲基苯胺,15 mL甲醇.搅拌下,先加入2滴甲酸,然后再滴加1.70 mL 40%乙二醛水溶液(0.15 moL).室温搅拌2 h后,减压过滤收集固体,并用冰甲醇洗涤固体2次,抽干.将固体转入表面皿,小火烘干,得1.98克黄色固体(产率:67.8%).熔点157~159 ℃,与文献值相符合.
-
反应方程式为
往装有温度计和回流冷凝管的50 mL三口瓶中加入1.46克(5 mmol)N,N′-双(2,4,6-三甲基苯基)-乙烷二亚胺,16 mL THF.将固体搅拌溶解后,用注射器取0.47 mL(5 mmol)氯甲基乙基醚加入到三口瓶中.水浴加热于40 ℃搅拌反应2 h后,放置过夜.减压过滤收集固体,固体用乙醚洗涤2次后,抽干.将固体转入表面皿,小火烘干,得0.92克白色固体(产率:54.0%).熔点>350 ℃,与文献值相符合.IR (cm-1):3 199,3 153,3 046,2 905,1 608,1 537,1 481,1 459,1 379,1 232. 1H NMR (600 MHz,CDCl3) δ:10.87 (s,1H),7.60 (d,J=1.5 Hz,2H),7.04 (s,4H),2.35 (s,6H),2.19 (s,12H). 13C NMR (150 MHZ,CDCl3) δ:141.31,139.31,134.09,130.62,129.90,124.66,21.16,17.63.
-
在装有回流冷凝管和温度计的50 mL三口烧瓶中,先加入0.27 g(0.8 mmol) 1,3-双(2,4,6-三甲基苯基)氯化咪唑和1 mL水,搅拌使其溶解后,再加入3 mL 95%乙醇.在冰水浴冷却下,边搅拌边滴加10% NaOH溶液,调节溶液pH值为9~10,此时溶液呈黄色.将2.0 mL(19.6 mmol)苯甲醛加入到反应瓶中,将反应混合物置于水浴中(65~75 ℃)加热90 min,反应过程中保持溶液pH值为9~10.
待反应混合物冷至室温后,用冰水浴冷却,有白色晶体析出,减压抽滤并用冰水洗涤晶体1次,得粗品.粗品用95%的乙醇重结晶,得白色针状晶体0.76克(产率:36.5%).熔点:132~134 ℃,与文献值相符合. TLC分析(乙酸乙酯/石油醚)与安息香标准品的比移值一致,无杂质点. IR (cm-1):3 415,3 377,3 083,3 059,3 028,2 932,1 678,1 594,1 577,1 490,1 448,1 206,1 068,755,704. 1H NMR (600 MHz,CDCl3) δ:7.91 (d,J=7.3 Hz,2H),7.51 (t,J=7.5 Hz,1H),7.39 (t,J=7.8 Hz,2H),7.34-7.30 (m,4H),7.29-7.22 (m,1H),5.95 (d,J=5.8 Hz,1H),4.54 (d,J=6.0 Hz,1H). 13C NMR (150 MHz,CDCl3) δ:198.96,139.00,133.96,133.46,129.18,129.16,128.72,128.62,127.80,76.23.
4.1. N,N′-双(2,4,6-三甲基苯基)-乙烷二亚胺的制备[11]
4.2. 1,3-双(2,4,6-三甲基苯基)氯化咪唑(NHC precursor)的制备[12]
4.3. 安息香的制备
-
本设计实验中N,N′-双(2,4,6-三甲基苯基)-乙烷二亚胺的制备比较简单,根据文献方法合成,加入几滴弱酸甲酸以催化胺与醛之间的亲核加成反应.根据学生的实验结果,大部分反应在甲醇、乙醇、异丙醇中于室温进行,反应时间1~2 h,产率60%~70%.也有学生分别在甲醇、乙醇、异丙醇3种溶剂中于50~60 ℃水浴中反应,产率可提高至80%以上.
对于1,3-双(2,4,6-三甲基苯基)氯化咪唑,一般通过两种方法来制备:一种是由亚胺与氯甲基乙基醚来制备[12],一种是由多聚甲醛代替氯甲基乙基醚与亚胺反应来制备[13].后一种方法高温反应时间较长,操作相对复杂,在规定的时间内完成比较困难,因此我们建议学生用第一种方法来制备,同时考虑到氯甲基乙基醚有一定的毒性,建议学生用注射器取用该药品.实验成功率100%,大部分学生的产率在50%~60%之间.
而对于安息香缩合反应,虽然文献报道由维生素B1催化的反应有重现性较差、反应影响因数较多的问题,但是从文献报道来看对该反应的研究还是比较透彻的,比如反应中的水醇比、溶液pH值、反应温度以及反应时间对产率的影响等.考虑到维生素B1和咪唑盐在碱性条件下都会产生亲核性的N-杂环卡宾,这一步反应主要要求学生自己根据文献方法选择合适的实验条件来完成.学生实验结果表明:大部分学生一次实验就拿到了纯净的产品,只有小部分学生第一次实验失败.实验失败的原因主要有两个:一是没有控制好安息香缩合反应的pH值,二是没有控制好溶解咪唑盐的水-醇比,加入醇过多,反应结束后产品难以结晶析出.但是学生通过分析实验失败原因,重做一次或采取相应处理措施以后(例如通过蒸馏除去多余溶剂或萃取洗涤后蒸馏除去溶剂再加水析出产物等),都得到了纯净的产物.
-
1) 本实验为有机化学设计实验,要求学生独立完成.教师提前4周将设计实验的基本要求发给学生,例如要求学生从2~3克2,4,6-三甲基苯胺出发合成氮杂环卡宾前体盐并应用于安息香缩合反应;要求学生4周完成合成实验,并给出较详细的时间安排等;要求学生先通过查阅文献了解咪唑型氮杂环卡宾的性质和制备方法、了解氮杂环卡宾催化醛极性翻转的基本原理,了解安息香缩合反应的基本原理;要求学生在实验前和实验指导教师讨论确定具体的实验方案,并在实验前一周完成所需仪器和药品的统计工作.
2) 在实验方案确定后,学生集中5周的时间完成实验,每周6学时.前4周在实验室完成合成及表征工作,最后1周为实验讨论课.在前2周,学生对1,3-双(2,4,6-三甲基苯基)氯化咪唑进行合成、分离纯化及表征.在该过程中,学生可以参考文献报道的方法对氮杂环卡宾前体盐进行合成,也可对文献的方法进行优化,在规定时间内完成催化剂的制备并进行表征(例如红外、核磁等).在成功制备催化剂后,学生再用2周时间按各自的实验方案对氮杂环卡宾催化苯甲醛的安息香缩合反应进行研究(例如TLC监测反应进程等),并让学生自主选择分离纯化的方式(例如重结晶,柱色谱分离等),并对产物结构进行表征(包括熔点测定,提供安息香标准样品供学生TLC分析以确定产品及纯度).最后1周的实验讨论课每班20~24人,每人口头汇报6~8 min,回答问题2 min.学生就实验方案设计,实验过程中出现的问题以及如何分析问题、解决问题,取得的实验结果以及仍需解决及优化的实验步骤进行总结和交流,能够很好地锻炼学生口头表达及思维能力,对学生有机化学理论知识的学习及实验技能的提高也有很大帮助.
3) 本实验实施过程中,由于实验学时限制,很难要求学生将每一步的实验进行优化,同时学生在查阅文献过程中发现有些反应(未经优化)需长时间加热,这些对于本科实验教学来说在学时内是无法完成,也是不安全的,因此我们建议学生可以选择用TLC来监测反应进程或缩短加热反应时间至2~3 h后考虑结合室温存放,不必刻意追求高产率.学生可以自主选择分离纯化的方法,主要包括重结晶、柱色谱分离,重结晶条件以及柱色谱条件均由学生自主探索.经历这样独立探索的过程,可以加深学生对有机化学实验单元操作的理解,培养学生独立操作的实验能力,同时也有利于培养学生的实验技能和探索精神.
-
本设计实验通过文献的查阅、1,3-双(2,4,6-三甲基苯基)氯化咪唑的制备及其催化的安息香缩合反应、催化剂及产物的纯化表征等多个环节,考察了学生的有机综合实验能力,激发了学生的科研兴趣,达到了对学生的培养目标,也为学生今后的学习和工作打下了坚实的基础.






 DownLoad:
DownLoad: