-
开放科学(资源服务)标识码(OSID):

-
卵泡成熟需历经募集、选择及优势化3个关键阶段,整个过程非常复杂。由于氧化应激、激素、细胞因子和线粒体损伤等因素影响,排卵前的卵泡会停止发育并且渐渐退化,最终消失,这个过程被称为卵泡闭锁[1]。在卵泡发育过程中,高达99.9%的卵泡会发生闭锁,不到0.01%的卵泡发育成熟并排卵[2]。卵泡闭锁会发生在卵泡发育的任意阶段,且大多数在有腔卵泡阶段发生闭锁[3]。闭锁卵泡中的颗粒细胞比卵母细胞和卵泡膜细胞更提前启动凋亡程序[4]。因此,颗粒细胞凋亡通常被视为卵泡闭锁的潜在机制。
颗粒细胞参与了卵泡发育和卵母细胞减数分裂阻滞,而颗粒细胞与卵母细胞之间主要通过间隙连接进行交流,小分子物质如细胞代谢产物、离子和mRNA等可以从颗粒细胞进到卵母细胞,这些小分子物质对于卵母细胞减数分裂、能量产生和酸碱平衡都很关键[5-6]。颗粒细胞凋亡时,会出现细胞皱缩、DNA断裂以及相关基因表达的异常等现象。Sun等[7]研究发现,miRNA在颗粒细胞凋亡进程中扮演着关键角色。miR-23a通过下调颗粒细胞中BCL-2的表达水平,激活ERK1/2信号通路,促进颗粒细胞发生凋亡[8]。姚勇[9]研究发现miR-1275通过靶向LRH-1的3'UTR区域,降低LRH-1的表达,间接阻止了LRH-1蛋白与CYP19A1基因启动子进行相互作用,抑制雌二醇的合成,以促进猪颗粒细胞凋亡[10]。
在不同闭锁阶段的猪和牛卵泡中,miR-99a的表达水平存在差异。林飞[11]通过分析猪早期闭锁卵泡miRNA的表达情况,筛选出了23条差异表达的miRNA,其中有12个miRNA表达上调,包括miR-26b、miR-10b、miR-99a等,11个miRNA表达下调。其中,随着猪卵泡闭锁程度的加深,miR-99a和miR-10b的表达水平也在增加。李润[12]指出,miR-99a和miR-10b的表达水平随水牛卵泡闭锁程度的增加而下调。然而,miR-99a在卵泡闭锁过程中的作用及机制尚不清楚。为了探究miR-99a在猪颗粒细胞的增殖与凋亡过程中的作用,本研究首先分析miR-99a在不同闭锁程度猪卵泡中的表达情况,随后通过调节miR-99a的表达水平,研究其对猪颗粒细胞增殖和凋亡的影响。该结果可作为miR-99a在卵泡闭锁过程中调控机制的参考。
全文HTML
-
猪卵巢样本取自南宁市鲁班路所在屠宰场,猪卵巢颗粒细胞(Porcine Granular Cells)和293T细胞由本实验室保存。此外,DH5α感受态购自TransGen Biotech公司,sus-miR-99a mimic、sus-miR-99a inhibitor均购自锐博生物公司。
-
pRL-TK为亚热带农业生物资源保护与利用国家重点实验室保存。
-
限制性内切酶XbaI、Tuborfect、SYBR Green qPCR Mix购自Thermo公司;同源重组酶Exnase、去gDNA反转录试剂盒、去gDNA特异性反转录引物转录试剂盒、CCK-8试剂盒购自南京诺唯赞生物公司;DNA Marker购自北京天根生化公司;dNTPs原料、超螺旋DNA ladder Marker、T4连接酶购自TaKaRa公司;Trizol、Trizol LS购自Invitrogen公司;普通琼脂糖凝胶回收试剂盒、普通质粒提取试剂盒、2×Taq PCR Master Mix试剂购自索莱宝公司;RFect购自常州百代生物公司;双荧光素酶试剂盒购自Promega公司;PI购自Biolab公司;凋亡试剂盒购自BD公司。细胞培养所用试剂均购自Sigma。
-
引物的设计采用了BLAST、Oligo 7和Primer 5软件,合成工作则委托给上海生工生物公司。所使用的引物信息详见侯晗琦[12]所用引物。
-
卵巢取自屠宰场,依次使用75%酒精、38.5 ℃生理盐水、75%酒精、PBS溶液清洗卵巢,用手术器械剪取卵泡,放入PBS清洗。依据卵泡分类标准[13-14],将猪卵泡划分为健康卵泡(HF)、早期闭锁卵泡(EF)以及晚期闭锁卵泡(PF)。卵丘清洗后迅速放置于无菌EP管中,并存放于液氮中。
-
猪颗粒细胞的分离培养参考吕嘉顺[15]的方法。
-
采用Trizol法提取样品总RNA,根据去gDNA反转录试剂盒、去gDNA特异性反转录引物转录试剂盒说明书(Vazyme公司)进行普通反转录和特异性反转录。以cDNA稀释液作为模板,加入PCR引物和SYBR Green qPCR Mix(Thermo)进行反应。程序为:95 ℃,5 min;95 ℃,30 s;60 ℃,30 s;72 ℃ 30 s,循环40次。选取GAPDH作为内参基因,通过2-ΔΔCT法计算mRNA相对表达量。
-
采用脂质体介导的瞬时转染法进行miRNA转染。接种细胞,当细胞汇合度约为70%时,使用RFect转染试剂进行miRNA转染,4~24 h后,更换细胞培养基,培养24~72 h后,收集细胞进行检测。
-
在本研究中,将5 000个细胞接种于96孔板,每日更换培养基。在每个孔中加入10 μL CCK-8溶液,38 ℃孵育1~4 h。随后,用酶标仪在450 nm波长处检测吸光度。从试验开始,每24 h测量一次,试验设置3重复样本,依据所得数据绘制出曲线。
-
采用CCK-8法进行检测。接种5 000~10 000个细胞至96孔板,于培养箱内孵育过夜,待细胞汇合度达50%,采用脂质体转染法转染miRNA至颗粒细胞,在每个孔中添加10 μL CCK-8溶液,并在CO2培养箱中孵育1~4 h。从处理开始时间0 h起,每隔12 h进行一次处理,直至72 h结束。于450 nm处测定吸光度,根据OD值进行细胞增殖活力和毒性分析。试验分为处理组孔、空白组孔、对照组孔3个组。
-
使用胰酶消化法收集细胞,于75%乙醇溶液中固定2 h,2 000 rpm离心5~10 min,加入500 μL的20 μg/mL RNase溶液,37 ℃孵育30 min,加入500 μL的10~50 μg/mL PI溶液,混匀,4 ℃避光孵育30 min。在流式细胞仪上于488 nm激发波长处检测荧光,利用MFLT软件分析结果。
-
采用FITC/PI双染法进行检测。在收集细胞后,将其重悬于300 μL的1× Binding Buffer中,然后加入5 μL的Annexin V-FITC,并充分混匀。接着,将混合物在室温下避光孵育15 min,加入200 μL 1×Binding Buffer和5 μL PI,混匀,5 min后上样检测。结果由Flowjo软件进行分析。
-
各组数据采用SPSS软件统计分析,运用单因素方差分析(ANOVA),结果以均值±标准误呈现。显著性水平用p值表示,其中p<0.05表示显著差异,p<0.01表示极显著差异。
1.1. 材料与试剂
1.1.1. 组织、细胞和菌株
1.1.2. 载体与质粒
1.1.3. 主要试剂
1.1.4. 引物设计与合成
1.2. 方法
1.2.1. 不同闭锁程度卵泡的分离
1.2.2. 细胞的分离与培养
1.2.3. 组织样品总RNA的提取和反转录PCR反应
1.2.4. miRNA的转染
1.2.5. 细胞活力检测(CCK-8法)
1.2.6. 细胞增殖/毒性检测
1.2.7. 细胞周期检测(PI染色法)
1.2.8. 细胞凋亡检测
1.2.9. 统计学方法
-
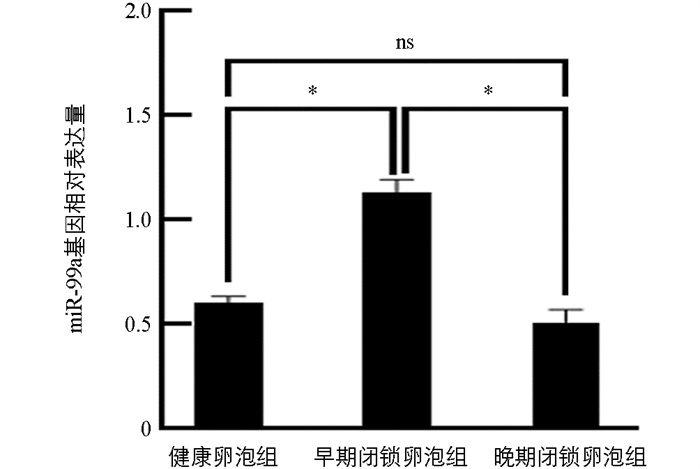
结果显示,miR-99a的表达在闭锁程度逐渐增加时呈现出先上升后下降的趋势。与健康卵泡组(HF)相比,miR-99a在早期闭锁卵泡组(EF)的表达水平显著提高(p<0.05),而在晚期闭锁卵泡组(PF)中变化不显著(p>0.05)。相较于EF组,PF组中miR-99a的表达量显著下调(p<0.05)(图 1)。
-
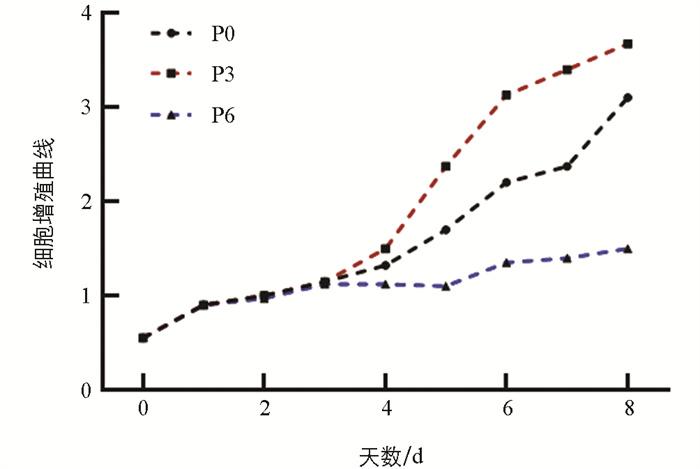
为了选择合适的试验代数,选取第0、3、6代猪颗粒细胞检测细胞增殖速度。结果显示,第0和6代细胞的生长速度较慢,而第3代颗粒细胞的生长曲线呈现典型的“S”形,表明其生长状态良好(图 2)。因此,选择第3代细胞用于后续试验。
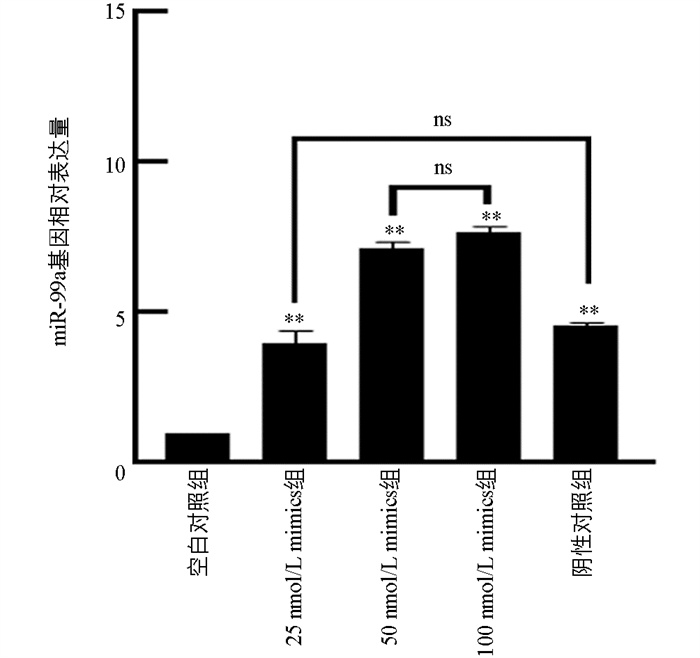
为了摸索Mimics适宜的转染时间和浓度,分别使用25 nmol/L、50 nmol/L、100 nmol/L的miR-99a Mimics处理猪颗粒细胞48 h,并设置空白对照组(MOCK组)和阴性对照组(Mimics-NC组)。结果显示,与MOCK组相比,25 nmol/L、50 nmol/L和100 nmol/L组的miR-99a表达量均有极显著差异(p<0.01)。与Mimics-NC组相比,miR-99a表达量在25 nmol/L组中没有变化(p>0.05),在50 nmol/L和100 nmol/L显著升高,miR-99a表达量在50 nmol/L组与100 nmol/L组之间没有显著差异(p>0.05),选择50 nmol/L浓度进行后续试验(图 3)。
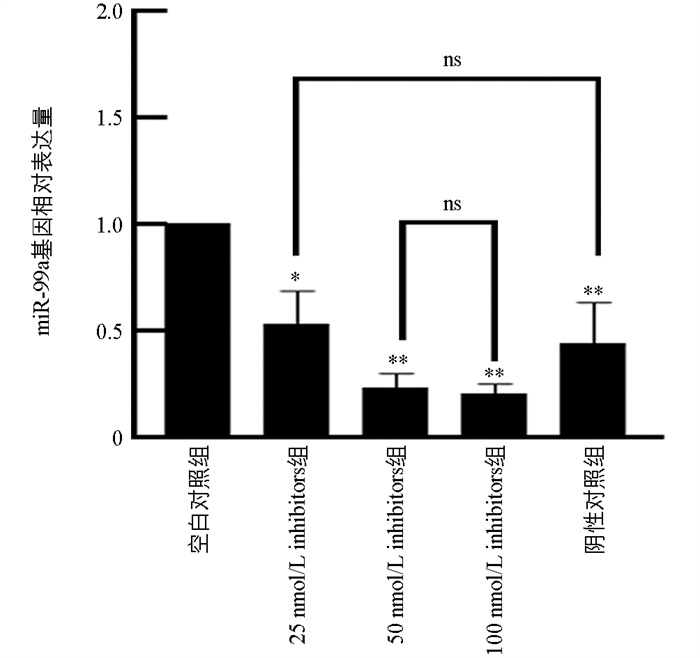
为了确定miR-99a抑制剂的最佳处理条件,使用了25 nmol/L、50 nmol/L和100 nmol/L浓度的miR-99a抑制剂对猪颗粒细胞处理48 h,并设置了对照组:MOCK组和Inhibitors-NC组。结果显示,与MOCK组相比,25 nmol/L组的miR-99a表达量显著降低(p<0.05),而50 nmol/L组和100 nmol/L组的降低极显著(p<0.01)。值得注意的是,50 nmol/L和100 nmol/L抑制剂组之间差异不显著(p>0.05)(图 4)。由于miRNA抑制剂存在竞争性抑制机制及其效率的因素,此结果为后续试验提供了参考。选择100 nmol/L进行后续试验。
-
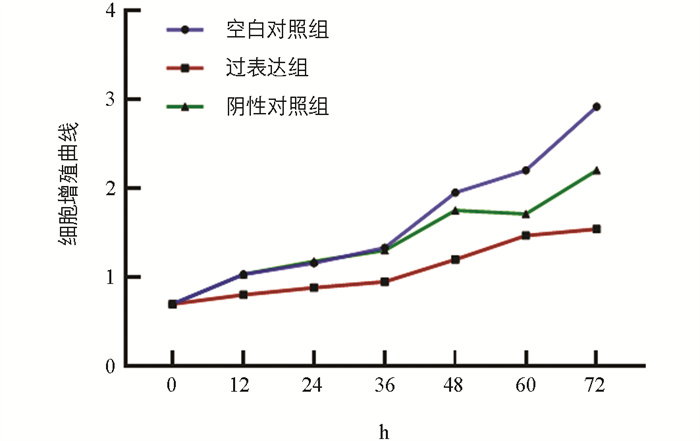
为研究miR-99a对猪颗粒细胞增殖的影响,采用CCK-8方法评估细胞增殖速度。试验设置空白对照组、miR-99a过表达组和阴性对照组,并另配置一孔仅加入细胞培养液,用于检测误差。结果表明,相较于对照组,过表达组的细胞增殖能力显著下降(图 5)。
-
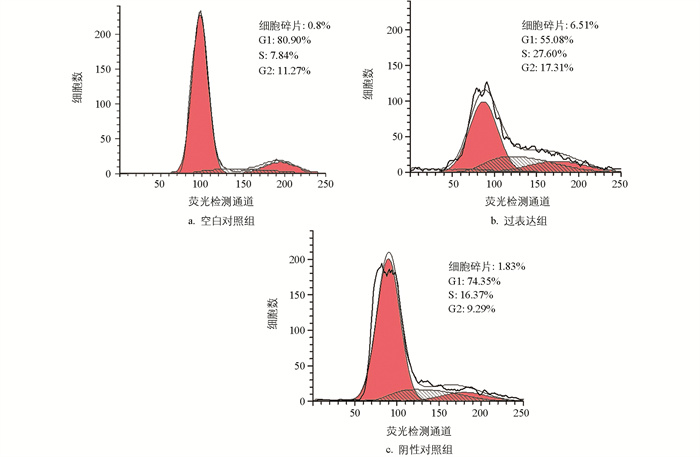
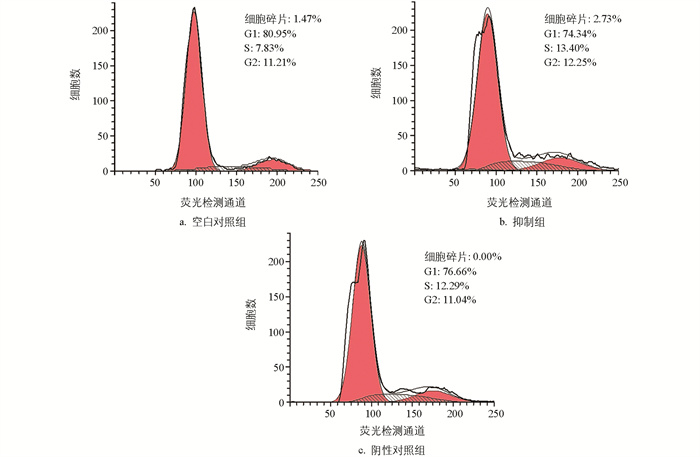
使用PI染色法检测颗粒细胞周期,结果显示,阴性对照组与空白对照组相比,细胞周期变化不大。与对照组相比,过表达组的细胞碎片增多,G1期的细胞含量减少,S和G2期增多,细胞发生G2/M期停滞(图 6)。与空白对照组相比,miR-99a抑制组、阴性对照组G1期细胞的含量减少,S期增多,G2期没有变化;与阴性对照组相比,ImiR-99a抑制组细胞周期没有变化(图 7)。
-
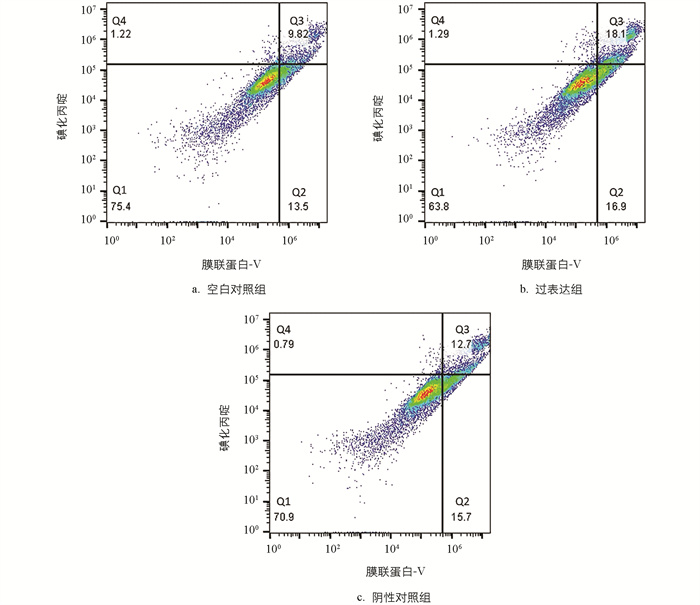
对细胞凋亡水平进行分析,结果显示,与空白对照组相比,过表达组早期凋亡细胞数量、晚期凋亡数量变化的正常细胞占比小,减少了11.6%;部分坏死细胞、早期凋亡及晚期凋亡细胞占比大,部分坏死细胞、早期凋亡细胞及晚期凋亡细胞占比增加11.68%,仅晚期凋亡和部分坏死细胞占比就增加了10.27%。与阴性对照组相比,过表达组的正常细胞占比减少了7.1%,部分坏死细胞、早期凋亡及晚期凋亡细胞占比增加了6.6%,仅部分坏死细胞和晚期凋亡细胞占比就增大了5.4%(图 8)。分析数据时,把活细胞分为4个区,Q1~Q4分别是正常、早期凋亡、部分坏死及晚期凋亡和坏死细胞区。
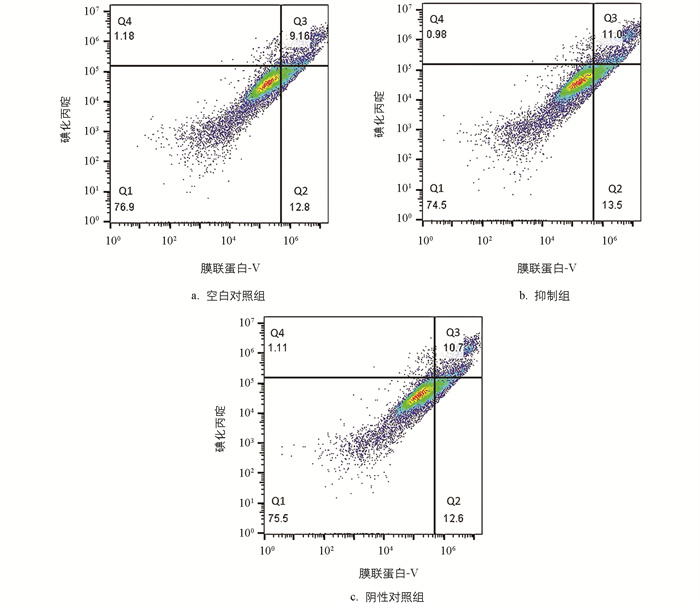
与对照组相比,抑制组的部分坏死细胞、早期凋亡及晚期凋亡细胞占比几乎不变。经过对miR-99a进行过表达处理后,颗粒细胞的凋亡水平显著上升,但抑制miR-99a并未对细胞凋亡水平产生明显影响(图 9)。
-
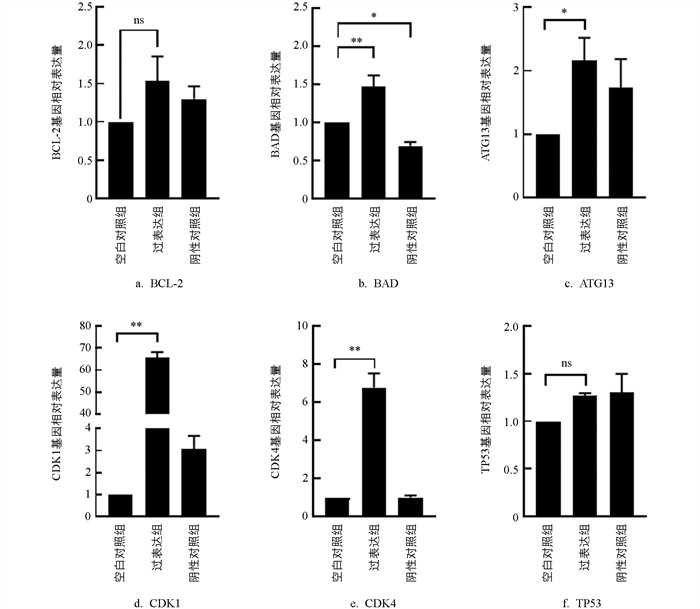
检测了与凋亡相关的基因BCL-2、ATG13、BAD,细胞周期依赖性激酶基因CDK1、CDK4、TP53的表达情况。与MOCK组相比,Mimics组颗粒细胞中CDK1、CDK4、BAD基因表达极显著升高(p<0.01),ATG13基因表达显著上调(p<0.05),BCL-2与TP53基因的表达增加(p>0.05,图 10)。
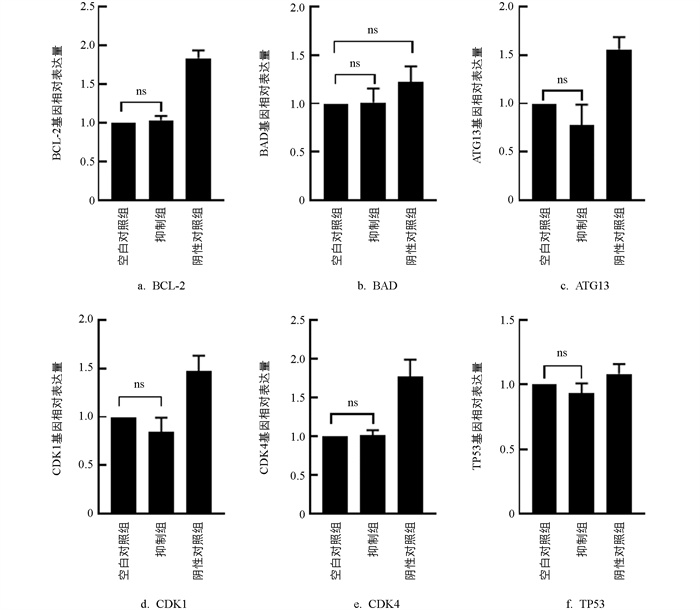
与MOCK组相比,Inhibitors组颗粒细胞中CDK1、ATG13、TP53基因表达降低(p>0.05),CDK4、BCL-2、BAD基因的表达无显著变化(p>0.05,图 11)。
2.1. miR-99a在不同闭锁程度猪卵泡中的表达
2.2. miRNA处理条件的摸索
2.3. 过表达miR-99a抑制猪颗粒细胞增殖
2.4. 正负调控miR-99a表达对猪颗粒细胞周期的影响
2.5. 上/下调miR-99a表达对猪颗粒细胞凋亡的影响
2.6. 正负调控miR-99a表达对猪颗粒细胞中基因表达的影响
-
研究表明,不同闭锁程度的卵泡中miR-99a的表达水平存在显著差异。具体而言,早期闭锁卵泡的miR-99a表达量明显高于健康卵泡和晚期闭锁卵泡。随着卵泡的发育,miR-99a的表达水平开始上升,随后逐渐降低。早期闭锁卵泡中的miR-99a显著表达加速了卵泡闭锁的进程,作为卵泡筛选机制的重要一环,导致大量卵泡被淘汰,难以进一步发育为优势卵泡。闭锁卵泡中miR-99a表达水平的上升可能与优势卵泡或卵母细胞中某些特定激素和细胞因子的作用密切关联。Hu等[16]指出,卵巢中Dicer酶的剪接异构体Dicer-a和Dicer-b的表达量均随着卵泡直径的增大呈现先升高后降低的趋势,在闭锁卵泡和排卵后卵泡中,Dicer-a表达量降低,Dicer-b表达量增加,增加的Dicer-b参与细胞凋亡的调控。借助Dicer酶的催化作用,早期闭锁卵泡中的miR-99a前体被加工为成熟的miR-99a序列,与AGO等组分结合形成RISC复合体,并不断累积。AGO对miR-99a的装载效率以及Dicer酶的活性,对该时期miR-99a积累及其功能发挥起着关键作用。
过表达miR-99a后,颗粒细胞的增殖受到抑制,凋亡水平上升,颗粒细胞G1期减少,S期增加,G2期略有增加。Mueller等[17]研究发现当miR-99a表达下调时,细胞对DNA损伤的敏感性增加。miR-99a可能通过靶向SMARCA5基因编码的蛋白SNF2H,间接诱导细胞周期在S期停滞。过表达的miR-99a可能对SNF2H蛋白产生抑制作用,阻碍其相关染色质重塑复合物介导的DNA修复过程,使细胞在S期检查点处停滞。若这一假设成立,那么在卵泡中过表达miR-99a可能会阻碍受损DNA的修复,导致DNA受损的颗粒细胞无法继续增殖。
过表达miR-99a可以上调促凋亡基因BAD和细胞周期蛋白依赖性激酶基因CDK1、CDK4的表达,其处于mTORC2信号通路下游的AKT/BAD通路,该通路可促进细胞凋亡,并且能够被Torin2抑制[18-19]。miR-99a对颗粒细胞凋亡的影响还可能与线粒体途径有关。miR-99a还上调自噬相关基因ATG13的表达量,增加颗粒细胞的自噬水平。通过过表达miR-99a促进了颗粒细胞凋亡和抑制了颗粒细胞增殖,为探究miRNA在细胞增殖和凋亡中的作用提供了新的参考。
-
miR-99a通过影响颗粒细胞的细胞周期、增殖和凋亡,导致细胞周期在S期发生阻滞,抑制细胞增殖,并促进细胞凋亡的相关基因表达变化。



 下载:
下载: