-
开放科学(资源服务)标识码(OSID):

-
马铃薯是我国重要的粮食作物,兼具蔬菜、饲料等多种用途,对保障我国的粮食安全有非常重要的意义[1-2]. 然而,由于马铃薯单一品种的重茬连作,导致土传病害如马铃薯黄萎病的发生逐年加重. 马铃薯黄萎病是一种主要由大丽轮枝菌(Verticillium dahliae)和非苜蓿轮枝菌(V. nonalfalfae)引起的土传兼种传的维管束病害[3-6],在我国内蒙古、河北、甘肃、宁夏等地均有发生,轻者减产20%~30%,重者损失达50%以上,严重制约着马铃薯产业的健康发展[3, 7].
马铃薯黄萎病的防治除了选用抗病品种外,主要依靠化学药剂,不仅造成生态环境污染,农产品中残留增加,同时危害人类健康. 微生物杀菌剂由于具有环境友好性、适应性强的特点,在农业生产中得到越来越多的关注. 然而,用于防治马铃薯黄萎病的微生物杀菌剂产品较少,因此,亟需继续开展马铃薯黄萎病高效绿色防控技术研究. 有报道表明,芽胞杆菌对马铃薯黄萎病具有较好的防治效果[8-9],但这些报道均利用单一生防菌株进行病害防治,施入土壤后受土壤中多种因素的综合影响,易造成防治效果降低或不稳定等[10]. 因此,以多株生防细菌配比组合防治植物病害成为当前的研究热点. 如芽胞杆菌属细菌F-1和D-3菌株发酵液配比组合后,对甜瓜枯萎病的防效高于两菌株单独使用[11];几株促生芽胞杆菌混合能提高对黄瓜病害的防治和促生效果[12];而有关生防菌配比组合防治马铃薯黄萎病的研究报道较少. 前期研究发现[13],以枯草芽胞杆菌HMB26553菌株和解淀粉芽胞杆菌PHODG36菌株为有效成分研发的30亿CFU/g芽胞杆菌可湿性粉剂能够有效防治马铃薯黄萎病且有一定的增产作用,在此基础上,本研究探索了2个菌株不同比例配比组合对马铃薯的促生作用,并初步研究了这些配比组合对大丽轮枝菌的抑制作用及对马铃薯黄萎病的防治效果,为进一步深入开发2个菌株复合微生物菌剂防治马铃薯黄萎病提供科学依据.
全文HTML
-
生防菌枯草芽胞杆菌HMB26553、解淀粉芽胞杆菌PHODG36以及植物病原菌大丽轮枝菌(Verticillium dahliae)均由河北省农林科学院植物保护研究所植物病害生物防治实验室分离并保存.
-
希森六号原原种,购自菁菁缘农业发展有限公司.
-
LB液体培养基:蛋白胨10 g,酵母粉5 g,NaCl 5 g,H2O 1 000 mL,pH值7.0~7.5.
LB固体培养基:蛋白胨10 g,酵母粉5 g,NaCl 5 g,琼脂15 g,H2O 1 000 mL,pH值7.0~7.5.
水琼脂培养基:琼脂8g,H2O 1 000 mL.
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂15 g,H2O 1 000 mL.
PDB培养基:马铃薯200 g,葡萄糖20 g,H2O 1 000 mL.
改良PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂8 g,H2O 1 000 mL.
-
将冻存管保存的HMB26553菌株与PODG36菌株在LB固体培养基平板上活化,30 ℃过夜培养后,挑取2个供试菌株单菌落先后于LB平板上垂直交叉划线,30 ℃培养24 h后,观察2个供试菌株的生长情况,重复3次.
-
分别挑取HMB26553菌株和PHODG36菌株的单菌落接种于LB液体培养基(250 mL装液量100 mL)中,以30 ℃、180 r/min振荡培养12~15 h,制成种子液. 将2个供试菌株种子液按2%的接种比例分别接种于LB液体培养基(300 mL装液量100 mL)中,以30 ℃、180 r/min振荡培养48 h,得到2个菌株发酵液. 采用平板菌落计数法测定2个菌株的菌含量并用无菌水分别稀释至108 CFU/mL,按照下表中不同比例进行配比(表 1),得到不同配比组合发酵液,置于冷藏室备用.
-
将保存的大丽轮枝菌在PDA培养基平板上活化培养6 d后,打取直径6 mm的菌盘,挑取5~6块菌盘接种至装有200 mL PDB培养基的三角瓶中,于25 ℃、180 r/min条件下摇培6~7 d,镜检观察待孢子量达到108个孢子/mL时,备用.
-
挑选大小一致、带有1~2个芽眼的马铃薯原原种置于培养皿(直径15 cm)中,分别加入HMB26553菌株和PHODG36菌株不同配比组合发酵液,浸泡30 min,取出待阴晾干燥后置于加有水琼脂培养基的培养皿内(直径15 cm). 以LB液体培养基处理作为对照. 每处理10粒种子,3次重复. 将培养皿置于25 ℃人工气候室进行黑暗培养,25 d后统计马铃薯的发芽率及芽长.
-
挑选大小一致、带有1~2个芽眼的马铃薯原原种播种于装有500 g无菌蛭石的花盆(盆口直径∶盆底直径∶高=18 cm∶13 cm∶15 cm)中,每盆播种10粒种子,分别浇施400 mL不同配比组合发酵液,置于温室中培养. 以浇入等量LB液体培养基作为对照. 每处理4次重复,每重复1盆. 每间隔6 d浇施不同配比组合发酵液1次,共浇施4次,最后一次浇施7 d天后(自播种25 d)测量株高、茎粗、叶片叶色值、植株地上部鲜质量及干质量、地下部鲜质量及干质量[14]. 其中,叶片叶色值(Soil and Plant Analyzer Development,SPAD)采用SPAD便携式叶绿素测定仪(SY-S02,石家庄世亚科技有限公司)进行测定.
-
采用牛津杯双层培养基法[15]测定不同配比组合发酵液对马铃薯黄萎菌的抑制作用. 将10 mL PDA培养基倒入无菌培养皿中作为下层平板备用;在100 mL改良PDA培养基中加入2 mL大丽轮枝菌分生孢子悬浮液(106个孢子/mL),混匀后倒在下层平板上作为上层. 在制备好的双层平板中央放置1个无菌牛津杯,并注入150 μL不同配比组合发酵液. 以LB液体培养基作为对照,每处理5次重复. 25 ℃培养5 d后观察供试配比组合对大丽轮枝菌的抑制作用,并以十字交叉法测量抑菌圈的直径.
-
采用伤根接种法[13],评价不同配比组合发酵液对马铃薯黄萎病的防治效果. 挑选大小一致、带有1~2个芽眼的马铃薯原原种种植于装有育苗基质(田园土∶花肥=1∶1)的花盆中,每盆播种10粒种子,分别浇施400 mL不同配比组合发酵液,置于25 ℃的人工气候室中培养. 以浇入等量LB液体培养基作为对照. 每处理3次重复,每重复1盆,每间隔10 d浇施1次,共浇施3次. 末次浇施10 d后,在马铃薯的花盆底部约2 cm处用壁纸刀横切一圈,置于盛有2 L大丽轮枝菌分生孢子悬浮液(107个孢子/mL)的塑料盒(长∶宽∶高=42cm∶30 cm∶12 cm)中浸泡30 min,取出并置于25 ℃人工气候室中,继续培养21 d后,按照5级分级法调查马铃薯黄萎病的发生情况[8],并计算病情指数和防效. 病情指数=Σ(病级×相应病级株数)/(4×总株数)×100,防效=(对照病情指数-处理病情指数)/对照病情指数×100%.
-
采用Excel 2016和SPSS 19.0软件进行统计分析,采用邓肯氏新复极差法进行差异显著性检验.
1.1. 供试材料
1.1.1. 供试菌株
1.1.2. 供试马铃薯品种
1.1.3. 供试培养基
1.2. 方法
1.2.1. HMB26553菌株与PODG36菌株相容性测定
1.2.2. 不同配比组合发酵液的制备
1.2.3. 大丽轮枝菌分生孢子悬浮液的制备
1.2.4. 不同配比组合发酵液对马铃薯种薯萌发的影响
1.2.5. 不同配比组合发酵液对马铃薯的促生作用评价
1.2.6. 不同配比组合发酵液对马铃薯黄萎菌的抑制作用
1.2.7. 不同配比组合发酵液对马铃薯黄萎病的防治效果
1.3. 数据统计与分析
-
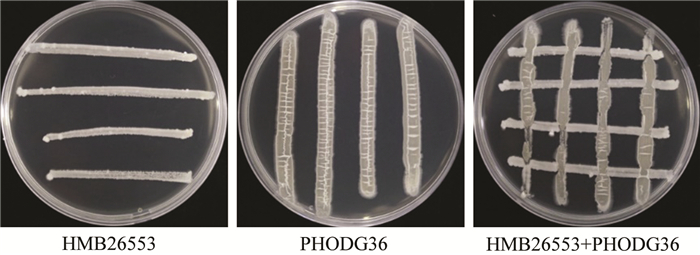
HMB26553菌株与PODG36菌株在同一LB平板上进行划线培养,结果表明,2个供试细菌菌株划线培养的交叉点及近处未发现明显的相互抑制现象,说明此2个菌株间生长互不影响(图 1). 因此,两菌株间具有相容性,发酵液可以配比使用.
-
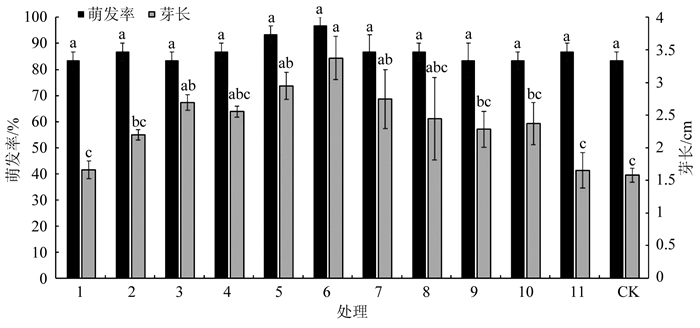
在马铃薯种薯萌发率方面,经不同配比组合发酵液处理后,种薯萌发率各处理之间没有显著性差异,与对照相比亦没有显著性差异,但组合6的种薯萌发率较对照提高16.67个百分点. 在马铃薯种薯芽长方面,组合6的种薯萌芽长度最高(3.37 cm),与组合3、4、5、7和8没有显著性差异,但显著高于其他配比组合及对照;比组合1和组合11的单个菌剂处理分别提高50.66%和50.98%,比对照提高113.48%(图 2).
-
不同配比组合发酵液对马铃薯幼苗的株高、茎粗、叶片叶色值、植株鲜干质量、根鲜干质量具有不同程度的促生作用(表 2).
在株高方面,组合6的株高最高,达到20.75 cm,与组合5的19.72cm差异不显著,但显著高于其他配比组合及对照;比组合1和组合11分别提高18.72%和27.21%,比对照提高30.05%. 在茎粗方面,组合6的茎粗最粗,为2.26 mm,与组合4、5、7、8和9无显著性差异,但显著高于其他配比组合及对照;比组合1和组合11分别提高54.79%和34.52%,比对照提高50.67%. 在叶片叶色值方面,组合6的叶片叶色值最高,达到61.71,与组合4、5、7、8和9无显著性差异,但显著高于其他配比组合及对照;比组合1和组合11分别提高32.87%和16.83%,比对照提高31.53%. 在植株质量方面,组合6的植株鲜质量和干质量均最高,分别为9.54 g和1.05 g,与组合4、5、7、8、9和10没有显著性差异,但显著高于其他配比组合及对照;植株鲜、干质量比组合1分别提高92.95%和61.54%、比组合11分别提高52.64%和59.09%、比对照分别提高71.89%和101.92%. 在根质量方面,组合6的根鲜质量最高,为1.13 g,与其他配比组合均无显著性差异,但显著高于对照,比对照提高18.95%;不同配比组合的根干质量均无显著性差异,其中组合6的根干质量最高,比对照提高22.22%.
-
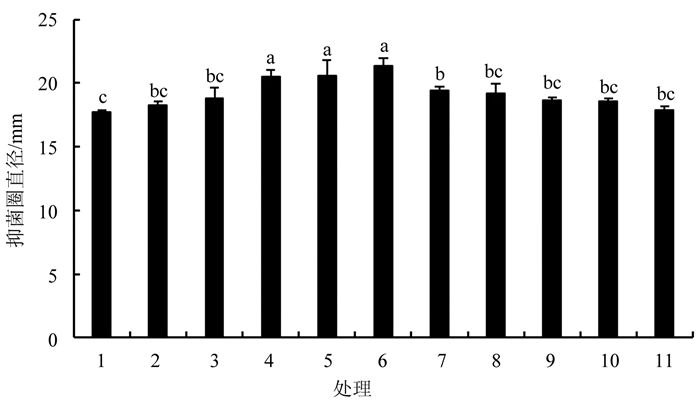
不同配比组合发酵液对大丽轮枝菌具有不同程度的抑制作用(图 3). 其中,组合6对大丽轮枝菌的抑制作用最强,抑菌圈直径最大,达到21.33 mm,与组合4和组合5没有显著性差异,但显著高于其他配比组合,比组合1和组合11的单个菌剂处理分别提高20.30%和19.63%.
-
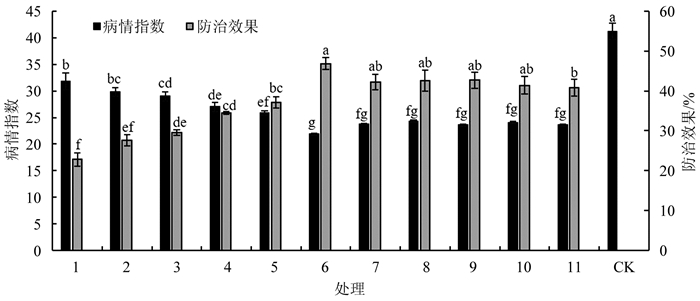
不同配比组合发酵液对马铃薯黄萎病的防治效果有所不同(图 4). 组合1~11均能够显著降低马铃薯黄萎病的病情指数,其中组合6的防治效果最高,达到46.90%,与组合7、8、9和10(防效分别为42.23%、42.58%、42.70%和41.43%)之间没有显著性差异,但显著高于其他配比组合.
2.1. HMB26553菌株与PODG36菌株相容性测定
2.2. 不同配比组合发酵液对马铃薯种薯萌发的影响
2.3. 不同配比组合发酵液对马铃薯的促生作用
2.4. 不同配比组合发酵液对大丽轮枝菌的抑制作用
2.5. 不同配比组合发酵液对马铃薯黄萎病的防治效果
-
复合微生物菌剂是在单一生防菌剂的基础上诞生的菌菌复配的新型高效生防模式,将具有不同功能的菌株进行复配组合,发挥出功能互补的作用,在改良土壤、促生防病方面具有积极的效应[16-17]. 何嘉等[18]报道,丛枝菌根真菌和解淀粉芽胞杆菌复合菌剂可将枸杞产量提高46.22%;于宏等[19]研究表明,复合菌剂可显著促进花生根系的生长、增加花生根瘤数量以及提高叶片SPAD值. 本研究与上述研究结果相同,将枯草芽胞杆菌HMB26553与解淀粉芽胞杆菌PHODG36以不同比例配比组合后处理马铃薯,发现不同的配比组合对马铃薯促生效果不同,其中组合6(HMB26553∶PHODG36=50∶50,V∶V)能够显著提高马铃薯种薯的芽长、株高、茎粗、叶片叶色值、植株鲜干质量,优于单一菌剂处理. 这说明复合微生物菌剂具有协同作用,不同菌株可能通过分泌不同代谢产物,协同促进植物生长;同时,复合微生物菌剂的应用效果,与其中单一菌剂的浓度有关. 说明复合微生物菌剂只有比例适当时,才能对植物生长产生刺激作用.
有研究表明,多种生防菌株复配可提高生防效果和稳定性. 枯草芽胞杆菌GLB191和短小芽胞杆菌GLB197混合接种处理对葡萄灰霉病的病斑抑制率高达70.89%,高于单菌株的病斑抑制率[20];Exiguobacterium indicum D1/8和蜡样芽胞杆菌D1/17混合防治番茄猝倒病较单菌株相比发病率减少了27%[21],但这些研究报道并未对混合菌株的配比比例进行筛选. 本研究发现,HMB26553和PHOD36单菌株及以不同比例配比组合对大丽轮枝菌具有不同程度的抑制作用,其中组合6对大丽轮枝菌的抑制作用最强,显著高于单一菌株,这可能与芽胞杆菌菌株本身的抑菌作用强弱及菌株产生的抗生素种类不同等因素有关[22-23]. 同时,盆栽防效试验结果也表明,组合6对马铃薯黄萎病的防治效果最高,显著高于单一菌株,达到46.90%,这可能是因为两菌株混合能提高代谢产物的抑菌作用及菌株的定殖能力,从而更好地抵抗不良环境等. 利用复合微生物菌剂来防治植物病害是生物防治的一个发展趋势,本研究将为马铃薯黄萎病复合微生物菌剂的研发提供理论依据.



 下载:
下载: