-
茶具有重要的经济、保健和生态价值,茉莉花茶属于典型的“气质花”,香气清新幽雅,是我国的特种茶,早在南宋时期便有制作记载[1-2].茉莉花茶质量的优劣很大程度上取决于其香气的释放量以及释放时间[3],茉莉花各个品种共有的主要香精成分有芳樟醇、吲哚、邻氨基苯甲酸甲酯、2-甲酸基苯乙酮、石竹烯和苯甲酸苄酯,这6种成分共同奠定了茉莉花香气的基础[4-5].然而茉莉花的保鲜时间短、保鲜效果不佳,导致茉莉花利用率低,在市场上价格居高不下,而加入化学保鲜液不仅会对人体有一定的伤害,还会造成难以解决的环境污染问题[6],因此对环境友好的茉莉香精缓释剂的研究显得尤为重要.
淀粉是由葡萄糖分子聚合的高分子类化合物,外观性状为白色无味粉末,不溶于冷水、乙醇等,与水加热可使其糊化形成糊浆状.淀粉在低于糊化温度下,加入乳化剂、交联剂、引发剂可反应形成许多类似蜂窝状的多孔结构产物,其多孔结构可以吸附承载许多物质,减小挥发性物质的挥发速度,多孔淀粉已经作为一种超强的新型吸附材料广泛用于食品、医药和环境等很多领域[7-8].其中,淀粉微球表面存在独特的微孔且其原料来源广泛,价格低廉,环境友好,绿色安全,可再生周期短,具有良好的吸附性能,目前已经广泛应用于食品、医学、化妆品和工业污水处理等领域,并且取得了较好的研究进展[9-11].常用的多孔淀粉的制备方法有反相胶乳法、酶解法、酸法和复合处理法等[12-13].利用β-环糊精特殊的复杂空腔结构,将其作为改性剂,通过化学键合的方法对淀粉进行改性,形成了一种新型的功能高分子材料,即交联β-环糊精/可溶性淀粉复合微球,相对单纯的淀粉微球或β-环糊精微球,制得的复合微球既保留了β-环糊精单体的包合作用,还具有更强大的吸附能力[14-16].
本研究采用反相胶乳法制备淀粉微球和淀粉-β-环糊精复合微球,比较二者对茉莉香精二氢芳樟醇的缓释性能,探究吸附的最佳条件,以期为复合微球在茉莉花香精缓释中的应用提供有效的参考依据.
全文HTML
-
实验药品:淀粉分析纯,天津市天力化学试剂有限公司; β-环糊精分析纯,西宝生物科技(上海)股份有限公司; 二氢芳樟醇95%化学纯,阿拉丁试剂(上海)有限公司; 亚硫酸氢钠分析纯,天津市大茂化学试剂厂; Span60化学纯,阿拉丁试剂(上海)有限公司; Tween60化学纯,阿拉丁试剂(上海)有限公司; 环氧氯丙烷分析纯,天津市河东区红岩试剂厂; 氢氧化钠分析纯,天津市百世化工有限公司; 无水乙醇分析纯,西安三浦精细化工厂; 实验用水均为蒸馏水.
实验仪器:UV-5100B紫外可见分光光度计,上海兰仪实业有限公司; W201B型恒温水浴锅:上海跃进医疗器械有限公司; DZF型真空干燥箱,北京科伟永兴仪器有限公司; FA2104电子分析天平,上海精密科学仪器有限公司; PW-100-517电镜扫描仪,复纳科学仪器(上海)有限公司; 85-1磁力搅拌器,上海司乐仪器有限公司; L400-S1真空抽滤机,上海领德仪器有限公司.
-
准确称取Tween60(半固体态)0.2 g于250 mL锥形瓶中,加入适量的无水乙醇搅拌溶解,同时准确称取Span60 (黄色颗粒状)3.0 g于该锥形瓶中,在60 ℃恒温水浴锅中振荡搅拌至Span60和Tween60完全溶解,然后降低恒温水浴锅温度至35 ℃作为实验油相,待用.
-
准确称取10.5 g淀粉(分析纯)于250 mL锥形瓶(编号1)中; 准确称量7.0 g淀粉(分析纯)和3.5 g β-环糊精(2:1)两者混合倒入250 mL锥形瓶(编号2)中; 分别加入100 mL蒸馏水,玻璃棒搅拌至淀粉和β-环糊精充分混合,迅速移取2份2 mL现配的浓度为0.2 mol/L NaOH溶液至编号1、2中的锥形瓶.用玻璃棒充分搅拌至淀粉、β-环糊精和NaOH三者混合均匀,作为实验水相,待用.
-
将恒温水浴锅温度调至60 ℃,等待片刻,把装有实验油相的锥形瓶放入恒温水浴锅中,同时将制备的实验水相用玻璃棒引流,缓慢地倒入实验油相中,边加边振荡,避免水相的加入降低油相的温度,油相在液体表面形成油膜甚至凝固会影响油相对反相胶乳的作用.将制备好的反应液置于磁力搅拌器调节温度为30 ℃,恒温高速搅拌乳化30 min后,取下锥形瓶趁热移取0.4 mL环氧氯丙烷交联剂,将称取好的0.6 g过硫酸钾和0.3 g亚硫酸氢钠同时加入锥形瓶中,作为反相胶乳法引发剂,振荡充分.
反相胶乳阶段以及后续处理:在磁力搅拌器上降低搅拌速度和温度,时刻关注锥形瓶中的反应情况,避免反应液沸腾过于剧烈使液体溅出锥形瓶以及温度过高使淀粉糊化.充分反应2 h后,取下锥形瓶放于实验台静置、冷却.加入适量无水乙醇洗涤,静置,去除上层清液,少量反复洗涤多孔淀粉微球和淀粉-β-环糊精微球2~3次,抽滤、105 ℃恒温真空干燥箱烘干4 h,最后得到多孔淀粉微球和淀粉-β-环糊精微球,用药品袋密封放置,贴好标签备用.
-
采用扫描电镜(SEM)观测两种微球的微观形态(喷金处理试样表面).
-
二氢芳樟醇标准液的配制:
准确移取0.1 mL二氢芳樟醇溶液于500 mL容量瓶中,用无水乙醇稀释定容到500 mL刻度线,上下颠倒摇匀,配成二氢芳樟醇标准液(浓度c=1.094 mmol/L).
二氢芳樟醇系列标准溶液的配制:
移取5 mL二氢芳樟醇现配标准液,稀释5倍,用紫外分光光度仪扫描二氢芳樟醇标准液,得出二氢芳樟醇在237 nm处有最大吸收峰,将波长237 nm作为本实验测定二氢芳樟醇吸光度最佳吸收波长.分别将原始标准溶液配成浓度为0.218 8,0.182 4,0.136 8,0.109 4 mmol/L的二氢芳樟醇梯度溶液.紫外分光光度计在237 nm波长下,无水乙醇作为空白调零,用石英比色皿测定吸光度.
-
正交试验1:淀粉-β-环糊精微球质量与时间
移取少量浓度为0.109 4 mmol/L的二氢芳樟醇溶液,用UV-5100B紫外可见分光光度计在波长为237 nm测定其在未加淀粉-β-环糊精微球时的吸光度.采用量程为10 mL标准移液管准确移取2份10 mL浓度为0.109 4 mmol/L的二氢芳樟醇于编号①和②的比色管中,立刻用玻璃塞塞住防止二氢芳樟醇分子挥发,移取2份10 mL无水乙醇于编号③和④的比色管中作为实验空白对照.称取2份0.2 g淀粉-β-环糊精微球分别缓慢倒入编号①和③比色管中,称取2份0.3 g淀粉-β-环糊精微球缓慢倒入编号②和④比色管中.分别静置0.5,1,2 h后,用加入相同的淀粉-β-环糊精微球质量作为对照,空白置零,UV-5100B紫外可见分光光度计分别测编号①和②比色管中溶液的吸光度,测定3次取其平均值,并记录吸光度(表 2).
正交试验2:二氢芳樟醇浓度与时间
移取少量浓度为0.182 4,0.136 8,0.109 4 mmol/L的二氢芳樟醇溶液,用UV-5100B紫外可见分光光度计在波长为237 nm分别测定其在未加淀粉-β-环糊精微球时的吸光度.准确移取0.182 4,0.136 8,0.109 4 mmol/L的二氢芳樟醇溶液10 mL于编号①、②、③的比色管中,用玻璃塞塞住,移取10 mL无水乙醇于比色管作为对照组(编号④),称取4份0.3 g淀粉-β-环糊精微球分别缓慢倒入编号①、②、③、④比色管中,静置1,2 h后,对照组④空白置零,UV-5100B紫外可见分光光度计测编号①、②、③比色管中溶液的吸光度,测定3次取其平均值,并记录吸光度(表 3).
-
正交试验3:时间与淀粉微球质量
移取少量浓度为0.136 8 mmol/L的二氢芳樟醇溶液,用UV-5100B紫外可见分光光度计在波长为237 nm分别测定其在未加淀粉微球时的吸光度.准确移取10 mL浓度为0.136 8 mmol/L的二氢芳樟醇标准溶液3份于3支比色管中,并迅速用玻璃塞塞住,编号①、②、③; 同时移取3份10 mL无水乙醇分别于编号④、⑤、⑥比色管中.称取淀粉微球0.20,0.25,0.35 g分别缓慢倒入编号①、②、③的比色管中,称取淀粉微球0.20,0.25,0.35 g分别缓慢倒入编号④、⑤、⑥的比色管中作为对照组.静置1,2 h后,用加入相同的淀粉微球质量作为对照,空白置零UV-5100B紫外可见分光光度计测其编号①、②、③的吸光度,测定3次取其平均值,并记录吸光度(表 4).
正交试验4:时间与二氢芳樟醇浓度
移取少量浓度为0.182 4,0.136 8,0.109 4 mmol/L的二氢芳樟醇溶液,用UV-5100B紫外可见分光光度计在波长为237 nm分别测定其在未加淀粉微球时的吸光度.分别准确移取10 mL浓度为0.109 4,0.136 8,0.182 4 mmol/L的二氢芳樟醇标准溶液于比色管中,并迅速用玻璃塞塞住,编号①、②、③,移取10 mL无水乙醇于比色管作为对照组编号④,称取4份0.3 g淀粉微球分别缓慢倒入编号①、②、③、④的比色管中,分别静置1,2 h后,对照组④空白置零,UV-5100B紫外可见分光光度计测编号①、②、③的比色管中溶液的吸光度,测定3次取其平均值,并记录吸光度(表 5).
1.1. 实验药品和仪器
1.2. 实验制备和结构测试
1.2.1. 油相制备
1.2.2. 水相制备
1.2.3. 淀粉微球的制备
1.2.4. 多孔淀粉微球和淀粉-β-环糊精微球的微观形貌结构测试
1.3. 二氢芳樟醇标准曲线的绘制
1.4. 淀粉微球对二氢芳樟醇的缓释性能测定
1.4.1. 淀粉-β-环糊精微球对二氢芳樟醇的缓释
1.4.2. 淀粉微球对二氢芳樟醇的缓释
-
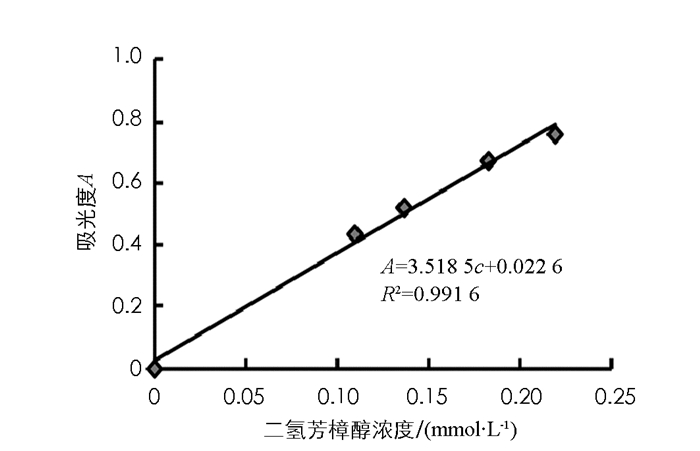
二氢芳樟醇浓度与吸光度曲线以最小二乘法进行线性回归,计算吸光度A与二氢芳樟醇浓度c的线型关系为A=3.518 5c+0.022 6,相关系数R2=0.991 6,该结果表示二氢芳樟醇浓度标准曲线在测定范围内线性关系良好(图 1).
-
图 2为淀粉-β-环糊精微球的SEM照片.由图 2可知:β-CD与可溶性淀粉通过反相胶乳法交联反应形成的复合微球,具有球形较规整、分布均匀和表面呈多孔结构孔隙体积较大之特征; 这些特征有利于被吸附物在吸附剂表面形成更加有序的排列,并且较大的比表面积及孔结构可以增加吸附剂的作用位点(如氢键、配位键和静电作用力[11]等).孔隙体积的增大增加了吸附质的存储空间,较好地提高了吸附剂的吸附量,延长了吸附饱和时间,吸附作用时间更长久.同时降低使用过程中脱附效率,避免造成二次污染,从而提高了吸附效果.
-
反相胶乳法作为一种常用的改性方法[17-18],工艺简单,操作安全方便,反应条件温和,本实验采用淀粉-β-环糊精溶液作为水溶性单体、过硫酸钾和亚硫酸氢钠为引发剂,Span60和Tween60为乳化剂,环氧氯丙烷为交联剂,制备得到的多孔淀粉-β-环糊精微球孔径较大,聚合速率高,可通过加入适量NaOH调节pH值,加入适当的乳化剂使聚合物快速的溶于水.实验油相和水相接触采用30°恒温水浴锅加热,水相滴加到油相使其充分混合.需要注意的是:①若油相加到水相会由于水相温度低,两者温度之间发生热传递,油相温度迅速降低并且凝固,导致水相表面漂浮油相,在反应液表面形成一层油膜,抑制反应的进行,导致胶乳效果不佳. ②淀粉和β-环糊精比例较大时,淀粉较粘稠,不能和β-环糊精充分接触,得不到很好的分散效果,不能形成实验所需要的乳液体系. ③若溶液浓度太低,两者之间不能充分地进行交联反应.实验可知:在不考虑其他因素的条件下,淀粉和β-环糊精质量比为2:1时最佳.本实验制备的淀粉-β-环糊精微球形状圆整,颗粒大小均匀,内部孔径大,吸附量大,尤其是对挥发性分子吸附效果好,对香精分子的挥发有较好的缓释作用.
-
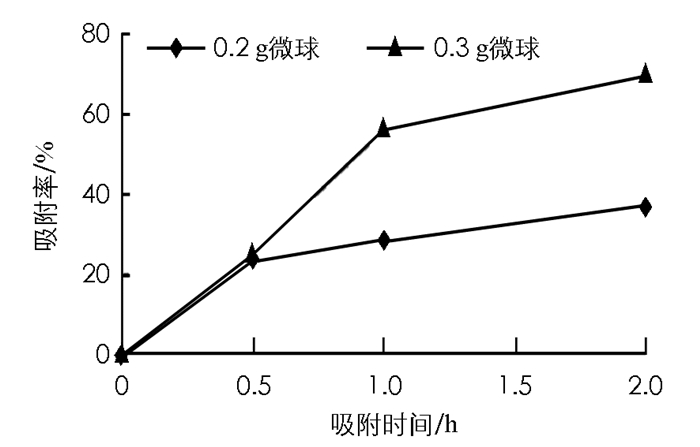
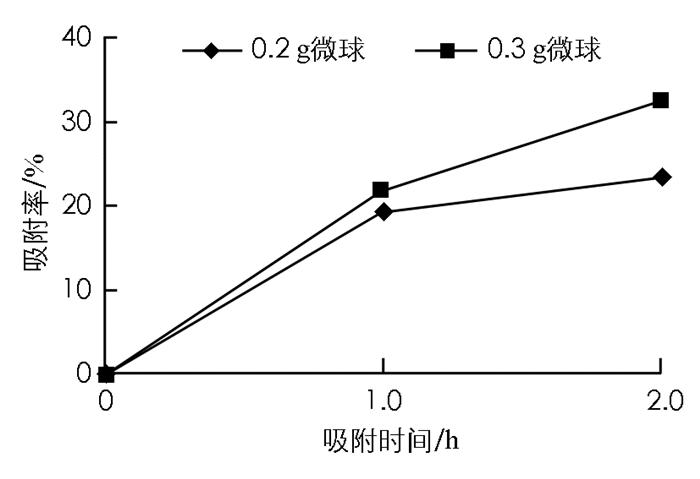
分别采用淀粉-β-环糊精微球和淀粉微球吸附二氢芳樟醇,分析不同微球的投加质量和吸附时间对微球对二氢芳樟醇吸附率的影响(图 3和图 4).
由图 3可知,淀粉-β-环糊精微球投加质量为0.3 g,吸附时间在0.5~1.0 h之间,吸附率从0增加到56%,吸附率增加明显; 在1.0~2.0 h之间,吸附率仅增加14%,吸附率增加速度明显减缓.因为淀粉-β-环糊精微球表面孔径容积和吸附位点具有一定的限度,当吸附达到一定量,吸附饱和,维持吸附动态平衡,淀粉-β-环糊精微球吸附香精分子的速度减缓.同理,图 4中不同投加质量的淀粉微球的吸附率在0~1.0 h之间增加较快,而在1.0~2.0 h之间淀粉微球对二氢芳樟醇的吸附明显减缓.淀粉-β-环糊精微球在投加质量为0.3 g的条件下吸附率最高可达70%,明显高于淀粉微球.实验得出结论:淀粉-β-环糊精微球对二氢芳樟醇的吸附率随微球投加质量的增加而显著提高,淀粉-β-环糊精微球表面微孔数量和大小有限,在香精分子浓度和吸附时间一定的情况下,淀粉-β-环糊精微球投加质量多,淀粉内部压强差大,可吸附的分子量越多.从经济情况以及实际情况综合考虑,1.0 h内吸附速度快,1.0~2.0 h之间吸附速度降低,淀粉-β-环糊精微球和淀粉微球在2.0 h时对二氢芳樟醇的吸附综合效果最好,缓释二氢芳樟醇挥发作用明显; 淀粉-β-环糊精微球吸附率大于淀粉微球对二氢芳樟醇的吸附,在单因素条件下,加入β-环糊精作为反相胶乳法单体制备的多孔微球吸附香精分子效果更好,其缓释香精分子的挥发效果更佳.
-
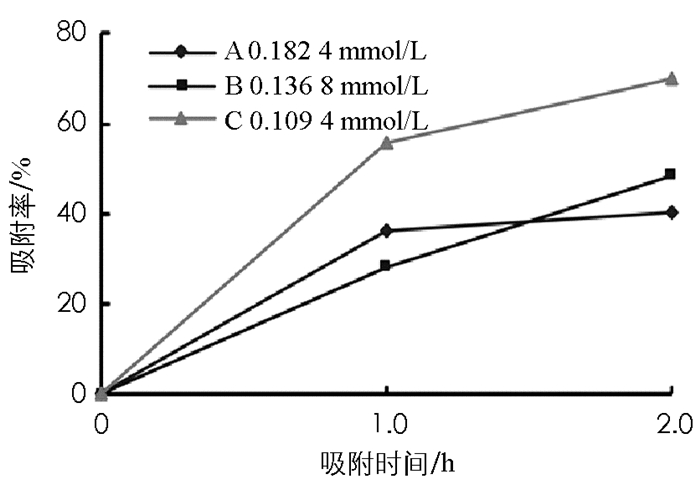
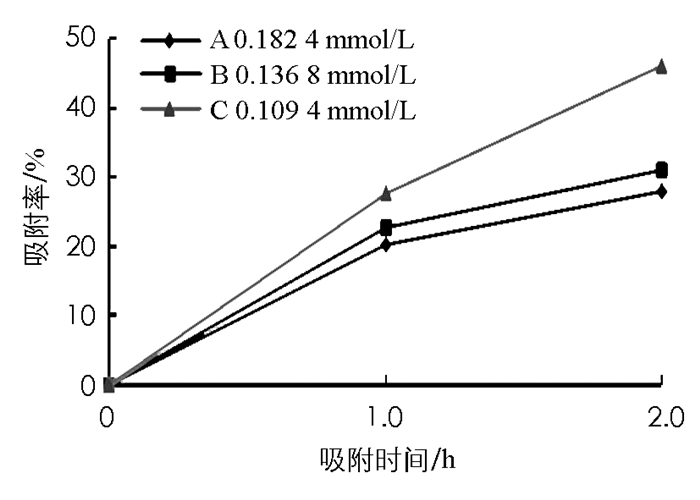
分别研究和分析不同浓度的二氢芳樟醇,对淀粉-β-环糊精微球和淀粉微球对二氢芳樟醇的吸附率的影响(图 5和图 6).保持两种微球投加质量和其他条件不变,控制二氢芳樟醇的浓度作为单因素变量,浓度为0.109 4 mmol/L、吸附2.0 h时,淀粉-β-环糊精吸附率达到70%,而浓度为0.182 4 mmol/L、吸附2.0 h时,淀粉-β-环糊精吸附率只有40.2%.
由图 5和图 6观察可得,在低浓度条件下微球吸附率比高浓度时大.如图 5所示,A组浓度为C组的1.67倍,当吸附时间为1 h时,C组吸附率为A组的1.5倍,吸附时间为2 h时,C组吸附率为A组的1.7倍,说明浓度增大,淀粉-β环糊精微球吸附香精分子的吸附率呈现下降趋势.可以理解为在淀粉-β-环糊精微球吸附二氢芳樟醇分子过程,微球投加质量一定,香精分子吸附位点恒定,二氢芳樟醇浓度越高,吸附效率越低.而对于只有淀粉制备的微球来说(图 6),微球对香精的吸附作用较小,效果较小,香精分子的浓度对淀粉微球的吸附率影响不明显.
在投加微球质量一定的情况下,伴随着溶液初始浓度的上升,微球对二氢芳樟醇的吸附率下降.这是因为在吸附过程中,吸附位点是固定的,所以吸附量也是不变的,而当其初始浓度较低时,由于二氢芳樟醇分子的数量少,微球的吸附位点还有剩余,所以在低浓度的情况下微球的吸附率较高; 在0~1.0 h之间,3种不同浓度的二氢芳樟醇,淀粉-β-环糊精微球对二氢芳樟醇吸附速度增加明显,1.0~2.0 h之间增加速度明显减缓.从图 5和图 6也可得出,淀粉-β-环糊精微球和淀粉微球在2.0 h处吸附综合效率最佳.
2.1. 二氢芳樟醇标准曲线绘制
2.2. 性能表征
2.3. 多孔淀粉的反相胶乳法
2.4. 不同微球投加质量和吸附时间对吸附率的影响
2.5. 不同二氢芳樟醇浓度吸附率随时间的变化
-
本实验主要研究以β-环糊精为载体,采用常用的反相胶乳法制备的淀粉-β-环糊精微球对二氢芳樟醇的吸附效果以及吸附最佳条件,以此反应其对香精分子的缓释性能研究,同时比较分析淀粉微球和淀粉-β-环糊精微球对香精缓释效果,探究加入β-环糊精对淀粉吸附作用的改善效果,以期制备出高效、无毒的新型挥发性分子吸附剂.
1) 以淀粉为原料,以β-环糊精为载体,利用反相胶乳法,以Span60和Tween60作为乳化剂,环氧氯丙烷作为交联剂,制备淀粉-β-环糊精微球,制得的微球颗粒均匀,微球内部空间更大,比无β-环糊精为载体的淀粉微球对二氢芳樟醇吸附效果更好.
2) 淀粉β-环糊精微球越多,给二氢芳樟醇分子提供的吸附结合位点越多,吸附量越大,以微球投加质量为单因素条件下,微球吸附香精分子的吸附率随微球投加质量的增加而增大.
3) 淀粉-β-环糊精微球作为一种新型香精缓释剂具有极大的潜能,无毒、环保,可以达到缓释香精的效果,本实验以茉莉香精的主要成分二氢芳樟醇为吸附质,探讨淀粉-β-环糊精微球吸附效果,可为其在茉莉花香精缓释中的应用提供有利的技术指导.



 下载:
下载: