-
开放科学(资源服务)标志码(OSID):

-
魔芋(Amorphophallus)又名蒟蒻、鬼芋,是天南星科魔芋属的多年生宿根草本植物[1],球茎中富含葡甘露聚糖(Amorphophallus glucomannan,KGM),是目前发现的仅有几种富含天然葡甘露聚糖的植物之一.
魔芋细菌性软腐病主要是由胡萝卜软腐果胶杆菌胡萝卜亚种(Pectobacterium carotovorum subsp. carotovorum)、胡萝卜软腐欧文氏菌黑腐亚种(Pectrobacterium carotovora ssp. atroseptica)和菊欧文氏菌(Erwinia chrysanthemi)等致病菌引起[2],其中胡萝卜亚种寄主最多、分布最广,是主要的致病菌种[3]. 软腐病在魔芋生长期和贮存期均可发病,生长期造成倒苗,贮存期造成烂种. 该病传播途径多样,常年发病率超过30%,部分地块甚至绝收,单一的防治方法很难获得理想的效果,一旦发病很难治愈. 因此,软腐病也被称为魔芋的“癌症”[4].
拮抗菌可通过抗生作用、重寄生作用、促生作用和诱导植物抗性等作用机制来防治病害,在一种或多种机制的共同作用下,抑制病原菌的生长繁殖,或者诱导植物系统产生抗性,促进植株生长. 在农业防治中,研究人员从土壤、植物体等介质中分离筛选出了对甜瓜黑斑病菌[5]、猕猴桃溃疡病菌[6]、花生果腐病菌[7]等病害的病原菌具有较强抑菌作用的拮抗菌. 有研究发现放线菌娄彻氏链霉菌“D74”对魔芋软腐病菌抑制作用强,且活菌制剂对魔芋有良好的防病促生效果,能显著改善魔芋品质[8]. 余婷等[9]通过组织分离法从健康块茎中分离得到对魔芋软腐病具有拮抗作用的17株内生细菌. 从魔芋根际土壤中分离出的放线菌SJK18弗氏链霉菌(Streptomyces fradiae)中一个新的亚种能抑制软腐病的发生[10]. 李辉等[11]分离筛选出了一株可以高效拮抗魔芋软腐病的苏云金芽孢杆菌.
本试验通过分离鉴定并明确魔芋软腐病致病菌,以期并筛选出有效的魔芋软腐病拮抗放线菌,从而丰富魔芋软腐病的生物防控途径.
全文HTML
-
从西南大学魔芋资源圃内采集具备软腐病典型症状的新鲜魔芋球茎、叶片及叶柄作为样品,并记录软腐病发病部位和典型症状.
-
供试烟草灰霉病菌、烟草炭疽病菌、辣椒疫霉病菌、番茄早疫病菌、烟草拟盘多毛孢、茄子褐纹病菌、油菜菌核病病菌和毛霉病原菌以及放线菌菌株F1-F221由西南大学植物保护学院免疫及生防实验室提供,其余菌株分离自重庆北碚区歇马西南大学魔芋资源圃、云南勐海基地和贵州纳雍曙光魔芋基地土壤.
-
牛肉膏蛋白胨(NA)培养基:蛋白胨10 g/L,牛肉膏3 g/L,NaCl 5 g/L,琼脂15~20 g/L.
高氏合成一号琼脂培养基:KNO3 1.0 g/L,NaCl 0.5 g/L,MgSO4 0.5 g/L,K2HPO4 0.5 g/L,FeSO4 0.01 g/L,可溶性淀粉20.0 g/L,琼脂20.0 g/L,蒸馏水1 000 mL.
马铃薯葡萄糖琼脂培养基(PDA):去皮马铃薯200 g/L,葡萄糖20 g/L,琼脂15~20 g/L.
LB液体培养基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,pH值7.0.
燕麦片培养基:燕麦60 g/L,琼脂15~20 g/L.
麦芽汁培养基:酵母浸粉3 g/L,麦芽粉3 g/L,葡萄糖4 g/L,蛋白胨4 g/L,琼脂15~20 g/L.
-
试验所用设备与仪器主要有:立式压力蒸汽灭菌锅(LDZX-30FBS,上海申安医疗器械厂)、双人单面净化工作台(W-CJ-2FD,苏州净化设备有限公司)、电热恒温培养箱(DHP-9162,上海齐欣科学仪器有限公司)、电子天平(FA2004B,上海越平科学仪器有限公司)、摇床(ZHWY-211B,上海一恒科学仪器有限公司)、Finnpipette微量移液枪(上海赛默飞世尔仪器有限公司)、电泳仪(DYY-6C,北京六一仪器厂)、PCR仪(A&B2720,美国应用生物系统中国公司)、制冰机(IMS-30,河南冰熊制冰机有限公司)、冷冻高速离心机(LEGEND MACH 1.6R,艾本德中国有限公司)等.
-
选取新鲜的魔芋发病植株,用灭菌的刀片切下病健交界处,75%酒精表面消毒30 s,2% NaClO2消毒2 min,无菌水清洗3~5次,将清洗后的病组织置于无菌水中,用镊子将组织捣碎,静置2 min后用灼烧后的接种环蘸取菌液,划线于NA平板,将平板倒置于28 ℃恒温培养箱中培养48 h. 挑取多个不同形态的单菌落,将其分别移入新的NA培养基上,进行多次纯化. 将获得纯培养的菌株挑取单菌落于LB液体培养基中,28 ℃摇培12 h,置-20 ℃保存备用.
-
将分离的菌株进行科赫氏法则验证,将保存的菌株配成108 CFU/m L的菌悬液. 分别取20 μL菌悬液接种于消毒后的健康魔芋块茎,接种无菌LB液体培养液作为阴性对照,置恒温培养箱28 ℃保湿培养,每个处理重复3次,24 h后观察块茎发病情况,并拍照记录.
-
将魔芋软腐病致病菌株接种在NA培养基上,置于28 ℃恒温培养箱培养24 h后,观察菌落生长状况和菌落形态、颜色. 参照细菌DNA提取试剂盒(OMEGA)步骤提取待测菌株的DNA,采用细菌通用引物27F(5′-AGAGTTTGATCGGCTCAG-3′)和1492R(5′-TACGGCTACCTTGTTACGACTT-3′)进行16S rDNA基因2序列的PCR扩增.
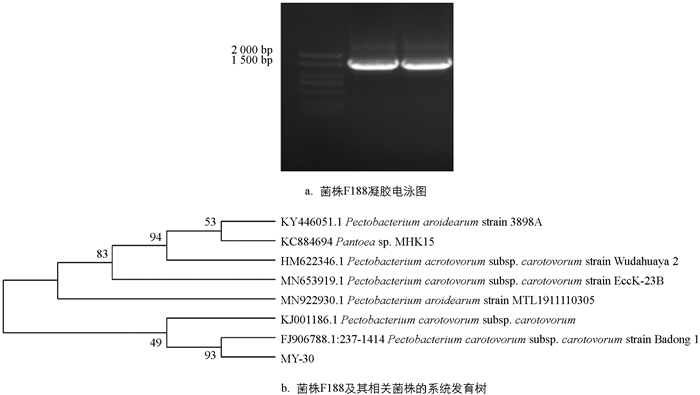
PCR扩增体系(总体系25 μL):2×Hieff TM PCR Master Mix (YEASEN,上海)12.5 μL,引物27F 1 μL,引物1 492 r 1 μL,DNA模板1 μL,dd H2O 9.5 μL. PCR反应程序:94 ℃预变性2 min; 94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸1 min 40 s,35个循环; 72 ℃终延伸8 min. 将回收的PCR扩增产物送至北京六合华大基因科技有限公司测序,测序得到的核酸序列在NCBI数据库用Blast进行比对分析,并用MEGA 7.0软件构建系统发育树.
-
后续试验主要以菌株MY-30进行. 采用土壤稀释法,将收集的土样,每份称取10 g,放入装有100 mL无菌水和无菌玻璃珠的灭菌三角瓶中,28 ℃,200 r/min振荡30 min制成土壤悬浮液后,静置20 min,取适量上清液用无菌水梯度稀释至10-2,10-3,10-4,10-5,10-6共5个梯度; 每个梯度用移液枪吸取200 μL,均匀的涂布在高氏一号培养基上,每个处理3次重复,将平板倒置与于28 ℃恒温培养箱中培养,5 d后挑取不同类型的单菌落转入新的高氏一号培养基中继续培养. 纯化后接种于高氏一号斜面培养基,4 ℃保存备用.
-
以魔芋软腐病病原菌MY-30为供试靶标菌,采用双层培养基法[12]筛选对魔芋软腐病病原菌具拮抗作用的放线菌. 将筛选的放线菌接种在高氏一号平板上4 d后,倒入含有一定量魔芋软腐病菌液的NA固体培养基. 双层平板制备好后,将其倒置于28 ℃恒温培养箱中培养48 h. 观察并标记出现抑菌圈的菌落,将其纯化后接种于高氏一号斜面培养基4 ℃保存备用.
-
本试验采用平板对峙法筛选对MY-30病原菌有拮抗作用的放线菌. 在距PDA平板中心30 mm的上、下、左、右4个位置,用灭菌枪头将待测放线菌点接在平板上,28 ℃恒温倒置培养4 d后,用猴头喷雾器将配成108 CFU/m L的MY-30菌悬液均匀地喷在平板上,以不接种放线菌的培养皿为对照. 28 ℃恒温培养箱倒置培养48 h,计算抑菌圈直径大小,每个处理3次重复.
-
将菌株F188划线接种在高氏1号、PDA、NA等6种培养基上,采用插片法28 ℃恒温培养,7~14 d后观察菌株的培养特征和颜色变化,并于光学显微镜下观察菌丝、孢子形态及孢子链的有无等.
-
以烟草灰霉病菌、烟草炭疽病菌、辣椒疫霉病菌、番茄早疫病菌、烟草拟盘多毛孢、茄子褐纹病菌、油菜菌核病病菌和毛霉8种病原菌为指示菌,采用平板对峙法,检测F188和F194菌株的抑菌活性及广谱性. 用打孔器取直径8 mm活化好的供试病原菌菌块置于PDA平板中央,四周接种拮抗菌菌株(已在高氏一号培养基中培养3 d),以不接种拮抗菌菌株为对照,每个处理重复3次,计算病菌抑制率.
-
种子液:取3个放线菌菌饼接种于100 mL装有适量液体高十一号培养基的锥形瓶中,28 ℃,200 r/min振荡培养3 d制成种子液.
发酵:在发酵基础培养基中以10%的接种量加入种子液,28 ℃,200 r/min振荡培养4 d后,获得发酵液,10 000 r/min离心10 min,经0.22 μm的滤膜过滤后得到发酵滤液.
-
选择白魔芋实生种子进行生防菌促生效果盆栽试验. 待实生种子完全展叶10 d后进行生防菌发酵液灌根(因魔芋实生种子植株较小,生长势较弱,选择生防菌发酵液5倍稀释液进行试验),隔7 d灌一次根,灌3次,每次50 mL,以浇灌50 mL清水为对照,每个处理15株. 第3次浇灌后,待植株生长30 d后进行测量,拔出魔芋幼苗时要保持植株的完整性,用水冲洗时应保护根部的完整性,去除黏着在根部周围的土壤. 用游标卡尺准确测量枝条、茎和根系的长度和宽度,称量植株的全鲜质量、主根数、叶面宽度.
-
取健康的魔芋球茎,清洗干净后将球茎切成大小约4 cm×4 cm×1 cm的切片,表面用75%的酒精消毒. 将放线菌发酵液用0.22 μm的滤膜过滤后制成发酵滤液,用无菌水稀释成各个试验浓度. 将消毒后的球茎切片放入装有不同稀释浓度发酵液和发酵滤液的烧杯中,分别浸泡5 min后取出晾干,用移液枪吸取108 cfu/mL的MY-30菌悬液20 μL接种到切片的中央,注意保湿,28 ℃恒温培养箱培养48 h后观察发病状况并记录. 采用SPSS 18.0软件对试验数据进行统计分析.
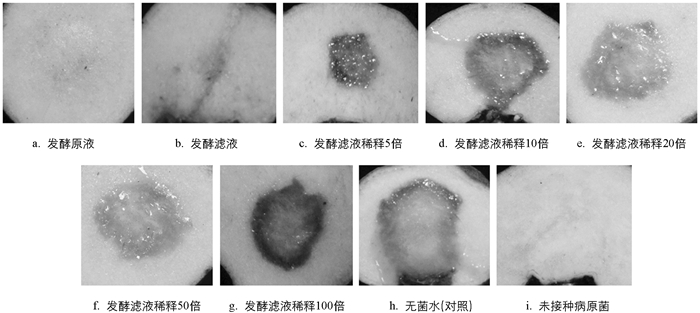
设置处理如下:A为发酵原液处理,B为发酵滤液处理,C为发酵滤液稀释5倍处理,D为发酵滤液稀释10倍处理,E为发酵滤液稀释20倍处理,F为发酵滤液稀释50倍处理,G为发酵滤液稀释100倍处理,H为无菌水处理(对照),I为未接种病原菌; 每个处理重复9块切片.
离体球茎病情分级标准参考崔双等[13]、张思梦等[14]的方法进行适当修改,建立0~5级共6个级别.
0级:无明显发病症状;
1级:病斑直径<10 mm;
2级:10 mm≤病斑直径<20 mm;
3级:20 mm≤病斑直径<30 mm;
4级:30 mm≤病斑直径<40 mm;
5级:病斑直径≥40 mm.
1.1. 供试材料与培养基
1.1.1. 样品收集
1.1.2. 供试菌株
1.1.3. 培养基
1.1.4. 主要设备与仪器
1.2. 病原菌的分离与鉴定
1.2.1. 病原菌的分离纯化
1.2.2. 科赫氏法则验证
1.2.3. 病原菌的鉴定
1.3. 拮抗放线菌的分离
1.4. 拮抗放线菌的筛选
1.4.1. 拮抗放线菌的初筛
1.4.2. 拮抗放线菌的复筛
1.5. 拮抗放线菌的培养特征与形态特征观察
1.6. 菌株F188抑菌谱测定
1.7. 放线菌发酵培养基及菌悬液的制备
1.8. 菌株F188对白魔芋植株的促生作用测定
1.9. 菌株F188对腐烂病菌的抑制活性及防效测定
1.9.1. 菌株F188拮抗软腐病菌感染离体球茎[13]防效
-
将所采集的魔芋软腐病组织进行平板划线分离培养、纯化,共获得106个细菌菌株,将所有的分离菌株活化制备新鲜菌悬液,接种魔芋离体块茎组织. 接种24 h后,有45个菌株可致使魔芋块茎发生软腐症状,组织呈黄褐色或褐色,黏稠糊状并散发臭味,与田间发病症状一致; 将接种后产生软腐症状的魔芋组织,再次进行平板划线培养,与原接菌株形态特征一致.
-
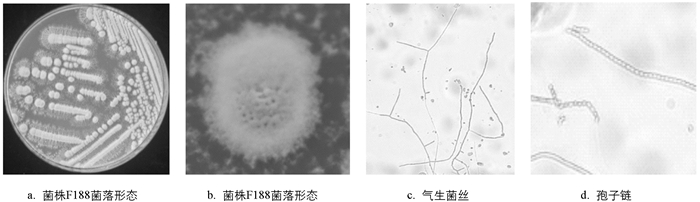
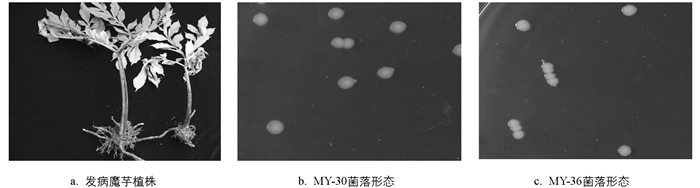
发病魔芋植株形态见图 1a. 45株致病菌株可分为两大类. 第一类:有24株菌株在NA固体培养基上培养48 h后,菌落呈乳白色、近圆形、表面光滑、边缘整齐、菌落中央稍隆起如MY-30(图 1b); 第二类:有21个菌株在NA固体培养基上,于28 ℃培养48 h后,菌落呈乳白色、边缘波状、菌落中央稍隆起如MY-36(图 1c).
-
采用16S r DNA通用引物27F/1 492 r对致病力最强的菌株MY-30进行PCR扩增,可得到片段大小为1 500 bp的扩增产物(图 2a),将产物测序结果提交到NCBI上进行BLAST比对,发现菌株MY-30的16S r DNA序列与已经报道的Pectobacterium carotovorum subsp. carotovorum strain Badong1(FJ906788.1)同源性最高(图 2b),达到95%以上.
-
初筛:用分离获得的305株放线菌对魔芋软腐病菌菌株MY-30进行抑菌试验测定,通过双层培养基法初步筛选得到有拮抗活性的菌株26株. 试验结果看出,其中菌株F15,F194对魔芋软腐病菌株MY-30的抑菌圈直径达到36.01 mm和35.19 mm,菌株F54,F65,F78,F81,F101,F109,F111,F188,F198,F255,F267,F291,NF2和NF5的抑菌圈直径在20 mm和30 mm之间(表 1).
复筛:对初筛得到的抑菌圈大于20 mm的16株放线菌进行复筛. 结果看出,菌株NF2,NF5,F65,F111,F188,F194对魔芋软腐病的抑菌圈直径均超过30 mm,抑菌圈透明度存在差异,其中菌株F188对魔芋软腐病的抑菌效果最好,其抑菌圈直径达到了57.09 mm,抑菌圈完全透明(表 2). 因此,选择菌株F188做后续试验.
-
菌株F188在6种培养基上均能生长,但培养7~14 d后表现出不同的培养特性. 菌株F188在高氏一号培养基上培养14 d后,菌落生长繁茂,可产生丰富的气生菌丝,呈辐射状,菌落颜色淡紫色,单菌落微微隆起成圆形,菌落边缘不规则,未见可溶性色素产生,光学显微镜下,气生菌丝直、柔曲,孢子链成线状(图 3). 在麦芽汁、小米、PDA和NA培养基上生长相对较弱(表 3).
-
试验结果看出,拮抗菌F188对8种供试病原菌均有一定的抑制活性,对不同病原菌的抑菌作用差异有统计学意义,表明菌株F188有广泛的抑菌谱,其中对烟草灰霉病菌、烟草炭疽病菌和油菜菌核病菌抑制作用较强,抑菌率在60%以上,对毛霉的抑菌作用较弱,抑菌率只有31.25 %(表 4).
-
试验结果看出,在盆栽试验中,由放线菌F188发酵液处理后的魔芋植株生长更加健壮,生长势更强,魔芋茎粗、总鲜质量、叶宽及主根数较对照均有所提高(p<0.05),且经菌悬液处理后,须根数较对照明显增多,促生效果最为显著,说明供试菌对魔芋植株具有促生作用(表 5).
-
试验结果表明,对照组离体球茎全部发病严重,出现黑褐色病斑,腐烂变软,有恶臭气味(图 4h); 而经放线菌F188发酵液和发酵滤液处理后球茎腐烂程度降低(图 4a~g). 发酵液和发酵滤液的相对防效达到60%以上,随着稀释倍数的增大,菌株F188发酵滤液对魔芋软腐病菌的抑制率逐渐减小,发酵滤液稀释10倍、20倍、50倍和100倍后对魔芋软腐病病菌的抑菌效果不明显,防效均低于20%(表 6). 表明菌株F188发酵液和发酵滤液均对魔芋软腐病有较好的防效,对魔芋软腐病病菌的抑制作用显著,可有效阻碍魔芋软腐病病斑扩大,且随着浓度增大,抑菌效果越佳.
2.1. 软腐病病原菌的分离纯化
2.2. 软腐病病原菌的鉴定
2.2.1. 形态学鉴定
2.2.2. 分子生物学鉴定
2.3. 拮抗放线菌的初筛与复筛
2.4. 拮抗放线菌的培养特征与形态特征观察
2.5. 菌株F188对不同病原菌的抑菌能力
2.6. 菌株F188的促生作用评价
2.7. 菌株F188拮抗软腐病菌感染离体球茎的效果
-
本研究从分离的魔芋软腐菌中,根据形态特征、分子生物学分析发现主要可分为两大类,筛选出致病力最强的菌株MY-30进行形态学和分子学鉴定,发现其与Pectobacterium carotovorum subsp同源性最近.
放线菌是广泛应用于植物病害防治的微生物之一,种类繁多,可以产生多种对植物病害具有抑制作用的抗生素和酶类. Liu等[15]发现贝莱斯芽孢杆菌(Bacillus velezensis LS69)对胡萝卜果胶杆菌(P. carotovorum)病原菌表现出较强的拮抗活性. 本研究通过双层培养基等方法筛选出对魔芋软腐菌有拮抗作用的菌株26株,其中F188拮抗活性最强,在高氏一号和燕麦培养基上生长最佳,对多种病原菌都具有较强的抑菌能力. 发酵液对白魔芋植株的生长势具有一定的促进作用,发酵液和发酵滤液对软腐病菌感染魔芋离体球茎的防效均达60%以上,表明发酵滤液中有抗生类物质产生,且发酵滤液在一定浓度范围内对魔芋软腐病菌的抑制效果随浓度降低而减弱,与已报道的多种放线菌类似,如毒三素链霉菌(Streptomyces toxytricini)[16]. 韩传玉[17]筛选的生防菌NEAU-U3抑菌谱广,对禾谷镰刀菌PH-1具有较强的拮抗作用,产生的主要活性代谢产物吡喃萘醌类化合物Frenolicin B,在大田中对赤霉病防效良好. 沈鹏飞[18]研究发现拮抗菌XCS1可产生嗜铁素等多种酶,产生的挥发性物质(volatile organic compounds,VOCs)对青枯菌具有显著的抑制效果. 因此拮抗菌株F188产生的对魔芋软腐病菌具有抑菌效果的具体物质,还有待进一步研究确认.
魔芋软腐病的防治主要依靠药剂处理,但是普通的药剂处理防治效果不够理想,且容易造成环境和土壤污染,赵小明等[19]用噻霉酮杀菌剂对安康魔芋种芋进行拌种处理,然后用壳寡糖等植物免疫诱导剂结合噻霉酮药剂在魔芋发病初期进行喷施,可达到较好的防治效果且对出苗具有促进作用. 何霜霜[20]将筛选出的生防菌株和促生菌株进行复配,制成可湿性粉剂,对马铃薯黄萎病的室内防治效果可达68.60%. 冯家畅[21]将筛选出不产毒黄曲霉菌的生防菌制成炭基双层固定化微球菌剂,通过竞争抑制作用,可显著降低花生中黄曲霉毒素造成的污染,在花生初花期增施大米菌剂,土壤中不产毒菌比例可提高至92.41%. 大田试验受土壤、温度、降水等影响,与室内试验存在着较大差异,本试验中筛选出的生防菌株是否能用于大田试验,是否可制成生防菌剂还有待考证. 防控软腐病的生防菌可以考虑多种菌株的协同作用,生物防治手段与其他防治手段的协同作用还需要进一步的探究.



 下载:
下载: