-
开放科学(资源服务)标志码(OSID):

-
苦荞又称鞑靼荞麦,生育期短,适应性广,抗逆性强,自花授粉率高,是很好的填闲补荒作物,社会效益显著[1]. 苦荞营养价值很高,富含蛋白质、维生素B和膳食纤维以及黄酮类生物活性成分,是一种潜在的“功能性食品”[2]. 苦荞独特的药食两用特性,使其具有重要的应用价值和开发潜力,市场需求不断扩大. 然而,由于苦荞的产量不稳,品种退化较严重、更新速度慢和品种间品质参差不齐等问题,严重阻碍了苦荞的生产及发展[3]. 苦荞属于小宗作物,基础研究开始较晚,遗传育种研究也相对滞后[4]. 因此,加快苦荞种质资源创新,挖掘与利用优良基因已经成为我国苦荞产业研究和发展的重点[5-9].
植物的自然突变频率很低,要想获得足够多有价值的突变材料,可通过人工诱变的方法来提高突变频率,创制筛选出更多、更有价值的突变体[10]. 突变体库主要的构建方法有插入诱变、物理诱变、化学诱变等. 化学诱变相较于其他诱变有着简单、经济、易突变、无需遗传转化的特点,已成为突变体库创建的一种重要技术手段[11]. 其中甲基磺酸乙酯(EMS)诱变因其诱变范围广、效率高、操作简便、成本低廉、产生的染色体畸变很少、对处理材料生物损伤小、主要发生DNA分子上的点突变(且大多是显性突变)、利于筛选工作的进行等优势而被认为是使用最广、效果最明显的诱变剂[12],已在玉米[13]、高粱[14]、黄瓜[15]、番茄[16]等植物上成功构建了EMS突变体库,获得了不同的新种质资源,大大加快了育种进程,并有助于新的等位基因鉴定和功能基因组学研究. 在苦荞育种研究方面,利用化学方法对苦荞的诱变研究陆续有相关报道出现. 温日宇等[17]研究了不同浓度EMS对晋荞麦4号种子发芽的影响,认为其EMS诱变的半致死百分比为1.7%,处理时间为12 h. 邓琳琼等[18]利用EMS对贵州地方栽培苦荞品种进行处理,对其突变体进行筛选和鉴定,获得了叶片肥大、早熟、晚熟、小粒、矮秆和黄化6种稳定遗传的突变体. 马名川等[19]利用EMS对苦荞地方资源材料刺荞进行处理,对其M2代突变体进行筛选和鉴定,获得了抗倒、矮秆、籽粒多棱、大粒等突变体,初步创建了刺荞突变体库. 孙朝霞等[20]利用EMS诱变苦荞品种“黑丰1号”,获得了矮杆、种壳开裂、丛生枝等突变株系,并筛选出高低芦丁突变体株系,对芦丁合成关键酶基因进行了表达分析.
目标起始密码子多态性(SCoT)分子标记是2009年由Collard等[21]新开发的一种基于翻译起始位点而设计的新型单引物扩增反应目的基因分子标记. 有研究表明,SCoT分子标记可以根据植物的性状突变进行初步鉴定. 岳庆春等[22]利用SCoT分子标记技术对经137Cs-γ射线处理“醉金香”葡萄种子得到的变异单株进行遗传变异及多样性分析,实现了葡萄变异材料的早期鉴定;王俏君等[23]对经形态学观察筛选到的彩叶芋表型突变体进行SCoT分子标记分析检测,发现在DNA分子水平上发生了变异的4株表型突变体;白邦琴等[24]将3种草坪草作为试验材料进行EMS诱变后,对诱变M2代植株进行了SCoT分子标记分析,在SCoT-PCR扩增结果电泳条带中出现了较丰富的多态性条带,表明筛选的突变体发生了分子水平的遗传变异.
本研究利用EMS诱变剂对苦荞测序品种“品苦1号”进行浸种诱变处理,创建一个表型变异丰富的苦荞突变体库,并对M2进行形态学和SCoT分子标记的筛选和鉴定,以期丰富苦荞基因资源,加快苦荞遗传育种进程,并为苦荞品种选育及功能基因组学的研究提供优良的基础材料.
全文HTML
-
试验所用材料为已完成测序的苦荞品种“品苦1号”[25],由山西省农业科学院作物研究所提供.
-
选取籽粒饱满均匀的“品苦1号”种子2 400粒,每200粒种子为一组,设0,0.2%,0.6%,1.0%,共4个百分比梯度处理,每个处理3次重复. 将种子清水浸种12 h后,用pH=7.0的磷酸缓冲液作为溶剂,配制百分比为0(磷酸钠缓冲液作为对照),0.2%,0.6%,1.0%的EMS诱变液(上海麦克林生化有限公司)处理“品苦1号”苦荞种子,并置于摇床上在通风橱中避光处理12 h,然后以浓度为0.1 mol/L的硫代硫酸钠为终止剂,终止诱变反应,然后用流水持续冲1 h. 吸干水分晾干后,于田间进行种植. 每个百分比处理种植1个小区(行长2 m,行距0.33 m),设3次重复,播种后记录各小区播种量(S),并对田间出苗和成苗情况进行调查统计. 于苦荞的2叶期,调查出苗数(E),计算各小区出苗率(X):X=E/S×100%. 于苦荞的4叶期,调查成苗数(F),计算各小区成苗率(Y):Y=F/S×100%.
-
选取饱满均匀的“品苦1号”种子4 000粒,先在清水中浸种12 h,然后用筛选出的适宜百分比的EMS溶液对浸泡好的4 000粒种子进行诱变处理,以未处理的“品苦1号”为对照,于2019年3月将其播种在西南大学科研基地实验田,每个小区(行长2 m,行距0.33 m)种200粒籽粒,对M1代植株做好田间管理,进行田间突变体及农艺性状的调查统计,成熟后按单株收获籽粒. 于2019年9月种成M2代株行(每株行种10粒籽粒),并对定植的M2代单株进行田间突变体及农艺性状调查统计,成熟后将定植的M2代植株按单株收获,其余单株按株行收获作为株系对照. 诱变材料各世代田间管理均采用常规育种方式.
-
突变体统计:对M2代植株全生育期调查,每3~5 d进行1次田间调查,根据《荞麦种质资源描述规范和数据标准》,观察记载植株的叶片、茎秆、株高、分枝、株型、籽粒、育性、生育期等表型性状,筛选出各种表型突变体. 在形态学调查过程中筛选出各种表型性状变异材料,同时分类记录各种表型变异性状,对变异性状进行拍照留存,并进行单株编号. 于成熟期,收获种子前测量株高(cm):用直尺测量从地面至主茎花序顶端的距离;一级分枝数(个):主茎上从基部至顶端的有效分枝数;主茎节数(个):主茎基部至顶端的总节数. 籽粒成熟单株脱粒收获后,将籽粒置于37 ℃烘箱烘干,并去除空瘪籽粒,采用万深SC-G型种子数粒仪及千分之一天平测量单株粒数(粒)、单株粒质量(g)、千粒质量(g)、籽粒面积(mm2)、籽粒周长(mm)、籽粒长(mm)、籽粒宽(mm)及籽粒长宽比. 最后,取3个单株的性状平均值作为该品种的表型值.
-
待M2代幼苗正常生长后,分别采集每株定植植株0.1 g新鲜叶片于离心管,经液氮速冻后,放入磁力打样机(LC-DMS-H型)(30 s,50 Hz)粉碎至粉末. 参照改良后的CTAB法提取苦荞种质资源的DNA[26],采用1.0%琼脂糖凝胶电泳进行质量检测,并利用Nano Drop 2000仪器检测样本的DNA质量浓度,用已灭菌的ddH2O将DNA稀释到50 ng/μL,-20 ℃低温保存待用.
-
参考Collard等[21]的方法设计并合成了36条SCoT引物,以野生型“品苦1号”DNA为模板,对36条引物进行筛选,其中26条引物可扩展出稳定性好,可重复的清晰条带(表 1).
PCR总反应体系为20 μL,其中苦荞基因组DNA 1.0 μL,引物各1.0 μL,buffer 1.0 μL,2×Taq PCR Master Mix 10 μL,ddH2O 6 μL. 2×Taq PCR Master Mix购自诺唯赞生物科技有限公司. SCoT-PCR初始基本扩增程序为:先94 ℃下预变性4 min,然后进行94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸90 s,35个循环程序,最后在72 ℃下进行7 min延伸. PCR扩增产物经2.0%琼脂糖凝胶电泳分离,于凝胶成像系统拍照保存,并根据电泳图像读取条带数据,分析诱变材料与野生型之间的差异.
-
利用Excel 2016统计各突变类型的突变数目及突变率,计算苦荞植株和籽粒各主要农艺性的平均值、最小值、最大值、极差、标准差,进而计算各农艺性状的变异系数、遗传多样性指数,同时绘制相应图表. 利用SPSS 24软件对诱变M2代的各主要农艺性状进行相关性分析、主成分分析、聚类分析,并利用DPS软件处理体系优化正交实验的方差分析及多重比较.
电泳结果采用0/1赋值,强带记1,弱带反复出现记1,弱带出现但不重复记0,无带记0,建立引物扩增的“0/1”分子数据矩阵,利用Power Marker软件[27]计算遗传距离,并利用MEGA 7.0软件[28]进行UPGMA聚类分析,利用Fig Tree软件对聚类图进行美化编辑.
1.1. 试验材料
1.2. 苦荞EMS诱变百分比的筛选
1.3. M2突变体库的构建
1.4. 田间突变体性状调查
1.5. 基因组DNA的提取
1.6. SCoT分子标记分析
1.7. 数据分析
-
本研究将0,0.2%,0.6%,1.0%共4种EMS百分比梯度处理后的种子于田间播种,播种后于2叶期统计出苗率及相对出苗率,于4叶期统计成苗率及相对成苗率(表 2). 研究发现,经EMS处理的苦荞品种“品苦1号”种子的田间出苗率和成苗率均随着EMS百分比的增加而逐渐下降. 其中0.6% EMS处理的“品苦1号”种子,与对照相比其相对出苗率为51.92%,相对成苗率为46.19%. 在EMS诱变的研究中,一般以半致死剂量LD50作为EMS诱变处理的适宜百分比标准,半致死剂量即相对出苗率为50%时的EMS剂量,此时诱变处理产生的材料,其单碱基突变的频率最高. 经综合分析后,本研究最终选定0.6% EMS为适宜“品苦1号”批量诱变的诱变剂量.
-
田间播种经0.6% EMS处理12 h的“品苦1号”苦荞种子4 000粒,2叶期出苗数为1 076株,出苗率为26.90%;4叶期成苗数为991株,成苗率为24.78%;同年5月底收获M1代植株971株. M1自交后单株收获M2代965份材料. 对野生型“品苦1号”和965个M2代株行进行突变调查(图 1),结果表明苦荞品种“品苦1号”经过EMS诱变后,在M2代观察到了丰富的表型变异突变体,且在所调查的叶片性状、茎秆性状、籽粒性状及生育期等表型性状中均发现了突变位点. 其中,部分植株表现出两种或两种以上表型性状的复合突变. 共计发现486个突变位点在M2代272个单株上(366个突变植株中,复合突变植株仅计数1次),M2代表型突变频率为28.19%. 各类型突变率为叶片8.60%,茎秆11.50%,籽粒14.20%,其他类型为4.56%(表 3).
-
本研究对“品苦1号”苦荞诱变M2代材料和野生型对照的主要农艺性状进行了调查测量及统计分析(表 4). 11个主要农艺性状的变异系数变化范围介于4.12%~53.88%之间,遗传多样性指数在1.46~2.02之间,平均值为1.87,各性状的遗传多样性指数从大到小依次为单株粒质量(单株粒数)、株高(籽粒周长)、籽粒面积、籽粒长、千粒质量、籽粒宽、籽粒长/宽、主茎节数、一级分枝数,表明“品苦1号”诱变M2代苦荞材料各主要农艺性状之间存在较大的差异,产生了较丰富的性状变异.
将诱变M2代材料的11个主要农艺性状进行主成分分析,结果表明所有主成分构成中特征值大于1的有4个主成分(表 5). 其中,第1主成分的的特征值为3.433,贡献率为31.209%;第2主成分的特征值为3.109,贡献率为28.262%;第3主成分的特征值为1.935,贡献率为17.587%;第4主成分的特征值为1.027,贡献率为9.333%;前4个主成分累积贡献率达86.391%. 根据累积贡献率大于(等于)85.00%的标准,表明本研究提取的4个主成分基本可以反映诱变M2代的11个主要农艺性状的因子信息,可以很好地解释表型的变异.
-
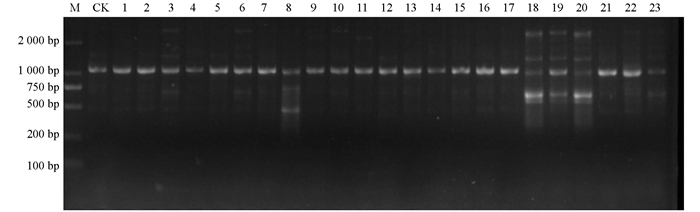
利用26条SCoT引物对“品苦1号”诱变M2代群体进行PCR扩增,共得到263条清晰稳定的条带,各SCoT引物扩增出的条带在4~16条之间,平均为每条引物扩增出10.12条电泳条带. 对比野生型“品苦1号”和诱变M2代材料SCoT-PCR产物的电泳条带,发现诱变M2代与野生型之间存在较丰富的条带差异,包括条带增加和条带缺失,这些条带差异证明EMS诱变方法导致苦荞在DNA分子水平上发生了变异(图 2).
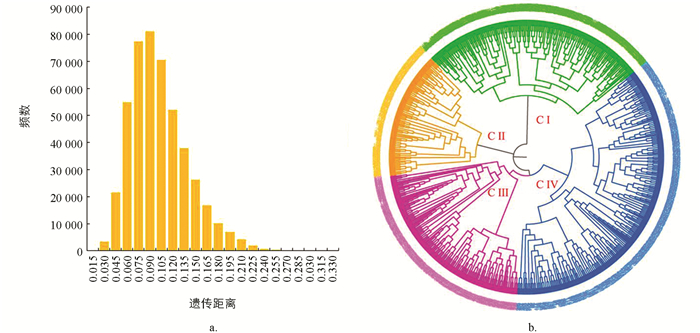
基于SCoT分子标记电泳条带数据,将对照的野生型“品苦1号”在内的966份材料两两组合进行分析,共得到466 095个遗传距离,分布在0.003 8~0.324 5之间,平均值为0.093 5,其中PKM2-148和PKM2-566间的遗传距离最大,为0.324 5;CK和PKM2-097间的遗传距离最小,为0.003 8. 以0.015为组间距进行频数分布分析,96.23%的遗传距离分布在0.045~0.180之间(图 3a). 965个诱变材料与对照材料“品苦1号”间的遗传距离平均为0.056 2. 其中CK和PKM2-803间的遗传距离最大,为0.203 8;CK和PKM2-097间的遗传距离最小,为0.003 8.
根据SCoT分子标记数据,利用非加权组平均法(UPGMA)构建聚类图(图 3b),结果966个材料被分为4类(CI-CIV). 对4个类群的农艺性状进行统计分析(表 6)发现:CI由256个材料组成,包括对照在内的256个材料间的遗传距离在0.003 8~0.271 7之间,平均遗传距离为0.066 9,显著小于其他类群,植株与籽粒的主要农艺性状均适中. CII由145个材料组成,145个材料间的遗传距离在0.015 1~0.230 2之间,平均遗传距离为0.088 7,主要农艺性状中株高偏低、单株产量较高,千粒质量偏小、籽粒偏大偏长. CIII由210个材料组成,210个突变材料的遗传距离在0.007 5~0.249 1之间,平均遗传距离为0.106 7,显著大于其他类群,主要农艺性状中主茎节数和分枝较少、单株产量低. CⅣ由355个突变材料组成,355个突变材料间的遗传距离在0.007 5~0.222 6之间,平均遗传距离为0.094 2,主要农艺性状中株高偏高,主茎节数偏多,千粒质量偏大,籽粒较小.
2.1. EMS诱变百分比的筛选
2.2. M2代植株表型性状变异分析
2.3. M2代主要农艺性状的遗传多样性分析
2.4. M2代的SCoT分子标记分析
-
EMS诱变结果具有不确定性,诱变对象不同,EMS的诱变效率也不同,而且前人研究结果表明,最佳EMS处理条件通常是接近半致死剂量的处理条件,原因是半致死剂量下的突变效率较高,获得的突变体较多,待选群体基数适中[24]. 影响EMS诱变效果的主要因素是EMS百分比和诱变处理时间长短[29]. 温日宇等[17]对苦荞种子EMS诱变效应的研究结果表明,不同诱变时间的处理结果差异不显著,且处理8 h以上才会对种子发芽率产生明显的影响,苦荞EMS诱变的半致死百分比为1.7%. 孙朝霞等[20]的研究结果显示,“黑丰1号”苦荞种子的EMS诱变半致死剂量为1.2%. 本研究对测序品种“品苦1号”采用0,0.2%,0.6%,1.0%共4种EMS诱变百分比对苦荞种子进行浸种诱变处理12 h,最终选定0.6% EMS诱变百分比为最适宜的诱变剂量. 本研究结果与前人研究最适诱变剂量的结论存在差异,可能是不同品种对诱变剂的敏感程度不同,亦有可能是处理后环境条件(播种地土壤、大气温度和湿度等)差异所致.
-
诱变M2群体是突变体表型调查最为关键的时期[30]. 本研究通过对966个M2代单株进行田间突变表型调查发现,苦荞品种“品苦1号”经过EMS诱变的M2代产生了丰富的表型变异突变体,共发现486个突变位点在M2代272个单株上,M2代表型突变频率为28.19%. 在所调查的M2代叶片性状、茎秆性状、株型及生育期等表型中均发现了突变,比马名川等[19]、孙朝霞等[20]在EMS诱变苦荞研究中的突变率要高,可能原因在于:与其他研究相比,本研究采用的苦荞品种不同,不同品种的材料对EMS的适应程度不同,因此可能造成的突变率不同;EMS诱变百分比及诱变剂品牌不同,产生的诱变效率会有所差异;植株生长环境不同也会导致田间表型调查的突变率不同. 本研究对突变群体田间表型调查采取的是单株逐一调查的方式,单株收获籽粒后进行了单株烤种,对籽粒表型进行了细致的鉴定,初步筛选的突变数量较多,因此突变比例也相对较高,但是在突变的稳定性上实验室后续还会进一步地筛选和鉴定.
统计发现,在M2代苦荞突变体库中产生最多的突变性状包括黄化叶片、矮化植株、紧凑株型、籽粒表型等,此外还有一些突变单株存在多个变异性状一起出现的现象,如矮化的植株节间短,株型紧凑的植株分枝多,丛生植株籽粒会比较早熟等等,这些现象的出现应证了前人提出的EMS诱变会导致基因点突变率增加,且突变的基因之间可能会存在连锁表达效应的说法[31-32].
-
遗传多样性指数是反映性状遗传多样性的一个重要指标,遗传多样性指数越高,表明农艺性状的多样性越丰富. 近年来,已有文献报道了较多苦荞株高、分枝数、节数、单株产量、籽粒表型等主要农艺性状的遗传变异研究[33-35]. 而本研究的M2代突变体主要农艺性状遗传多样性指数在1.46~2.02之间,平均值为1.87,其中最高的是单株粒质量和单株粒数,说明经EMS诱变后的M2代群体间主要农艺性状的多样性变异丰富,包含的变异类型多,具有很高的研究价值.
聚类分析已广泛应用于苦荞的遗传多样性分析,吕丹等[36]基于农艺性状对苦荞资源材料进行聚类分析,将213个苦荞种质资源分为6类,其中的高产类群可以作为苦荞品种选育的亲本材料. 本研究基于11个主要农艺性状进行聚类,将诱变M2代材料分为4大类群,方便对优良性状进行筛选和鉴定,为苦荞育种工作提供丰富的基础材料,加快育种进程.
-
SCoT分子标记与传统DNA分子标记相比具有灵敏度高、稳定性好、引物设计简单、通用性强;DNA用量少且质量要求低、操作简单、成本低廉、遗传信息丰富、条带的多态性高等优点[37]. 本研究以诱变M2代与野生型“品苦1号”为PCR扩增的DNA模板,进行SCoT-PCR扩增,发现诱变M2代与野生型之间存在条带差异,包括条带增加和条带缺失,这些条带差异证明EMS诱变方法导致苦荞在DNA分子水平上发生了变异,与王俏君[23]的研究结论相似,但各突变株变异位点的碱基序列信息、突变性状能否稳定遗传等问题还需后续进一步地研究.
将基于M2代农艺性状的聚类结果与基于M2代SCoT分子标记的聚类结果进行对比分析,发现诱变苦荞品种“品苦1号”的诱变M2代在两种不同方式下的聚类结果有所不同,虽然两种方式都聚成了4个类群,但每个类群在综合农艺性状变现过程中有所不同,且每个类群的材料分布也不尽相同. 两种聚类方式结果有所差异的现象也出现在其他许多植物的研究中[38-40],造成这些差异的主要原因是农艺性状聚类的作用是揭示植株表型性状的差异,而基于SCoT分子标记的聚类结果揭示的主要是M2代材料在DNA分子水平上的差异. 同时,两种聚类方式无论是性状测量,还是电泳条带读取在数据统计时都存在统计人员主观因素及仪器设备误差的影响. 因此,将农艺性状分析与分子标记分析结果相结合,在突变体研究工作中可以根据既定目标进行综合筛选和分析,有利于提高突变体鉴定和筛选的效率和准确性,同时也说明将分子标记技术与常规育种手段有机地结合起来,能有效缩短育种年限,加快作物育种进程.
3.1. EMS诱变百分比的筛选
3.2. EMS突变体库的构建
3.3. M2代主要农艺性状的遗传多样性分析
3.4. M2代的SCoT分子标记分析
-
EMS诱变百分比梯度试验结果表明“品苦1号”在重庆最适宜的EMS诱变百分比为0.6%;M2代966个株系产生了丰富的表型变异突变体;主成分分析得到包括籽粒大小因子、籽粒形状因子、植株产量因子、植株表型因子的4大主成分因子;基于SCoT分子标记的UPGMA聚类分析将966个材料分为4大类,SCoT-PCR扩增结果表明EMS诱变导致苦荞在DNA分子水平上发生了变异. 该突变体库的构建及初步筛选分析,将为苦荞功能基因组学研究和分子育种提供表型多样的种质资源.




 下载:
下载: