-
开放科学(资源服务)标志码(OSID):

-
铝是地壳中最丰富的金属元素之一,主要以硅酸盐或氧化沉淀物的形式存在,在中性或中等酸性土壤中没有生物活性[1-2],但当土壤pH值小于5.0时,便会从这些黏土矿物中解离出具有植物毒性的Al3+[3]. 目前,世界范围内约有40%的可耕地是酸性土壤[4];在中国,长江以南的大部分耕地土壤呈酸性或强酸性,此外不当的农业措施(施肥)和环境问题(酸雨),导致耕地土壤pH迅速下降[5]. 酸性土壤中铝的毒性已经成为限制全球作物产量的一个主要因素[6-7].
光合作用是植物获取物质和能量的基础,约95%的植物干物质直接来自光合作用[8]. 不同的环境胁迫会导致光合色素的质量分数下降[9],色素的破坏或其生物合成的受阻都可能导致电子传输受到影响[10],从而导致植物的光合能力下降. 目前,铝诱导的叶绿素质量分数下降现象在柑橘、大豆、水稻、大麦等作物中被发现[11-14],而铝诱导二氧化碳同化效率的降低在水稻[15]、玉米[16]、黑麦[17]、柑橘[18]、可可[19]等作物中有广泛的报道. Al3+可以引起叶绿素a荧光的变化[18],并导致PSII光合电子传输的抑制和PSII反应中心的关闭[20]. 有研究表明,铝胁迫抑制大豆及烟草的PSII光能转化效率、实际光化学效率[21-22],使柑橘和菠菜的PSII潜在活力下降[23-25]以及限制芥菜型油菜的电子传递速率[26].
光合能力还受到碳同化过程中很多关键酶的限制[27]. 核糖-1,5-二磷酸羧化酶(Rubisco),甘油醛磷酸-3-磷酸脱氢酶(GAPDH)和核糖-5-磷酸激酶(PRK)是碳同化过程中的重要酶,可控制二氧化碳固定、电子转运和1,5-二磷酸核酮糖(RuBP)再生等关键代谢过程[28]. 在非生物胁迫下,烟草中的Rubisco活化酶(RCA)活性的降低可影响Rubisco活性,最终抑制光合作用[29-30]. 碳同化利用ATP和NADPH将大气中的CO2合成非结构性碳水化合物(淀粉和蔗糖等)[31]. 非结构性碳水化合物可以反映碳同化(光合作用)和碳需求(生长和呼吸等)之间的平衡[32]. 非结构性碳水化合物的增加,往往反映其利用率下降,导致生物量减少[29],与干物质的积累呈显著负相关[33].
油菜是世界上主要的油料作物之一,中国是目前世界上第二大油菜生产国,2019年油菜籽产量约为全球总产量的1/5. 中国油菜大多种植于长江以南地区,该油菜种植区受严重的酸铝威胁[34],因此,铝胁迫是油菜籽产区普遍存在的严重问题. 前人研究主要集中在铝毒对植物根系生长的影响[35-36],植物的有机酸分泌耐铝毒机制[18, 37-38],铝胁迫下植物的氧化应激[39-41]以及铝胁迫对植物光合气体交换的影响等方面[17-18, 23],而对铝胁迫下甘蓝型油菜光化学性能、光能分配及碳同化关键酶等的系统研究较少. 本研究选用2个遗传来源差异较大的甘蓝型油菜品种,通过不同浓度铝胁迫后,测定其叶绿素质量分数、叶绿素荧光参数、光合参数、碳同化关键酶活性及非结构性碳水化合物质量分数,探讨甘蓝型油菜幼苗在铝胁迫下光合特性的变化,揭示铝胁迫下光化学反应与油菜幼苗CO2同化的相互关系.
全文HTML
-
供试材料为遗传差异较大的2个甘蓝型油菜品种(系)ZS11和10D130,其中,ZS11为中国农科院油料作物研究所选育的优质常规品种,10D130是重庆市油菜工程技术研究中心选育、由羽衣甘蓝和芥菜型油菜种间杂交而得的衍生品系. 实验材料均由重庆市油菜工程技术研究中心提供.
-
实验于2019年10月初至2020年1月初在重庆市北碚区西南大学现代农业人工气候室中进行(29°30′41"N,106°18′14"E). 分别选取大小均匀、圆润饱满的油菜种子,先用75%乙醇对种子消毒30 s,然后用蒸馏水清洗,以滤纸吸干种子表面水分,再将种子分别播种至装有蛭石的营养钵中进行萌发,每个营养钵内播种5粒种子并浇透水. 每个品种总共播种18个营养钵,放入装有1/2霍格兰营养液的托盘内保持蛭石湿润并促进种子萌发. 每隔4 d更换1次营养液. 幼苗在2叶1心时进行间苗,每个营养钵内留下2株长势相近的幼苗. 待幼苗生长至第4片真叶长出时开始用处理液进行铝胁迫处理,处理液分别为添加有0,800,1 600,2 400,3 200和4 000 μmol/L AlCl3·6H2O的1/2霍格兰营养液. 每处理3个重复,每隔4 d更换1次相同的处理液,处理第15 d时进行相应指标的测定.
-
叶绿素质量分数测定采用丙酮乙醇法进行:选取第3片真叶,避开主脉剪取0.2 g碎叶,放入带刻度加塞试管中,加入10 mL丙酮无水乙醇混合液(丙酮与无水乙醇比例为1∶1). 试管移至暗处保存,48 h后待样品呈白色时,用光栅型多功能酶标仪(Tecan,Inc.,Swiss)在波长663 nm和645 nm下测定提取液的吸光度,每个处理测定3个重复. 根据Arnon公式[42]计算叶绿素a(Chl a,用SChl a表示),叶绿素b(Chl b,用SChl b表示)及总叶绿素(Chl,用SChl表示)的质量分数.
式中,A663代表在波长663 nm时的吸光度,A645代表在波长645 nm时的吸光度,V代表体积,W代表质量.
-
幼苗植株经过20 min暗处理后,采用植物表型成像分析系统(PSI,Inc.,Czech Republic)测量其初始荧光产量F0,最大荧光产量Fm,光适应下初始荧光产量F0′,光适应下最大荧光产量Fm′,稳态荧光产量Fs,最大光化学量子产量(Fv/Fm),PSII实际光化学效率(ΦPSII),PSII效率系数(Fq′/Fv′),光合作用活力指数(Rfd),PSII有效光化学量子效率(Fv′/Fm′). 每个处理测量3个重复.
根据Wang等[43]方法计算PSII潜在活性(Fv/F0):
光合机构吸收光能被用于光化学反应的相对份额(P):
用于热耗散的相对份额(D):
用于反应中心的过剩激发能的份额(Ex)[44]:
PSI激发能分配系数(α):
式中,f为常数,代表PSII反应中心的开放程度.
PSII激发能分配系数(β)[45]:
-
利用LI-6400XT便携式光合系统(LI-COR,Inc.,USA)在晴天上午9时至12时测定第4片真叶的净光合速率(Pn),气孔导度(Gs),胞间二氧化碳浓度(Ci)和蒸腾速率(Tr). 二氧化碳浓度设定为400 μmol/mol,饱和光强设定为1 200 μmol/(m2·s). 每个处理均设置3个重复.
-
在每个处理中随机选取生长比较一致的3株油菜,在第3片真叶位避开主脉剪取0.2 g叶片放入研钵中,加入液氮研磨成粉末后,转移至EP管中,加入2 mL PBS溶液(pH值为7.4)进行提取. 随后进行20 min离心(3 000 r/min),收集1 mL上清液加入EP管中用于测定碳同化关键酶活性. 采用酶联免疫法(ELISA)[46]测定核糖-1,5-二磷酸羧化酶(Rubisco),甘油醛磷酸-3-磷酸脱氢酶(GAPDH)和核糖-5-磷酸激酶(PRK)活性. 以同样的方法称取0.2 g叶片,参考前人方法[47-48]分别测量淀粉及可溶性糖质量分数. 每个处理设置3个重复.
-
采用DPS V9.50进行单因素方差分析和显著性比较(LSD法),显著性水平为p<0.05;采用SPSS 22.0进行相关性分析;采用Excel 2013进行制表及作图.
1.1. 实验材料
1.2. 实验设计
1.3. 光合性能指标的测定及方法
1.3.1. 叶绿素质量分数
1.3.2. 叶绿素荧光参数
1.4. 碳同化相关指标测定及方法
1.4.1. 叶片光合气体交换参数
1.4.2. 碳同化关键酶活性及非结构性碳水化合物质量分数测定
1.5. 数据分析
-
2个品种叶绿素a(Chl a),叶绿素b(Chl b)及总叶绿素(Chl)的质量分数均随铝胁迫浓度上升呈先升后降的趋势(表 1).
对照(CK)时的2个品种Chl a,Chl b,Chl质量分数相近. 低浓度(800 μmol/L)铝处理下ZS11的Chl a,Chl b,Chl质量分数分别比对照增加56.0%,190.2%和84.3%. 中浓度(2 400 μmol/L)铝处理下10D130的Chl a,Chl b,Chl质量分数分别比对照增加31.4%,124.3%和51.1%. 高浓度(4 000 μmol/L)铝处理下ZS11的Chl a,Chl b与Chl质量分数与对照相比下降27.5%,28.0%和27.7%;10D130的Chl a,Chl b及Chl的质量分数与对照相比下降40.0%,47.2%和41.6%. 这说明低浓度铝对ZS11的叶绿素质量分数有更强的促进作用,高浓度铝对ZS11叶绿素质量分数抑制作用相对较弱,ZS11较10D130有更好的耐铝性.
-
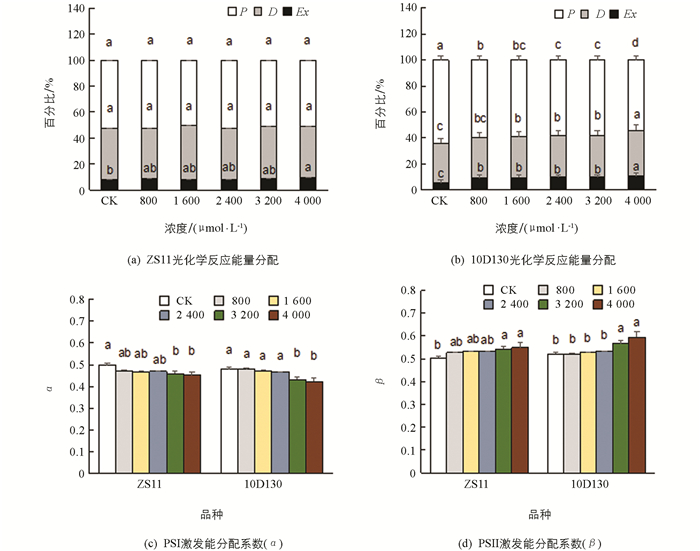
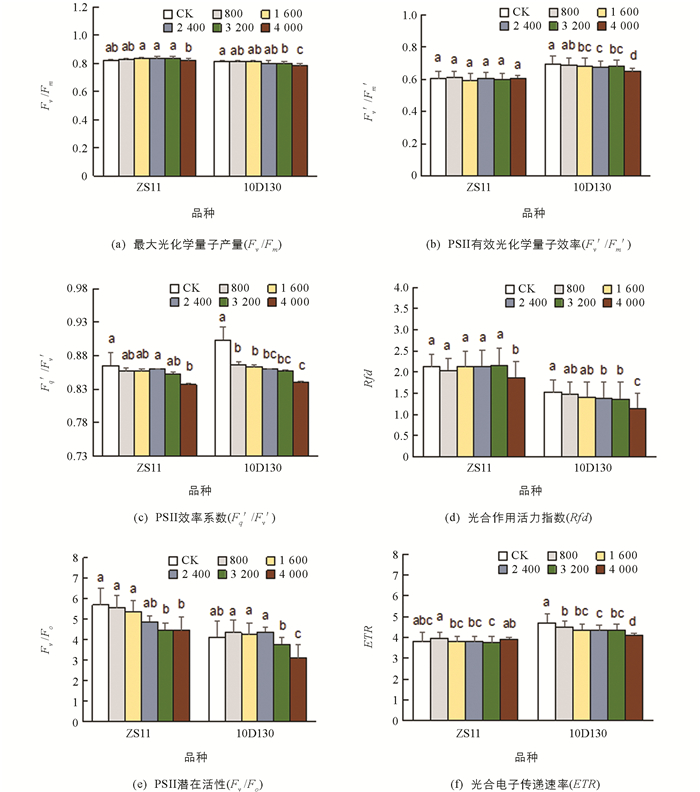
如图 1,Fv/Fm为最大光化学量子产量,Fq′/Fv′为PSII效率系数,Rfd为光合作用活力指数,Fv/F0为PSII潜在活性,分别反映了PSII反应中心的电子捕获能力、开放程度、叶片潜在的光合作用量子转化效率和PSII中电子传递的效率和光合作用的量子转化率[44]. 2个品种的Fv/Fm,Fq′/Fv′,Rfd,Fv/F0大致随着铝胁迫浓度的上升而下降,并在最高胁迫浓度下(4 000 μmol/L)达到最小值,表明2个品种的PSII效率下降,PSII反应中心的开放程度降低,叶片光合作用活力受抑制且光合释氧配合物(OEC)的完整性下降,影响光合作用的电子传递. Fv′/Fm′为PSII有效光化学量子效率,ETR为光合电子传递速率,10D130的Fv′/Fm′和ETR随铝胁迫浓度的增加而下降,并在最高胁迫浓度下达到最低值,表明其开放的PSII反应中心原初光能捕获效率降低并且电子传递速率下降.
从光合荧光参数总体结果分析,在同一胁迫浓度处理下,ZS11大多参数降低的幅度较10D130降低的幅度要小. 就高浓度胁迫(4 000 μmol/L)下各指标变化幅度来看,ZS11的Fv′/Fm′和ETR变化与对照差异无统计学意义,说明铝胁迫对ZS11品种的PSII有效光化学量子效率及电子传递速率影响较10D130小.
-
光合作用中,植物叶片吸收的光能有3条去路:一是用于光化学反应(P),二是在天线色素上进行热耗散(D),三是反应中心的过剩激发能(Ex). 图 2a显示,用于光化学反应的光能(P)在ZS11中各处理与对照间差异无统计学意义;而在10D130中,铝胁迫后均较对照显著下降,表明光合器官吸收的光能分配用于光化学反应的份额降低(图 2b). 就热耗散(D)来看,ZS11的热耗散(D)大多与对照差异无统计学意义;而10D130的热耗散(D)随着铝胁迫浓度的增加而升高,说明10D130对铝表现得更敏感,能更快地启动光保护热耗散机制. 此外,2个品种的过剩激发能(Ex)均随着铝胁迫浓度的增加而升高,说明铝胁迫导致2个品种的过剩光能增加,对光合器官造成损伤.
α和β分别表示2个品种PSI和PSII激发能的分配系数. 图 2c和2d显示,在高浓度铝处理下(3 200,4 000 μmol/L),2个品种PSI激发能分配系数(α)分别较对照显著降低8.0%~9.1%(ZS11)和9.7%~11.5%(10D130);而PSII激发能分配系数(β)分别较对照显著增加7.8%~9.0%(ZS11)和8.8%~14.0%(10D130),说明高浓度铝导致两个光系统之间的激发能分配严重偏离平衡,造成了PSII的伤害.
-
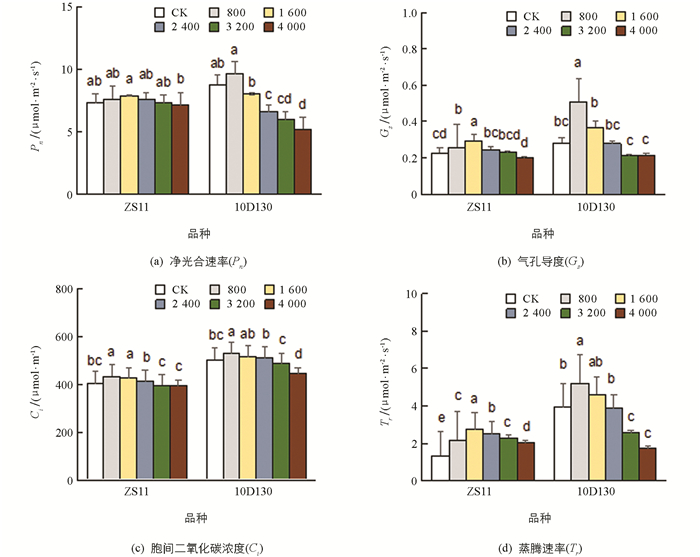
由图 3可知,ZS11和10D130的净光合速率(Pn),气孔导度(Gs),胞间二氧化碳浓度(Ci)和蒸腾速率(Tr)随着铝胁迫浓度增加均表现出先增加后又降低的趋势. 10D130的Pn,Gs和Tr在800 μmol/L处理时达到最大,分别比对照增加9.6%,80.7%和32.6%;在4 000 μmol/L处理时达到最小,分别比对照减少40.7%,23.5%和55.8%. ZS11的Pn,Gs和Tr在1 600 μmol/L处理时达到最大,其中Gs和Tr分别比对照显著增加30.3%和104.3%. 2个品种的Ci变化趋势与各自的Pn相似. 在低浓度(800 μmol/L)处理下,其Ci与对照相比显著增加7.2%(ZS11)和5.1%(10D130),在高浓度(4 000 μmol/L)处理下与对照相比下降,分别为9.0%(ZS11)和11.8%(10D130).
-
核糖-1,5-二磷酸羧化酶(Rubisco),甘油醛磷酸-3-磷酸脱氢酶(GAPDH)和核糖-5-磷酸激酶(PRK)是卡尔文循环中的重要酶,分别控制二氧化碳固定与还原和RuBP再生等关键代谢过程. 表 2中,2个品种的Rubisco活性均在800 μmol/L处理下较对照有显著下降,然后随着处理浓度的增加表现为先升后降的趋势,至胁迫浓度为4 000 μmol/L时,分别较对照显著降低39.9%(ZS11)和77.7%(10D130). 10D130的GAPDH和PRK活性在铝胁迫下呈先升后降的趋势,其中GAPDH活性在1 600 μmol/L处理下达到最大值,在4 000 μmol/L时较对照显著降低21.8%. 10D130的PRK活性在3 200 μmol/L处理下达到最大值,在800 μmol/L和4 000 μmol/L时活性较低,与对照差异无统计学意义. ZS11的GAPDH和PRK活性在各处理浓度下均与其对照差异无统计学意义.
-
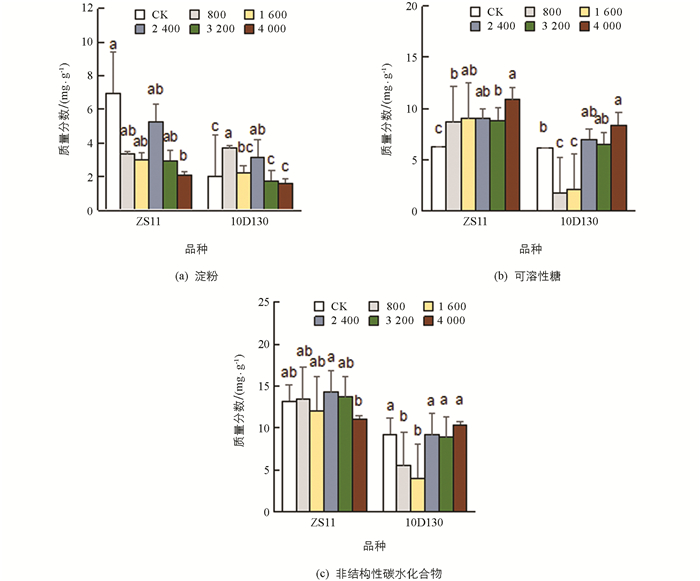
图 4中,ZS11的淀粉质量分数随铝胁迫浓度的增加而有所降低,可溶性糖质量分数呈逐渐上升的趋势,非结构性碳水化合物质量分数与对照差异无统计学意义,表明其在铝胁迫下通过渗透调节维持着较高的叶片代谢速率,表现出耐铝性. 10D130的淀粉质量分数呈先上升后下降的趋势,可溶性糖质量分数呈先下降后上升的趋势,非结构性碳水化合物质量分数变化与可溶性糖变化类似,并在低浓度(800,1 600 μmol/L)胁迫下与对照相比显著降低,表明此时碳的输入不能满足其代谢的需求,而后随浓度的增加而增加,维持碳平衡.
2.1. 铝胁迫对油菜光合性能指标的影响
2.1.1. 铝胁迫对油菜幼苗叶绿素质量分数的影响
2.1.2. 铝胁迫对油菜幼苗叶绿素荧光参数的影响
2.1.2.1. 铝胁迫对油菜幼苗叶片PSII光化学效率及电子传递的影响
2.1.2.2. 铝胁迫对油菜幼苗吸收光能分配的影响
2.2. 铝胁迫对油菜碳同化相关指标的影响
2.2.1. 铝胁迫对油菜幼苗光合参数的影响
2.2.2. 铝胁迫对油菜幼苗碳同化关键酶活性的影响
2.2.3. 铝胁迫对油菜幼苗非结构性碳水化合物质量分数的影响
-
光合作用是影响作物生产的最重要过程,高光合速率是提高作物生长的最重要育种策略之一[49],而胁迫能够抑制光合作用中的碳同化过程[50]并导致净光合速率降低[51]. 研究表明,不利条件下气孔或非气孔的限制会减少光合作用[52],而Pn,Gs和Ci的一致降低表明其光合作用植物主要受气孔因素限制[53-54]. 本研究中,2个品种的Ci呈下降趋势,且与Pn,Gs呈显著正相关(表 3),说明这两个油菜品种在铝胁迫下气孔关闭,使细胞间CO2浓度降低,油菜利用CO2能力下降,最终导致Pn下降. 前人通过铝处理青蒿发现气孔因素导致其光合速率降低[55],在铝胁迫下的麻疯树气体交换研究中发现,其Pn下降归因于气孔因素[56]. 另外,本研究中,较低处理浓度下2个品种的Pn相比于对照有所提升,可能是由于Al3+促进了油菜生长必需营养素(例如磷酸盐)的摄取,或减轻了其他有害离子(如Fe2+和/或H+)的影响[57],从而促进了油菜的光合速率. 有研究表明[58],在较低浓度铝胁迫(1.25,2.0 mol/L)下油茶的Pn和Gs得到了提升.
叶绿素(Chl a,Chl b,Chl)是植物叶片中的主要光合色素,是评估植物生理状态以及反映叶片光合作用能力的重要指标[59]. 本研究中,铝胁迫下ZS11的Chl b,Chl质量分数与Pn有显著相关性(表 4),说明Chl b质量分数的变化是制约其净光合速率变化的主要因素之一;而10D130的Chl a,Chl b,Chl质量分数与Pn都呈显著正相关,说明叶绿素质量分数的降低造成了其净光合速率的下降. 作物碳同化能力下降,光合色素吸收的光能就会超过碳同化的利用能力进而导致过剩光能的产生,从而导致光抑制[60]. 在2个品种中,最高胁迫浓度下Ex与对照相比显著上升,可知2个品种在最高胁迫浓度下存在光抑制,其中10D130的Ex上升幅度是ZS11的4倍,说明10D130受到的光抑制更严重,考虑主要原因是其净光合速率Pn的下降所致. 10D130的热耗散D值随着铝胁迫浓度的上升而增加,表明其通过环式电子传递[61]以及热耗散[62]来消耗过剩的光能;而ZS11中,其P, D,ETR,Fv/Fm,Fv′/Fm′在各浓度处理下均与各自的对照差异无统计学意义,其光抑制的原因可能与光抑制密切相关的放氧复合体(OEC)活性指标Fv/F0[23]在最高胁迫浓度下表现为显著下降有关,表明此时放氧复合体活性受损,导致PSII光抑制. 另外,铝胁迫下其PSII所分配的激发能份额β增加,可能会引起激发能的过剩,而Al3+没有激活其热耗散途径,过剩激发能难以通过热耗散转化,也导致PSII的光抑制. 由此可知,10D130较ZS11对Al3+更敏感并且能更快地启动光保护机制. 植物可以通过对二氧化碳同化的改善来调整吸收光能的利用率,从而最大程度地减少光抑制作用[63],而光化学能利用是捕光效率及PSII反应中心开闭程度共同作用的结果[44]. 本研究中,ZS11的Fq′/Fv′在最高处理浓度下显著降低,表明其在光抑制下通过PSII反应中心的关闭,减少过剩激发能的累积,达到光化学能利用的稳定;10D130的Fq′/Fv′和Fv′/Fm′均降低,说明其通过关闭PSII反应中心及降低捕光效率来实现光保护.
电子传递效率下降引起的同化动力供应不足会抑制卡尔文循环中的一些酶活性,从而引起光合速率的下降[64]. 在本研究中,我们以Pn与碳同化酶(Rubisco,GAPDH,PRK)活性做相关性分析(表 4),结果表明:在10D130中Pn与Rubisco和GAPDH活性呈显著正相关,该两种酶活性随着胁迫浓度增加呈先增加后下降的趋势;在ZS11中,Rubisco,GAPDH和PRK活性与Pn没有相关性,且GAPDH和PRK活性随铝胁迫浓度增加没有显著变化. 非生物胁迫下,耐性强植物相比于敏感性植物通常表现出较高的GAPDH活性[65-66]. 由此可知,ZS11相较于10D130有更强的耐铝性,原因可能是GAPDH活性的增加可以维持碳水化合物的糖酵解以产生能量并抑制活性氧(ROS)的产生[67-68],减轻光抑制程度,因此在碳同化过程中,GAPDH活性的维持可能是ZS11在铝胁迫下防止光合作用受抑制的因素,这也可以解释ZS11较10D130受到光抑制更轻. 我们还观察到,2个品种的Rubisco活性在低浓度铝胁迫(800 μmol/L)下较对照有显著下降,而Pn,Gs,Ci反而上升,其中的原因可能是Ci的升高致使CO2浓度达到饱和,使RuBP羧化酶(1,5-二磷酸核酮糖)再生速率(Jmax)成为影响光合的因素,而Jmax与碳同化过程中RuBP的再生有关[69-70],也就是说此时光合速率主要受到RuBP再生步骤的影响;另外,不同碳同化酶活性的增加会使碳同化效率提高[71],从而推断该浓度下2个品种的GAPDH和PRK活性的稳定有利于碳同化及光合作用的进行,进一步说明各处理浓度下ZS11中光合速率的稳定得益于GAPDH和PRK活性的维持.
作为光合作用的最终产物,有机物质量分数可作为植物生长潜力及鉴定植物对铝耐性的重要指标[72]. 本研究中,尽管ZS11的叶绿素质量分数,Fq′/Fv′和Fv/F0在处理与对照间有显著下降,用于光反应的光能P和非结构性碳水化合物(NSC)在对照与处理间差异无统计学意义,表明其能保持较好的光能利用与光合能力,维持光合有机物产出,具有更好的耐铝性. 而10D130的NSC与对照相比有一定上升,可能是Al3+降低了碳水化合物在生长中的利用[73],引起其叶片中碳水化合物的积累,尤其是可溶性糖质量分数的增加,使其通过增加渗透调节物质来维持正常的生理代谢[74]. 另外,碳水化合物的积累可能会引起反馈抑制作用,从而导致碳同化作用下降. 该结论与Dai等[75]对铝胁迫下田七NSC质量分数变化的结论一致,后者表明铝处理下田七中淀粉质量分数降低但NSC质量分数增加.
-
在铝胁迫下,2个油菜品种的净光合速率在铝处理下受气孔因素及叶绿素质量分数变化的影响. 2个品种均体现出光抑制,ZS11通过PSII反应中心的关闭以及10D130通过关闭PSII反应中心及降低捕光效率来减少光抑制的损害. 另外,ZS11中GAPDH活性的维持可能是其在铝胁迫下减轻光抑制的原因. ZS11通过改善NSC质量分数来保持其碳平衡,而10D130的NSC质量分数上升则表明可能存在负反馈对其碳同化产生抑制作用. 综合碳同化变化、叶绿素质量分数下降幅度、光抑制程度、碳同化酶活性变化以及NSC对碳平衡的调节可知,ZS11较10D130具有更好的耐铝性,能够保持较好的光合及碳同化效率.



 下载:
下载: