-
开放科学(资源服务)标识码(OSID):

-
铝(Al)是地壳中含量第三丰富且分布广泛的金属元素[1]. 铝的毒性取决于土壤的酸度,在pH值小于5.0的土壤中,铝溶解为有毒性的Al3+形式,它能够在微摩尔水平下抑制根系的生长[2]. 根系不仅是养分及水分的吸收器官,还可以感受土壤的养分状况所产生的化学信号,并将这些信号传递到地上部,从而控制地上部器官的生理活动,最终导致作物减产[3-4]. 酸性土壤约占世界可耕地面积的30%,占潜在可耕地面积的50%[5]. 近年来,铵肥大量施用以及酸雨频降引发耕地酸化愈发严重. 铝毒胁迫成为了酸性土壤中影响作物生长的主要限制因素之一,因此,研究作物对铝毒胁迫的适应性是非常必要的. 有研究表明,铝毒胁迫抑制了小麦[6]、大豆[7]、水稻[8]、油菜[9]、扁豆[10]等作物的形态和生理活性,但由于作物类型不同、同一作物品种的基因型不同,对铝毒的耐受性也会存在差异. 过去,主要通过改良酸性土壤来缓解铝毒对作物的伤害[11],但从生态角度来看,选育耐铝毒品种才是最经济、环保和有效的措施.
重组自交系(recombinant inbred lines,RIL)是指将两个不相关的高度近交品种(系)杂交产生F2代后,由F2个体经多代自交而产生的一系列自交系组合群体. 它在很大程度上消除了遗传背景的干扰,从而准确反映出不同性状之间的关系[12]. 近年来,随着作物抗逆性研究的深入,利用RIL材料进行综合评价,已初步应用于高粱[13]、水稻[14]、棉花[15]等作物的抗逆性鉴定中,但使用RIL群体作为耐铝性筛选材料的研究还很少,且根系变化是评价作物耐铝性的重要指标之一. Paul[16]以耐铝毒平均隶属函数值、根干质量比、总根长比和总根表面积比等作为指标,比较了大豆RIL群体的耐铝性. Butare等[17]使用菜豆RIL群体,通过地上部和根系生长反应的表型鉴定铝的抗性.
油菜(Brassica napus L.)是世界第二大油料作物,具有为人类提供食用油、蔬菜、饲料、观赏花、蜂蜜和肥料等多种用途[18]. 目前,我国油菜种植面积已超过720万km2,主要分布在长江中下游地区[19]. 但近年来,该地区遭受到酸性土壤的严重迫害[20],油菜对土壤酸度非常敏感,因而研究铝毒对油菜生长的影响及耐铝毒种质资源的筛选鉴定引起了广泛关注. 王瑞莉等[21]、吴家怡等[22]以甘蓝型油菜RIL群体为材料分别对铝毒胁迫下萌发期相关性状、幼苗期光合相关性状进行了QTL定位. 壮苗是获得更多的生物学产量(牧草)和经济产量(籽粒)的基础,壮苗要先壮根,建立发达的根系才能保证地上部茎、叶及果实的正常发育,因此,利用综合评价的方法通过幼苗期根系表型筛选耐铝种质对新品种培育和耐铝机制研究具有重要意义. 本研究以甘蓝型油菜RIL亲本10D130和中双11为材料筛选苗期适宜的铝胁迫浓度,并以该浓度处理RIL里138个品系的幼苗,统计各品系根系性状,采用主成分分析、系统聚类分析和逐步回归分析等不同评价方法,对苗期铝胁迫下的油菜根系耐铝性进行综合评价,以期为酸性土壤地区耐铝油菜品种(系)的筛选提供理论依据.
全文HTML
-
用于幼苗期铝毒胁迫处理浓度筛选的材料为10D130和中双11 (Zhongshuang 11,ZS11);用于资源筛选鉴定和综合评价体系构建的试验材料是由10D130为母本和ZS11为父本,采用单粒传法连续自交8代获得的包含138份品种(系)的RIL群体,所有品种(系)均由西南大学油菜工程技术研究中心提供. 用于铝毒处理的试剂为97%的A1Cl3·6H2O.
-
将ZS11和10D130两个品种各选择颗粒饱满、大小均匀的90粒种子用75%无水乙醇消毒1min后,用无菌水进行洗涤数次. 将种子播种于装有2/3湿润蛭石的方形塑料盆中,每个方形盆播5粒. 待油菜幼苗长出第2片真叶时,进行间苗,每个方形盆中留两株幼苗,并施加1/2霍格兰营养液. 待幼苗第4片真叶长出时开始用处理液进行铝胁迫处理,处理方式参考吴家怡等[22]的方法,处理液分别为添加有0 (CK),800,1 600,2 400,3 200和4 000 μmol/L A1Cl3·6H2O的1/2霍格兰营养液. 每个处理3个重复,每隔4 d更换1次相同的处理液.
铝胁迫处理15 d后,取各材料根系,利用根系扫描仪(Perfection V850 Pro,Epson Crop,Beijing,China)进行根系扫描,得到根系原位图并存入计算机转换为数字化根系图像后,采用根系图像分析软件WinRHIZO Pro 32-bit 2020a(Regent Instruments,Quebec,Canada)分别计算根长(cm)、根表面积(cm2)、根平均直径(mm)、根体积(cm3)、根交叉数(个)和根尖数(个).
-
从138份甘蓝型油菜RIL群体材料中挑选饱满均匀的种子分别播种在蛭石培养基中萌发,直至长至2~3片真叶时移栽到泡沫育苗盘(60 cm×34 cm×3 cm),置于蓝色塑胶箱(67 cm×41 cm×15 cm)中,并加入1/2霍格兰营养液漂浮培养,每箱加入营养液6 L. 设对照组(CK)和铝胁迫组(筛选出的最适宜铝处理浓度,调pH值为4.0~4.5)2个处理. 每隔4 d更换1次相同的处理液. 铝胁迫处理15 d后进行根系扫描,并在105 ℃下杀青10 min,75 ℃烘干24 h后测其干质量. 各性状的缩写如下:根长(Root Length,RL)、根表面积(Surface Area,SA)、根平均直径(Average Diameter,AD)、根体积(Root Volume,RV)、根交叉数(Root Crossings,RC)、根尖数(Root Tips,RT)、根干质量(Dry Weight,DW). 以上试验均设置3个重复.
-
使用Microsoft Excel 2019对原始数据进行统计、处理并制作相关图表,采用IBM SPSS 22.0[23]和DPS V9.50[24]对处理后的数据进行变异系数分析、相关性分析、主成分分析、灰色关联度分析、系统聚类分析及逐步回归分析等. 采用隶属函数和标准差系数赋予权重法进行耐铝性的综合评价. 各指标平均隶属函数(average sub-ordinative function value,ASF)、铝毒胁迫耐性综合评价(aluminum toxicity tolerance value,A)、铝毒加权耐性系数(weight aluminum toxicity tolerance coefficient,WAC)的计算方法及公式参照文献[25-27].
以各品种(系)7个根系性状测定值作为基础数据,进行变异系数分析,按公式(1)计算单项指标铝毒耐性系数(aluminum toxicity tolerance coefficient,AC). 针对各指标AC值,进行频数分布统计分析、相关性分析和主成分分析.
式中Xij,CKij分别表示第i个指标下第j个品种(系)铝毒胁迫和对照处理的指标测定值.
按公式(2)和公式(3)计算各品种(系)各指标的隶属函数[R(ACij)]和平均隶属函数(ASF):
式中ACij,ACij,min,ACij,max分别表示第i个指标下第j个品种的AC值及第i个指标下的最小值和最大值.
按公式(4)和公式(5)计算取各品种(系)各指标的权重(w)和铝毒耐性综合评价(A)值:
式中,Pi为第i个综合指标贡献率,表示第i个指标在所有指标中的重要程度;k为选取的主成分个数;R(Xi)为各主成分得分值.
按公式(6)和公式(7)计算关联系数(ξi)及等权关联度(γi):
式中,Δij为品种(系)最优性状与第j个品种(系)第i个性状的绝对差值. minΔij为最小二级绝对差值,maxΔij为最大二级绝对差值,p为分辨系数(取0.5).
按公式(8)和公式(9)计算各指标权重系数(ωi)和铝毒加权耐性系数(WAC):
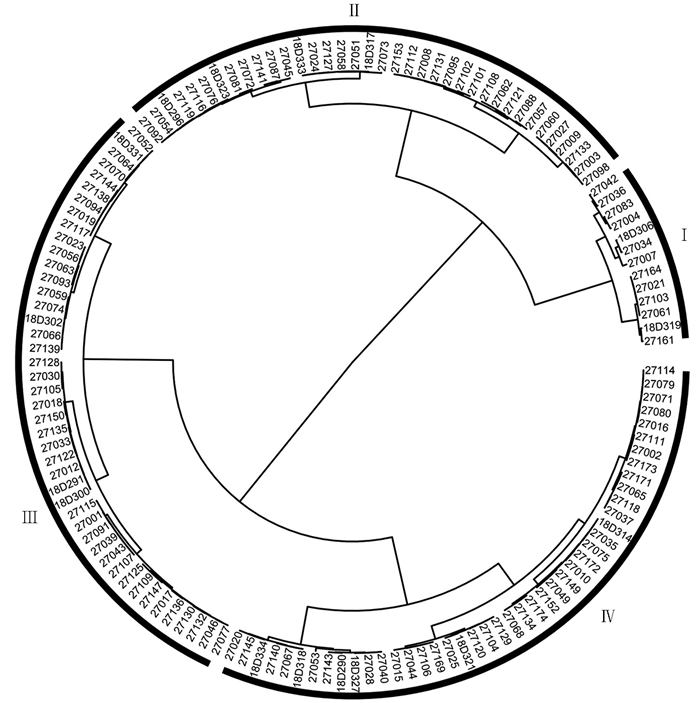
以各指标AC值为比较序列,并以A值为参考序列进行灰色关联度分析,获得各指标AC值与A值间的关联度(γi);最后基于供试甘蓝型油菜种质A值,采用离差平方和法(Sum of Squares of Deviations)和欧氏距离进行系统聚类分析,划分铝毒耐性等级,使用R语言ggtree函数绘制圆形聚类图[28]. 以A值为因变量,各指标的AC值为自变量进行逐步回归分析,获得回归方程.
1.1. 供试材料与试剂
1.2. 适宜铝胁迫浓度筛选
1.3. 幼苗期油菜RIL群体根系耐铝性测定
1.4. 数据处理与分析
-
本研究以根长作为苗期筛选耐铝胁迫的最适宜浓度指标. 由表 1可以看出,铝胁迫浓度为800 μmol/L时,ZS11的根长显著高于对照组(p<0.05),而10D130的根长与对照组相比差异无统计学意义(p>0.05). 随着铝处理浓度增加,两亲本的相对根长均呈下降趋势,但两亲本的下降幅度不同. 总体来说,ZS11对铝胁迫的耐受能力明显比10D130强,亲本间根系的抑制情况明显不同,可很好地区分耐铝性差异. 当铝胁迫浓度为1 600 μmol/L时,两亲本的相对根长均显著下降(p<0.05). 在0~1 600 μmol/L的铝处理浓度下,两亲本总根长均大于100 cm,在2 400~4 000 μmol/L的铝处理浓度下,总根长低于100 cm,显著低于对照组(p<0.05),故选择2 400 μmol/L铝胁迫浓度作为油菜幼苗期耐铝毒种质资源筛选的适宜浓度.
-
由表 2可知,在对照和铝处理2种条件下,RIL群体品种(系)间7个根系性状差异均达到统计学意义(p<0.05). 对照组中各性状变异系数范围为14.34%~59.25%,变异系数从小到大依次为根平均直径、根长、根表面积、根交叉数、根体积、根尖数和根干质量;处理组中各性状变异系数范围为18.36%~49.63%,变异系数从小到大依次为根平均直径、根表面积、根长、根体积、根交叉数、根尖数和根干质量. 对照和处理2种条件下变异系数均大于14%,表明138份RIL群体材料间具有较广泛的遗传变异. 铝毒胁迫下,根长、根表面积、根体积、根交叉数及根尖数均值较对照分别下降53.35%,50.00%,42.76%,57.25%和50.19%,而根平均直径、根干质量则分别较对照增加12.94%,2.30%.
-
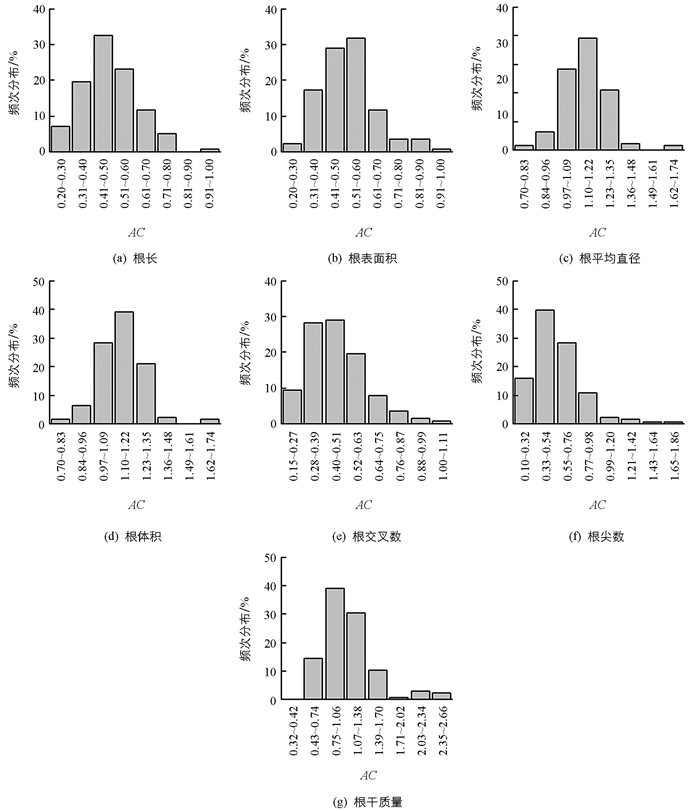
按照公式(1)计算138份RIL群体材料的单项指标铝毒耐性系数,统计该群体各AC的频次分布(图 1).
结果表明,各指标的AC值呈连续性变异分布,具有典型的数量性状特点,直接通过AC值来区分品种(系)铝毒耐受性较为片面. 由表 3可知,根长、根表面积、根体积、根交叉数和根尖数AC均值小于1.00,而根平均直径和根干质量AC均值大于1.00. 7个单项指标铝毒耐性系数在品种(系)间差异较大,均达到统计学意义(p<0.01),说明这些性状在铝毒胁迫下不同品种(系)间变化不同. 7个指标的变异系数为12.534%~46.374%,由小到大依次为根平均直径、根表面积、根体积、根长、根干质量、根交叉数、根尖数.
由表 4可以看出,各指标铝毒耐性系数之间存在一定程度的相关性. 铝胁迫下,根长与根表面积、根体积、根交叉数、根尖数、根干质量间呈极显著正相关(p<0.01),与根平均直径呈显著负相关(p<0.05). 根表面积与根体积、根交叉数、根尖数、根干质量间呈极显著正相关(p<0.01). 根平均直径与根体积、根干质量间呈极显著正相关(p<0.01);与根交叉数、根尖数间呈极显著负相关(p<0.01). 根体积与根交叉数、根尖数、根干质量呈极显著正相关(p<0.01). 根交叉数与根尖数、根干质量间呈极显著正相关(p<0.01). 可见,各性状的铝毒耐性系数所提供的信息重叠,在油菜耐铝毒胁迫中所起的作用不完全相同,直接利用这些性状指标的AC值来评价油菜幼苗期耐铝毒性不太准确.
-
由表 5可知,第1、第2、第3、第4主成分的贡献率分别为52.082%,24.672%,7.118%,6.606%,累计贡献率达到90.478%. 提取前4个主成分因子,基本涵盖了被测指标的大部分遗传信息,将7个单项指标转化为4个新的独立综合指标,作为铝毒胁迫影响油菜种质幼苗期的主要筛选指标(表 6). 在第1主成分中,根尖数、根长、根交叉数正向贡献率较高;在第2主成分中,根干质量、根长、根尖数、根表面积正向贡献率较高;在第3主成分中,贡献率较高的是根表面积、根平均直径、根交叉数、根尖数;在第4主成分中,贡献率较高的是根表面积、根长、根平均直径、根体积. 综合可知,主成分1,2,3,4基本包含了幼苗期测定的所有根系指标性状,其贡献率达到90%以上,所以前4个主成分可反映138份甘蓝型油菜品系幼苗期的耐铝毒性.
-
根据公式(3),对138份供试种质的平均隶属函数(ASF)进行计算和排序(表 7).
结果表明,平均隶属函数值为0.12~0.81,由大到小进行排序后的前10名依次为27007,27034,18D306,27042,27036,27004,27103,27164,27083和27061,从小到大后10名依次为27053,18D290,27028,27040,27067,27020,27143,27140,18D318和18D334. 供试种质铝毒耐性综合评价(A)值是衡量各品种(系)的主成分得分和主成分权重的累加值,其值大小反映了各品种(系)铝毒耐受性的强弱. 138份油菜种质A值为-2.04~3.69,根据A值大小对供试种质进行排序(表 7),耐铝性最强的前10个品种(系)依次为27007,27034,18D306,27036,27042,27004,27083,27021,27164和27103,耐铝性最弱的品种(系)依次为27053,27143,18D290,27028,27040,18D327,27140,27067,18D318和27020. 138份油菜种质的铝毒加权耐性系数(WAC)值为0.45~1.18. 根据WAC值对供试种质的耐铝性进行排序(表 7),对铝毒耐性强的品种(系)有27007,18D306,27036,27034,27004,27083,27164,27042,27021和27103,对铝毒敏感性的品种(系)有27053,27028,18D290,27143,27067,18D318,27040,18D327,27140和27020. 在3种综合评价体系中,138份品种(系)在不同评价体系中排名略有不同,但排名顺序差异不大,铝毒耐受性和铝毒敏感性品种(系)的筛选结果基本一致.
-
采用离差平方和法进行系统聚类,将138份供试种质按欧氏距离D=11.99可分为4类(图 2):第Ⅰ类是耐铝毒的品种(系),包括27007,27036和27034等13份,占9.42%;第Ⅱ类是较耐铝毒的品种(系),包括18D323,27132和27092等37份,占26.82%;第Ⅲ类属于铝毒较敏感的品种(系),包括27173,27049和18D314等44份,占31.88%;第Ⅳ类属于铝毒敏感的品种(系),包括27053,27143和27040等44份,占31.88%. 对4种类型的单项铝毒耐性系数(AC)、平均隶属函数(ASF)、铝毒耐性综合评价(A)、铝毒加权耐性系数(WAC)的统计结果表明(表 8),各单项指标AC值以及综合评价体系中的ASF值、WAC值和A值均随铝毒耐性级别降低而减小.
-
从各单项指标AC值与A值的灰色关联度、权重和排序(表 9)可以看出,关联度和权重从大到小依次为根表面积、根体积、根长、根干质量、根交叉数、根尖数和根平均直径. 虽然各关联度和权重系数差值较小,但根表面积和根体积排序靠前,结果与之前各指标对铝毒胁迫的敏感性基本吻合.
为了进一步分析幼苗期各单项指标耐铝毒系数与耐铝毒特性之间的关系,筛选出耐铝毒鉴定指标,建立耐铝毒评价的数学模型,进行耐铝毒性预测. 以7个单项指标耐铝毒系数为自变量、铝毒耐性综合评价(A)为因变量,进行逐步回归分析,构建最优回归方程:
这7项指标可为油菜幼苗期耐铝毒特性筛选提供参考,因此,在油菜幼苗期测定其根长、根表面积、根平均直径、根体积、根交叉数、根尖数和根干质量,并通过回归方程估算其A值,可以初步判断种质的耐铝毒特性. 根据这7个指标的灰色关联度权重和偏回归系数,筛选到根长、根表面积、根体积、根交叉数4个油菜苗期根系耐铝性评价的关键指标.
2.1. 适宜铝胁迫浓度的筛选
2.2. 油菜RIL群体幼苗期根系指标分析
2.3. 单项指标铝毒耐性系数(AC)分析
2.4. 油菜RIL群体铝毒胁迫条件下幼苗期根系耐铝性的综合评价
2.4.1. 单项指标铝毒耐性系数(AC)的主成分分析
2.4.2. 基于平均隶属函数值、铝毒耐性综合评价值和铝毒加权耐性系数的综合评价
2.4.3. 基于各品种(系)铝毒耐性综合评价(A)值的系统聚类分析
2.4.4. 幼苗期耐铝毒性指标的筛选和回归方程构建
-
幼苗期是油菜耐铝筛选指标的关键时期[29-30],幼苗期不仅能快速、准确地鉴定和筛选耐铝品种(系),还可以显著减少田间筛选的工作量和成本[31-32]. 水培试验方法对作物根系伤害小,营养液成分及pH值容易控制,且作物受到铝毒害的主要症状是根系生长发育受到抑制,因此普遍认为水培试验方法更适用于筛选耐铝作物品种(系)[33-34]. 本试验采用水培法对RIL群体中138份品种(系)进行了苗期耐铝性筛选,发现铝胁迫下大多数品种(系)根系发育受到抑制,而少数品种(系)的根系性状呈增长趋势,说明铝胁迫对不同品系油菜苗期的单项指标有不同程度的影响,由此可以看出通过单一根系性状进行耐铝性评价存在一定的局限性.
-
铝毒胁迫处理对油菜生长发育有明显的抑制作用,特别是对于根系,且随着浓度的不断增加,抑制作用越来越明显[35]. 郜欢欢等[25]研究发现,在萌发期低的铝毒浓度胁迫下,部分种质资源的根长较对照相比没有统计学意义(p>0.05);王瑞莉等[21]也发现,在20 μg/mL,40 μg/mL,60 μg/mL铝毒浓度胁迫下,ZS11和10D130在萌发期的相对根长下降幅度相近,无统计学意义(p>0.05). 铝在低浓度(25~100 μmol/L)下对油菜幼苗根系生长有促进作用,但随着铝浓度的增加(800~1 600 μmol/L),Al3+严重抑制了根系伸长和鲜质量[36]. 韩德鹏等[37]利用6种不同的铝浓度对2个耐铝毒差异显著的油菜品种进行了根系形态指标的测定,发现铝浓度对许多苗期形态指标有显著影响,且随着铝浓度的增加,根尖数呈先升高后降低的趋势,根长、根表面积等根系指标则呈逐渐减少的趋势. 本研究在最适宜铝胁迫浓度筛选试验中发现,在800 μmol/L铝胁迫下,耐铝种质(ZS11)的根长值高于CK,差异有统计学意义(p<0.05);铝敏感种质(10D130)在该铝浓度胁迫下根长较CK有所下降,但也未达到统计学意义(p>0.05). 在所有铝浓度胁迫下,耐铝种质的根长均高于铝敏感种质. 在2 400~4 000 μmol/L铝浓度处理后,两个品种的根长均表现为随着铝胁迫浓度的增加而不断降低的趋势. 结果表明铝毒胁迫对RIL群体的两亲本根系均有一定的抑制作用,而ZS11对铝毒胁迫的耐受能力明显高于10D130.
-
耐铝种质资源的筛选与鉴定是油菜耐铝育种的核心任务之一,油菜育种家常采用形态学指标和生理指标相结合的评价方法,即采用发芽势、发芽率、根长、芽长、鲜质量、干质量等指标评价油菜萌发期的耐铝性. 党甲军[36]利用根长、鲜质量、干质量进行模糊评价,对10个油菜品种的耐铝性进行了排序,这3个指标已广泛应用于油菜种质资源苗期耐铝性的评价中. 熊洁等[29-30]则将株高、根长、根茎粗、地下部干质量、地上部干质量、叶和根中可溶性糖含量、叶和根中脯氨酸含量、叶绿素相对含量、总根长、总根表面积、总根体积、根茎粗、绿叶数等作为衡量不同基因型油菜耐铝性的指标,并对其进行了耐铝性综合评价. 本研究测定了油菜RIL群体的根长、根表面积、根平均直径、根体积等反映铝毒胁迫对根系生长发育影响的7个单项指标,并通过平均隶属函数法对其耐铝性进行比较. 通过对铝毒耐性综合评价值与7个单项指标的逐步线性回归分析,得到了1个最优回归方程. 结合方程中自变量指标的偏回归系数,筛选到根长、根表面积、根体积、根交叉数等7个关键指标,满足大量种质资源苗期耐铝性鉴定对评价指标简单易行、准确有效的要求. 因而本研究选择的评价指标较为合理,得出的评价结果也较为可靠. 此外,本研究筛选出的耐铝种质可用于培育耐铝毒胁迫的油菜新品种,也可作为研究油菜耐铝毒胁迫机制的材料.
-
油菜耐铝性是一个受多种因素影响的复杂数量性状[38],容易受外界环境条件和自身基因型的影响,仅用单一指标难以准确评价油菜苗期的耐铝性[30]. 多元统计分析方法可以量化几个耐铝性相关指标,建立与耐铝性的定量关系,有效识别油菜的耐铝性. 近年来,多元统计学分析方法已广泛应用于大豆[39]、花生[40]、豌豆[27]、玉米[41]、番茄[42]等作物种质资源耐铝性的筛选与鉴定. 本研究选取7个油菜苗期耐铝根系指标,采用多元统计分析对油菜RIL群体苗期根系耐铝性进行综合评价. 通过主成分分析,得到了4个彼此独立的新指标,并结合隶属函数及权重获得了能客观反映各品种(系)铝毒耐性综合评价值,利用该指标将138份甘蓝型油菜RIL群体材料划分为耐铝毒、较耐铝毒、铝毒较敏感、铝毒敏感4种类型. 采用逐步回归分析构建了1个较为可靠的油菜苗期根系耐铝性评价模型. 对于未来新选育或新引进的油菜品系,只需利用最优回归方程中的7个指标,即可计算出铝毒耐性综合评价值. 由此判断出该品种(系)在苗期的耐铝性强弱以及该品种(系)是否适合在酸性土壤地区种植,并为油菜耐铝育种及资源鉴定提供了一定的理论依据.
3.1. 筛选油菜耐铝种质资源的方法
3.2. 铝胁迫浓度对油菜苗期耐铝根系相关性状的影响
3.3. 油菜RIL群体苗期耐铝性鉴定指标的选择
3.4. 油菜RIL群体苗期根系耐铝性的多元统计学分析
-
通过对138份甘蓝型油菜RIL群体材料7个根系性状的单项指标铝毒耐性系数(AC)进行主成分分析,将原有的相关单项指标转化为4个独立的综合指标,累计贡献率达到90.478%. 采用隶属函数法计算各品种(系)的铝毒耐性综合评价值,并用系统聚类分析法对该值进行分析. 138份RIL群体材料被分为4种类型,包括13种耐铝毒品种(系)、37种较耐铝毒品种(系)、44种铝毒较敏感品种(系)和44种铝毒敏感品种(系). 通过逐步回归分析,筛选出根长、根表面积、根平均直径、根体积、根交叉数等7个鉴定耐铝性的指标,并建立了最优回归方程,使油菜种质资源的耐铝性预测更容易、快捷. 通过主成分分析、系统聚类分析和逐步回归分析,对油菜种质资源的耐铝性进行综合评价回归分析更为可靠,既避免了单一指标的片面性和不稳定性,又揭示了油菜根系相关性状与耐铝性的关系.



 下载:
下载: