-
开放科学(资源服务)标识码(OSID):

-
桃(Prunus persica),蔷薇科李属小乔木,其原产于中国,距今已有近4 000年栽培史,是我国最古老的栽培树种之一,在全国范围内均有种植. 桃树经济价值极高,其果实作为最为常见的水果之一,味道鲜美、营养丰富;种子和枝条烘干制熟可入药,称为“桃仁”与“桃枝”[1];另外,桃是园林景观设计中的重要树种,被广泛用于道缘、小区、公园、广场等各种公共场所的绿化之中[2].
桃树生长发育的各个时期均有可能受病害侵扰,其中真菌病害种类繁多,对桃树植株的各个部位均可造成危害,不同种类的病害在桃树上的主要为害部位不同. 其中以真菌性穿孔病、流胶病、褐腐病、炭疽病、疮痂病等最为常见. 真菌性穿孔病在我国南方桃园中发生较为严重,对桃树叶片造成相当严重的危害,并且寄主范围较广,除桃树外,李、杏、梅、樱等核果类果树同样也是其为害对象[3];流胶病在长江以南的桃产区发病较为严重,发病率为30%~40%[4];桃褐腐病在我国16个省份均有发生[5],山东、长江中下游地区受害较为严重[6];桃炭疽病在南方湿润地区发病较为严重,北方地区的温室中也有发生[7];桃疮痂病在辽宁、山东、江苏和四川地区发病严重[8].
我国是桃树种植大国,种植面积及产量均位居世界前列,但由于农业生产过程中对病害的预防与治理仍存在一定问题,使得桃的果品质量与其他发达国家相比还存在一定差距. 同时,由于近年来气候条件发生变化,温度的上升使得病菌对桃树的侵染更加活跃,病害的发生愈加严重. 果农由于对病害缺乏系统正确的认识,往往会错过最佳的防治时间或是进行错误的治理,这也就进一步影响了生产质量的发展. 因此本研究从重庆市北碚区桃园中采集患病桃树组织样本,采用真菌分离纯化技术分离病原菌,并使用柯赫氏法则回接健康植物样本进行致病性测定,以此明确果园中真菌病害致病菌种类,为后续的防治工作奠定坚实的理论基础,并作为田间防控的重要参考依据. 在确定病害的病原菌之后,还可以采取生物防治的方式,通过筛选特定的生防菌来控制病害,减少化学农药的使用,从而进一步提高果品质量并减少环境污染.
全文HTML
-
本试验所用植物材料均于2023年8月采自重庆市北碚区三圣镇三生三世桃园. 采集患病叶片、果实各4份装入封口袋中,作为真菌分离纯化材料,另外采集若干健康样品作为后续致病性测定材料.
-
PDA培养基:葡萄糖20 g/L,琼脂粉20 g/L,马铃薯200 g/L. 把马铃薯削皮、清洗后切成边长为1.5 cm的小块,用电子天平称200 g小块并加入1 000 mL水中煮熟煮软(玻璃棒轻松扎入薯块即可),将所得马铃薯汁液用纱布过滤,用ddH2O定容至1 L,并溶解20 g葡萄糖,得到马铃薯葡萄糖汁液,将制备好的汁液分装至若干已加入5 g琼脂的250 mL锥形瓶中,密封后放入高压灭菌锅内,于121 ℃下灭菌20 min.
-
在实验室中进行分离纯化操作,于超净工作台内,在田间所采样品病组织的病健交接处,用经过消毒处理的剪刀和刀片剪取叶片切取果皮,所取组织块大小约1 cm2. 用70%酒精润湿组织块表面2~3 s,之后将组织块置于5%次氯酸钠5~8 min进行表面消毒;无菌水洗涤3次,每次2 min,以洗去消毒液;最后用滤纸控干组织块表面多余水分,将组织块平放于PDA培养基表面,每个培养基放置3块处理后的病组织;培养基封口贴好标签后倒置于25 ℃恒温培养箱中培养3~5 d,利用接种针或接种环取边缘菌丝于新的PDA平板上进行真菌纯化.
-
多次纯化后的真菌,用打孔器打取带有菌丝的菌饼,将菌饼放置于70%甘油冻存管中,将冻存管做好标记,并于-20 ℃低温冰箱中保存备用.
-
提前准备好经高温灭菌的离心管和小钢珠,将小钢珠提前装入2 mL离心管中,用灭菌过的接种针,从PDA培养基上刮取若干菌丝于离心管中,使用高速振荡仪充分振荡破碎;向破碎后的样品中加入700 μL CTAB,于65 ℃恒温水浴锅水浴40 min,每隔10 min将离心管颠倒混匀保证重复裂解;在通风橱内加200 μL三氯甲烷,4 ℃低温下高速离心机12 000 rpm离心15 min. 吸取离心后的上清液于新的1.5 mL离心管中,于冰上低温操作加入等体积异丙醇和20 μL醋酸钠溶液,振荡混匀,-20 ℃放置至少40 min. 低温离心机4 ℃、12 000 rpm离心15 min,去除上清液后加入70%乙醇800 μL用于洗涤沉淀,重复操作两次;再次4 ℃、12 000 rpm离心2 min,用移液枪吸去乙醇,之后将离心管开盖并于超净工作台静置,让残余乙醇挥发最终得到干净沉淀,加入65 ℃水浴锅预热过的ddH2O溶解沉淀.
以所提取真菌DNA作为模板,进行多基因序列扩增,所采用的引物有主要有以下几种.
ITS引物(引物序列ITS1:5’-TCCGTAGGTGAACCTGCGG-3’,ITS4:5’-TCCTCCGCTTATTGATATGC-3’);CAL引物(引物序列CL1C:5’-GAATTCAAGGAGGCCTTCTC,CL2C:5’-CTTCTGCATCATGAGCTGGAC);GAPDH引物(引物序列GDF:5’-GCCGTCAACGACCCCTTCATTGA,GDR:5’-GGGTGGAGTCGTACTTGAGCATGT);TUB2引物(引物序列T1:5’-GGTAACCAAATCGGTGCTGCTTTC,T2:5’-ACCCTCAGTGTAGTGACCCTTGGC).
PCR检测体系(50 μL)为:2×Taq PCR Mastermix 25 μL,ITS 12.5 μL,ITS 42.5 μL,ddH2O 18 μL,DNA模板2 μL. PCR反应程序为:预变性94 ℃ 5 min,变性94 ℃ 30 s,退火52 ℃ 40 s,延伸72 ℃ 1 min、35个循环,延伸72 ℃ 10 min,保温4 ℃.
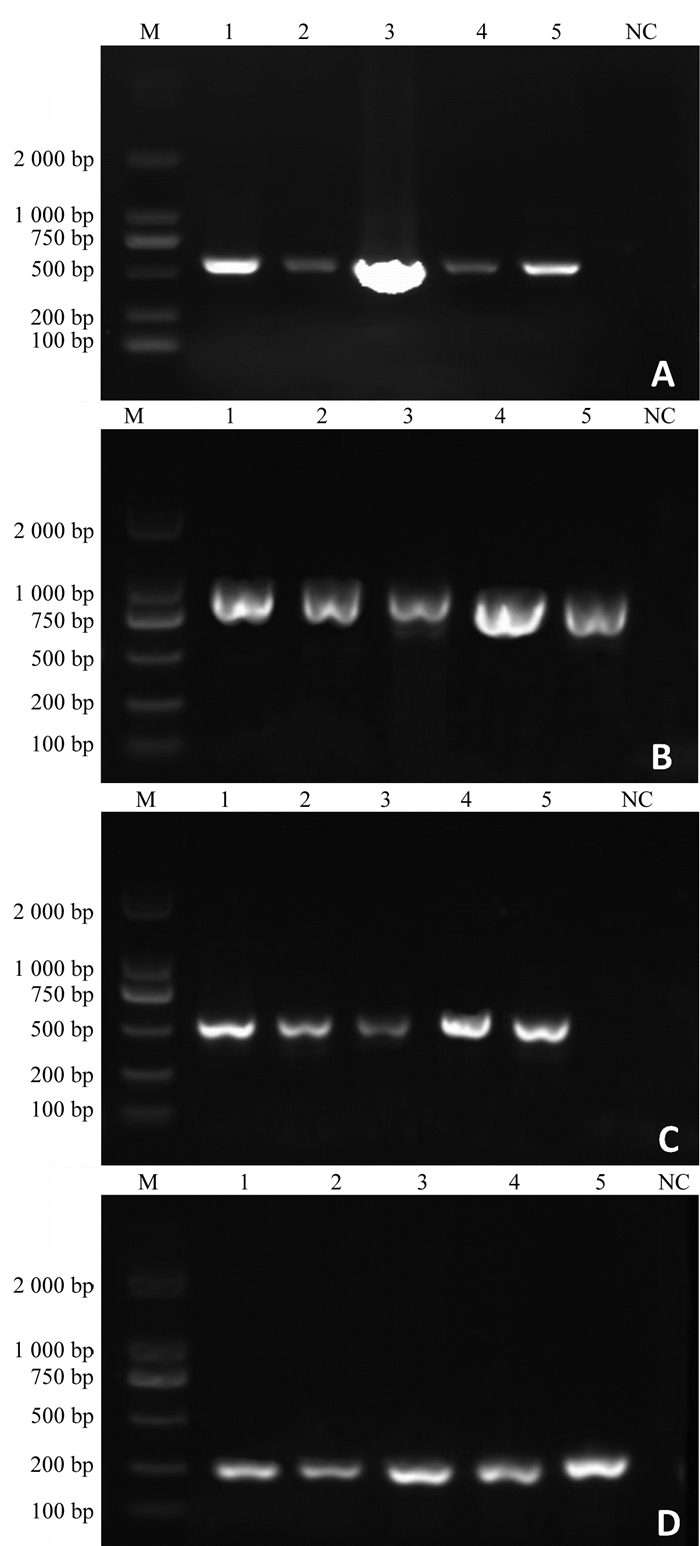
将所得PCR产物通过凝胶电泳,并利用凝胶成像仪采集结果进行片段大小检测. 将荧光条带位于500~750 bp的PCR产物送至生工生物工程(上海)股份有限公司进行测序.
-
将分离所得的病原菌分离到新的PDA培养基上,于28 ℃培养箱中倒置培养,待菌丝近乎长满整个PDA培养基后,于室内模拟条件下对健康桃叶和桃果进行离体接种. 首先用ddH2O对健康桃叶与桃果表面进行简单清洗,晾干后采用针刺法刺伤其组织,针刺过程中注意力度以确保刺伤面积深度合适. 之后用打孔器从菌落的外延边缘处取直径约5 mm的病原菌菌饼,将菌饼的菌丝面朝下放置于针刺后的桃叶和桃果之上,将经过ddH2O浸润的脱脂棉覆盖在菌饼上,每种菌株重复接种3次,同时设置PDA培养基接种作为空白对照组. 将接种好的桃叶桃果放入保鲜盒内,在保鲜盒底部平铺2~3层经高压蒸汽灭菌的纱布并做好保湿,后用保鲜膜将保鲜盒包裹,置于28 ℃光照温室培养7 d,第2 d去除菌饼,定期观察桃果桃叶发病情况. 出现症状后,取发病组织并采用组织分离法分离纯化病原菌,观察比较获得的病原菌是否与原始病原菌一致,确定其是否符合柯赫氏证病法则.
-
根据致病性测定结果,将病原真菌再次经过分离纯化后,取其菌丝于全新PDA培养基上,放入28 ℃恒温箱倒置培养,待菌丝长满PDA培养基,观察记录其形态、大小、颜色等特征,并进行拍照观察.
-
将所得致病真菌菌株DNA序列(ITS、CAL、GAPDH、TUB2)在NCBI进行序列比对检索,将检索出的具有高相似度的近缘DNA序列下载并通过DNAMAN进行比较分析;在MEGA 11中进行相关序列的系统发育树分析,使用最大似然法(Maximum Likelihood)演算最佳核酸替代模型来构建系统发育树,并通过重复1 000次的自展值来判断分支的可信度.
1.1. 植物材料
1.2. 培养材料
1.3. 真菌的分离与纯化
1.4. 真菌保存
1.5. 真菌DNA的提取与测序
1.6. 致病性测定
1.7. 真菌的形态学鉴定
1.8. 系统发育树的构建
-
根据调查,叶片穿孔和果实腐烂病是果园中发生最为普遍的症状,并且由于2023年降水量充沛,湿度的增加使得果园中病害发生的严重程度有所提高.
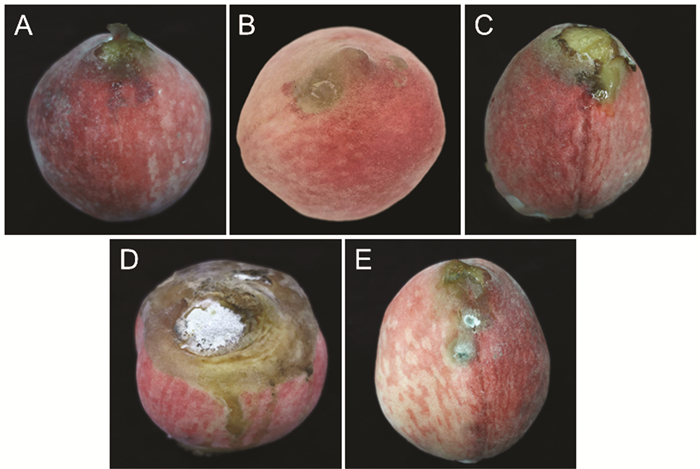
果园中患病的果树叶片大部分表现为穿孔症状,并且观察到患病叶片主要集中于果树下部荫蔽处,通风条件相对上部较差且湿度较高. 果树上部叶片几乎没有发病情况,部分发病严重叶片穿孔连接成片形成较大的缺刻或孔洞. 典型症状表现为:叶片表面出现多边形或近圆形褪绿病斑,从病斑中央开始,颜色逐渐变深至褐色,之后病斑部位焦枯变脆,而后因病斑脱落在叶面形成穿孔(图 1).
患病果树果实的发病情况则主要表现为果实腐烂,患病严重的还伴有灰白色绒球状霉层产生,且同样是果树下部较为荫蔽处的果实发病较为集中,而上部果实基本未出现发病状况. 典型症状表现为:部分发病较轻的果实,表面出现淡褐色的近圆形病斑,并伴随果皮龟裂,病斑周围果实逐渐变软腐烂. 发病严重的果实,病斑扩散并连接成片造成整颗果实的腐烂,并且在腐烂的果实表面由中心向周围产生灰白色霉层,霉层呈同心轮纹状排列(图 2).
-
通过对病原菌进行分离纯化,最终从PDA培养基上共获得了10种不同类型的真菌菌株. 提取真菌样品DNA并分别使用ITS、CAL、GAPDH、TUB2引物对其进行PCR序列扩增,4种引物扩增后通过凝胶电泳分别得到600 bp、750 bp、250 bp、500 bp左右的目的片段(图 3).
利用PCR产物进行测序,将测序结果在NCBI中进行序列的比对与检索,所得结果显示,从病叶上分离得到6种不同种类菌株,分别用L1~L6表示,其中L1型菌株所得序列与棒孢属(Corynespora sp.)相似度最高,相似度达99%;L2型菌株所得序列与粘帚霉属(Clonostachys sp.)相似度最高,相似度为97%~99%;L3型菌株所得序列与梨孢属(Apiospora sp.)相似度最高,相似度为96%;L4型菌株所得序列与炭疽菌属(Colletotrichum sp.)序列相似度最高,相似度为99%~100%;L5型菌所得株序列与炭团菌属(Fusarium sp.)相似度最高,相似度为95%~96%;L6型菌株所得序列与黑孢属(Nigrospora sp.)相似度最高,相似度为97%~99%.
病果上分离得到4种不同种类菌株,其中F1型菌株所得序列与拟盘多毛孢属(Pestalotiopsis sp.)相似度最高,相似度为96%~98%;F2型菌株所得序列与间座壳属(Diaporthe sp.)相似度最高,相似度为97%~99%;F3型菌株所得序列与交链孢霉属(Alternaria sp.)相似度最高,相似度为98%~100%;F4型菌株所得序列与链核盘菌属(Monilinia sp.)相似度最高,相似度为100%.
-
将从桃树叶片上分离并培养所得的6种不同种类真菌,用打孔器取5 mm菌饼分别回接至带有微创口的健康桃叶上,观察到在7 d后,接种L1、L2、L3、L5、L6型真菌以及用PDA培养基作为空白对照的健康桃叶即使在进行了针刺接种后,伤口仍没有出现被侵染的现象,而接种L4型菌株的叶片在7 d后,叶面出现了不规则淡褐色病斑(图 4),并且经过再分离、形态学鉴定和DNA检测后确定为炭疽菌属(Colletotrichum sp.)真菌.
将从桃树果实上分离并培养所得的4种不同种类真菌,用打孔器取5 mm菌饼分别回接至带有微创口的健康桃子上. 7 d后,接种F1、F2、F3型真菌以及用PDA培养基作为空白对照的健康桃果实在进行了针刺接种后,仅出现了小面积的变软或腐烂,且经过再分离后并没有分离出相同真菌菌株. 而接种F4型菌株的果实在7 d后,果实产生大面积的软腐,并且果实表面生出了白色霉层(图 5),经过再分离、形态学鉴定和DNA检测后确定为链核盘菌属(Monilinia sp.)真菌.
-
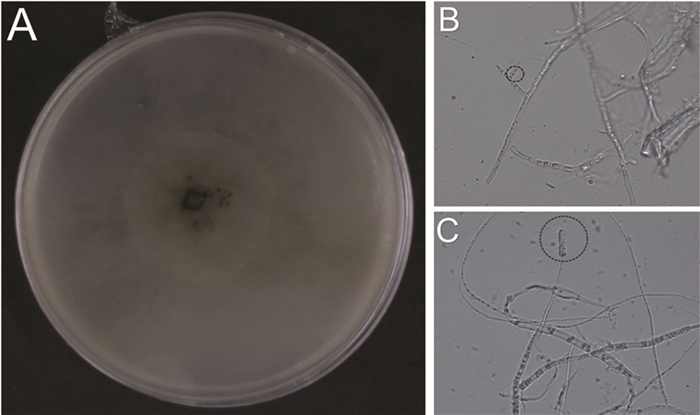
根据致病性测定结果,选取使桃树叶片发病的炭疽菌属真菌L4在PDA培养基上进行培养观察,可以观察到菌株L4在培养7 d后菌落呈近圆形,有少量呈丝状菌丝生长于培养基表面,颜色呈白色,新生菌丝较少且在后期培养基中部出现了少量的黑色真菌孢子团. 在显微镜下观察到病原菌菌丝有分枝,无隔膜;分生孢子两端呈钝圆形,整体呈柱状,无色(图 6).
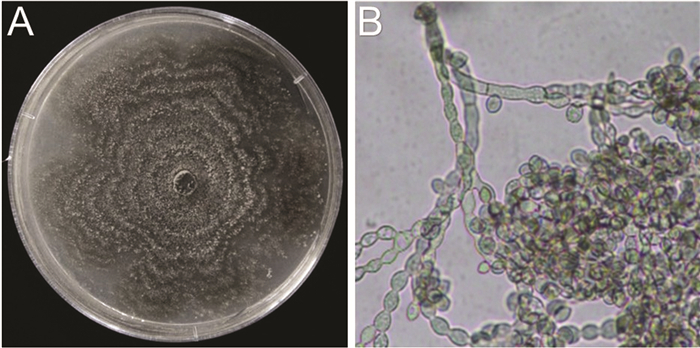
根据致病性测定结果,选取使桃树果实发病的链核盘菌属真菌L4在PDA培养基上进行培养观察,可以观察到菌株F4在培养7 d后菌落整体呈近圆形,菌落边缘不连续并且由于分生孢子的产生呈现出同心圆环状,菌落生长初期颜色呈灰白色,后期菌落颜色逐渐变深呈灰褐色. 在显微镜下观察到病原菌菌丝有分枝,内含隔膜;分子孢子串生,单孢子,孢子呈椭圆形,无色(图 7).
-
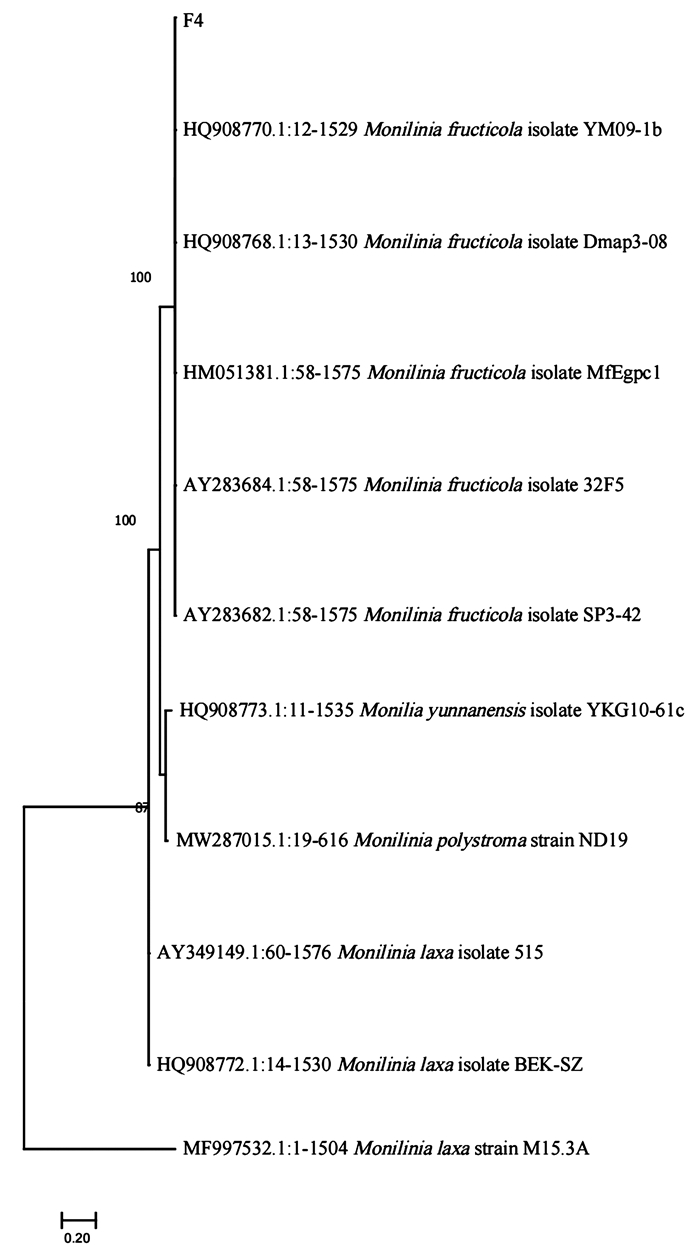
经过致病性测定以及再分离,并对再分离的病原菌进行生物学特性鉴定后,将病原菌基因组中的ITS、CAL、TUB2、GAPDH序列在NCBI数据库中进行BLAST比对,确认了能够导致桃树叶片与果树发病的真菌分别为Colletotrichum sp.与Monilinia sp.,在此基础上进一步利用MEGA 11软件、最大似然法,通过演算得出的最优替代模型为“GTR+G+I”模型,以此构建系统发育树. 结果显示,导致健康桃叶发病的L4型菌株在系统发育树中与OP466830.1:1-581 Colletotrichum gloeosporioides isolate PRSM01等处于同一分支中,结合其生物学特性,最终可将其确定为胶孢炭疽菌(Colletotrichum gloeosporioides)(图 8);而导致健康桃果发病的F4型菌株在系统发育树中与HQ908770.1:12-1529 Monilinia fructicola isolate YM09-1b处于同一分支中,结合其生物学特性,最终可将其确定为美澳型核果链核盘菌(Monilinia fructicola)(图 9).
2.1. 病害症状
2.2. 病原真菌分离纯化
2.3. 真菌菌株致病性测定
2.4. 病原真菌生物学特性鉴定
2.5. 致病菌系统发育树构建
-
重庆市北碚区桃树病害主要以叶片穿孔病和果实腐烂病较为严重,叶片受害症状表现为表面产生不规则穿孔;果实受害症状表现为果实部分或整果腐烂,并且腐烂部位有霉层产生. 通过对果园中桃树两种真菌病害进行了病原菌分离以及纯化培养,依据病原菌菌株的生物学特征,并利用柯赫氏法则进行了致病性测定,再对真菌多基因序列构建系统发育树进行分析,最终确定了引起果园中桃树叶片穿孔病与果实腐烂病的主要病原菌分别为胶孢炭疽菌(Colletotrichum gloeosporioides)和美澳型核果链核盘菌(Monilinia fructicola),这为探究重庆市桃树病害真菌的田间防控提供了依据.
病原真菌寄主范围广泛,具有丰富的遗传多样性,其形态特征、致病力和近似种等之间差异微小,因此在不同的产区内,导致相同病害症状的病原菌可能存在差异. 本研究通过对重庆市北碚区桃树患病叶片进行病原菌分离鉴定,发现胶孢炭疽菌是重庆市桃树叶片穿孔病的致病菌,这与解孝水[8]通过对山东临沂县的患病桃树进行调查并进行病原鉴定发现胶孢炭疽菌能够侵染叶片,并且在后期病组织会干枯脱落,进而造成叶片穿孔这一结论一致. 而王剑荣等[9]通过对浙江省金华与义乌两市的患病样品进行鉴定,发现浙江省桃树叶片穿孔的致病菌为嗜果刀孢霉(Clasterosporium carpophilum);王召元等[10]则发现核果假尾孢菌(Pseudocercospora circumscissa)可以导致桃树叶片穿孔病的发生. 同时,本研究发现导致重庆市北碚区桃树果实腐烂病的致病菌为美澳型核果链核盘菌,这与李志伟等[11]通过采集烟台、威海、临沂等患病样品并进行分离鉴定发现美澳型核果链核盘菌是引发山东省桃果实腐烂病的主要致病菌的结论保持一致. 然而邢红亮等[12]通过对南疆桃园中患病样本进行分离鉴定,发现桃幹枯蕉孢菌(C.leucostma Sace.) 能够引发桃果实腐烂病;刘君盈等[13]通过采集河北省深州市蜜桃园中患病样品并进行分离,则发现暹罗炭疽菌(Colletotrichum siamense)同样也是引发深州桃树果实腐烂病的病原菌.
相较于叶片病害,桃果实病害对生产造成的危害更为严重也更为直接,特别是在7、8月桃的主要采收阶段,由于高温高湿的环境导致真菌繁殖、传播与侵染都极为旺盛,这便容易导致果园中桃子大面积受害腐烂. 与此同时,因为桃子果实软表皮薄,在运输过程中也极易因机械损伤而造成真菌的侵染进而导致果实腐烂[14-15],因此减少桃树果实腐烂病的发生也成为当前生产中的重点. 目前所采用的防治措施主要以化学防治为主,有研究表明目前针对桃果实腐烂病防治效果较好的药剂有申嗪霉素、腈苯唑、苯醚甲环唑、苯甲·嘧菌酯等[16-17]. 然而长期用药导致的病原菌产生抗性,以及对环境造成污染的问题也逐渐显现,因此安全、高效、无残留的生物防治逐渐成为研究的热点,针对桃果实腐烂病目前已有报道从高产桃园土壤中分离、筛选具有防治作用的细菌菌株,对不同病原菌引起的桃褐腐病均具有良好的抑制效果,如袁雪等[18]筛选到特基拉芽孢杆菌(Bacillus tequilensis)对桃褐腐病病原菌的抑菌率为74.48%;侯亚倩[19]等筛选到对美澳型核果链核盘菌最优的拮抗酵母——异常威克汉姆酵母(Wickerhamomyces anomalus),其对美澳型核果链核盘菌的菌丝抑制率达78.31%,可以诱导桃果内抗氧化酶活性的增高,显著抑制桃褐腐病. 这两种生防菌在田间的防效都具有深入研究的价值.
本研究仅对重庆市北碚区桃树病害进行了病原菌分离鉴定,而重庆其他桃产区的病害严重程度、种类以及病原菌类型仍有待更加全面地考察与研究. 为了更好地防治当地桃树叶片穿孔病和果实腐烂病,并保证桃产业的健康发展,亟待对导致两种病害的病原菌进行更加深入且细致的研究,进一步了解两种致病菌的生物学特性,以便于更好地对病害的发生进行预测,进而对病害进行有效防治.




 下载:
下载: