-
开放科学(资源服务)标识码(OSID):

核桃(Juglans regia L.)是胡桃科(Juglandaceae DC. ex Perleb)胡桃属(Juglans L.)多年生落叶乔木,是我国重要的“木本粮油”树种,兼具生态保护和经济价值,其栽培历史可追溯至7 000年前[1]。截至2020年,我国核桃种植面积已达679.1万hm2,覆盖23个省(区、市)[2]。核桃在重庆市栽培历史悠久,是当地山区重要的经济支柱产业[3]。然而,近年来核桃病害问题日益突出,尤其是炭疽病在重庆地区发生频率显著升高。2022年初田间调查显示,核桃树叶片出现褐色病斑,中央呈灰白色,具明显同心轮纹,潮湿条件下形成粉红色黏质分生孢子堆;果实表面产生多个凹陷、形状不规则的黑褐色病斑,具同心轮纹,后期密布黑色分生孢子盘,严重时侵染核仁导致褐腐;枝条上可见黑褐色梭形病斑,对核桃产量与品质构成直接威胁[4]。
据文献报道,我国已明确由病原微生物侵染引发的核桃病害达20余种,主要包括核桃细菌性黑斑病[5-6]、炭疽菌[5]、褐斑病[6]、白粉病[5]、溃疡病[5]、腐烂病[5-7]等。其中,炭疽病因病原菌遗传多样性和致病机制复杂,已成为制约核桃产业发展的关键因子。核桃炭疽病由刺盘孢属真菌(Colletotrichum spp.)引起,其病原种类多样,遗传变异显著。我国已报道的核桃炭疽病原包括胶孢炭疽菌(C. gloeosporioides)和睡莲炭疽菌(C. nymphaeae)等[8-9],其中胶孢炭疽菌在云南等地为优势种[10],而重庆地区病原种群组成尚不明确。化学防治是目前核桃炭疽病的主要防控措施,咪鲜胺(Prochloraz)作为推荐药剂,因长期单一使用已导致多地病原菌敏感性下降[11],抗药性风险日益凸显,亟需开展病原鉴定与药剂筛选研究。
本研究基于重庆市14个区(县)采集的炭疽病样本,通过形态学观察、多基因(ITS-ACT-GAPDH-Tub2-CAL)系统发育分析明确病原菌种类,并筛选苯并咪唑类、烟酰胺类等10种作用机制差异化的杀菌剂,评估其对优势病原的抑制效果,以期为重庆地区核桃炭疽病的精准防控及抗药性管理提供科学依据。
全文HTML
-
2022年4月至2023年7月,在重庆市北碚区、城口县、巫溪县、巫山县、云阳县、奉节县、彭水县、黔江县、秀山县、南川区、綦江区、石柱县、涪陵区和丰都县14个核桃种植区开展调查,采集疑似核桃炭疽病的感病组织,包括叶片(近圆形褐色斑点)、枝条(凹陷梭形病斑)和果实(表面凹陷严重、具黑褐色病斑)共93份。记录采集时间、地点及症状特征后,将样本置于4 ℃冰箱保存备用。
10种供试原药均购自湖北康宝泰精细化工有限公司。除多菌灵用0.2 md/L盐酸溶解外,其余原药均以丙酮溶解配置成10 mg/L母液,并以灭菌水稀释至不同质量浓度梯度(表 1)。
-
采用组织分离法[12]进行病原菌分离。病样经流水冲洗后,切取病健交界处组织块(5 mm×5 mm),依次使用75%乙醇(15 s)和5% NaClO(1 min)表面消毒,然后用无菌水漂洗3次,晾干后接种于马铃薯葡萄糖琼脂(PDA)培养基上,在25 ℃环境下培养3~7 d。采用菌丝尖端挑取法对菌落进行纯化,获得单一菌落。
-
参照柯赫氏法则,选取健康核桃叶片,使用70%乙醇表面消毒后,用无菌水冲洗,叶柄包裹湿润的灭菌脱脂棉,平铺在灭菌纱布上。接种部位刺伤后,覆盖5 mm PDA菌饼块,作为接种菌丝块,对照组接种无菌PDA块。所有样品在25 ℃下进行光暗交替培养(12 h/12 h)。接种7 d后,观察发病情况并拍照记录。
-
纯化菌株在PDA培养基上,置于25 ℃黑暗条件下培养5 d后,持续观察菌落形态(如颜色、质地、边缘特征和生长速率)及微观特征(如分生孢子形态、附着胞结构、产孢结构等),并拍照记录。
-
采用玻璃纸培养法获取分离物的菌丝,利用CTAB法提取DNA。以提取的菌株DNA为模板,选择内源转录间隔区(Internal Transcribed Spacer,ITS)、钙调蛋白(Calmodulin,CAL)、甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate Dehydrogenase,GAPDH)、β-微管蛋白(β-tubulin,Tub2)、肌动蛋白(Actin,ACT)作为目标基因,进行PCR扩增(表 2)。扩增产物经生工生物工程(上海)股份有限公司测序后,使用NCBI BLAST比对进行初步鉴定。下载模式菌株序列,并使用MEGA 11.0软件构建多基因(ITS-ACT-GAPDH-Tub2-CAL)串联系统发育树。单基因分析采用邻接法(NJ),多基因联合分析则采用最大似然法(ML,Bootstrap=1 000)。
-
采用菌丝生长速率法测定供试药剂对两种菌株的毒力。将供试杀菌剂溶解于丙酮中(多菌灵用0.2 mol/L HCl溶解),配制10 mg/L母液,再用灭菌水梯度稀释至0.1~100 μg/mL。将含药PDA培养基(9 mL PDA +1 mL药液)接种直径为5 mm的菌饼,在25 ℃黑暗条件下培养7 d。采用十字交叉法测量菌落直径,计算抑菌率。
抑菌率(%)=(溶剂对照组直径-处理组直径)/(溶剂对照组直径-5 mm)×100%。
-
根据生物统计学概率值表,将抑菌率转换为几率值并与浓度对数进行回归分析。使用SPSS 27和GraphPad Prism 8软件,以抑菌率的几率值为纵坐标,浓度的对数为横坐标,计算毒力回归方程(y=ax+b)、相关系数(R)及抑制中浓度EC50值,用于评价杀菌剂的抑菌能力。
1.1. 试验材料
1.2. 病原菌分离纯化与鉴定
1.2.1. 病原菌的分离纯化
1.2.2. 致病性测定
1.2.3. 形态学鉴定
1.2.4. 分子生物学鉴定
1.3. 室内药剂筛选
1.4. 数据处理与统计学分析
-
田间调查发现,炭疽病可导致核桃新叶上出现病斑,初期病斑呈近圆形或不规则褐色,周围有淡黄色晕圈,病斑可沿叶脉扩展成长条状,严重时病斑连片,导致叶片发黄。保湿后,病斑表面可见灰白色菌丝和分生孢子团。老叶上的病斑多为近圆形,随着叶脉扩展或因叶脉阻碍呈现梭形,病斑边缘呈深褐色,中间部分为浅褐色干枯,易破裂,病斑中央有黑色点状结构,为炭疽菌的分生孢子盘(图 1a)。茎秆上的病斑初期为黑色竖线,逐渐扩大形成梭形凹陷,后期病斑扩展成片,导致枝条发黑萎缩,苞芽被侵染后可能发黑并掉落(图 1b)。果实上的病斑初期呈褐色,后期转为黑褐色,病斑呈近圆形,中央下陷。一个果实上可出现多个病斑,病斑融合后可导致果实整体变黑腐烂。病害侵染青皮部位甚至可扩展至核仁内部,使果实失去经济价值(图 1c)。
-
通过表面消毒、病健交界组织分离及PDA培养纯化,共获得95株病原分离物。根据培养性状的观察,发现有两种表型较为一致。第一种表型以重庆市北碚区天府镇叶片样品的分离物BTZL1-4为代表,共分离到25株,占比26.32%;第二种表型以城口县高观镇果实样品的分离物CGWF-6-10为代表,共分离到32株,占比33.68%。
-
菌株BTZL1-4、CGWF-6-10接种核桃叶片后,在伤口处形成中间褐色,边缘深褐色病斑,病斑处呈现轮纹状排列的粉色分生孢子,且菌株接种后接种叶颜色发黄(图 2)。经柯赫氏法则验证,在病斑处分离到相应菌落形态的病原菌。
-
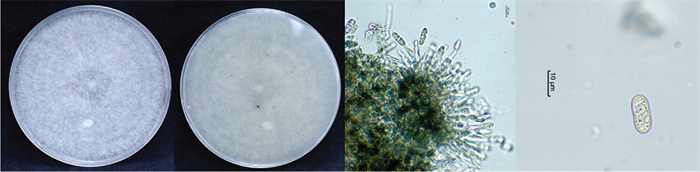
菌株BTZL1-4在PDA平板上培养时,菌落正面呈灰白色至淡褐色,从背面观察可见同心轮纹状结构,背面颜色较暗黄,后期色素沉着转为淡褐色至橄榄色。气生菌丝丰富,呈灰白色,致密且隆起,棉絮状,边缘不规则,生长速率较快,平均生长速率为(12.79±1.00) mm/d。培养2周后,菌落中央逐渐形成橙色孢子团,随后孢子团从基部开始硬化,最终转变为黑色菌核,并被气生菌丝覆盖,半埋于培养基中。营养菌丝透明,光滑且有分隔;分生孢子单胞,椭圆形,直,一端钝圆,另一端较扁平,无隔膜,具一个油球,大小为(12.5~15.0)μm×(5.0~7.5) μm,长宽比(L/W)=2.4。分生孢子梗呈弯曲的圆梯形,透明无色,长短不一。附着胞呈近圆形或不规则椭圆形,灰色至深灰色,边缘规则,芽管可从分生孢子的一端或两端伸出,透明无色,无隔(图 3)。
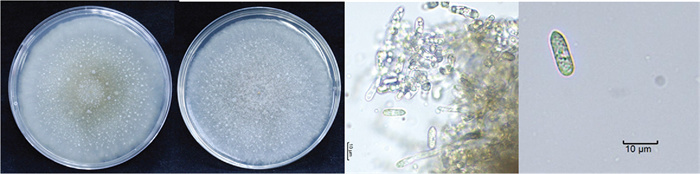
菌株CGWF-6-10在PDA平板上培养时,菌落正面呈灰白色,正面和背面布满雪花状的小白点。气生菌丝丰富,呈灰白色,隆起且致密,呈棉絮状,边缘规则,生长速率较慢,平均生长速率为(6.76±2.14) mm/d。培养7 d后,菌落中央出现橙色孢子团,随后孢子团从基部开始硬化,最终转变为黑色菌核,且被气生菌丝覆盖,半埋于培养基中。营养菌丝透明,光滑且有分隔;分生孢子单胞,椭圆形,直,一端钝圆,另一端锐尖,无隔膜,具一个油球,大小为(13.7~17.5) μm×(5.0~6.3) μm,长宽比(L/W)=2.9。分生孢子梗呈圆梯形,上窄下宽,透明无色。附着胞呈近圆形或不规则椭圆形,灰色至深灰色,边缘规则,芽管可从分生孢子的一端或两端伸出,透明无色,无隔,长短不一(图 4)。
-
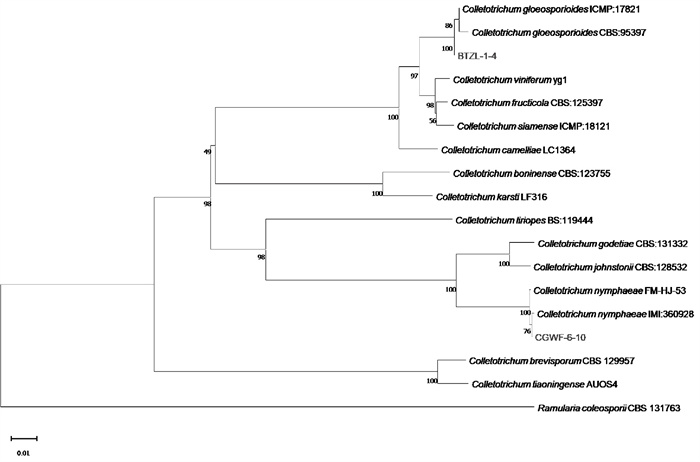
对菌株BTZL1-4和CGWF-6-10分别进行ITS、ACT、CAL、GAPDH、Tub2基因的扩增和测序,BLAST比对结果显示,菌株BTZL1-4与胶孢炭疽菌(Colletotrichum gloeosporioides)的序列一致率超过99%,而菌株CGWF-6-10与睡莲炭疽菌(Colletotrichum nymphaeae)的序列一致率超过99%。根据“ITS-ACT-GAPDH-Tub2-CAL”基因顺序进行拼接,并使用MEGA 11.0软件构建系统发育树。结果表明,菌株BTZL1-4与C. gloeosporioides聚类在同一支,菌株CGWF-6-10与C. nymphaeae聚类在同一支(图 5)。
-
筛选结果显示,胶孢炭疽菌和睡莲炭疽菌对啶酰菌胺、多菌灵、甲基硫菌灵、苯醚甲环唑、丙硫菌唑、戊唑醇、肟菌酯、醚菌酯、嘧菌酯和吡唑醚菌酯这10种杀菌剂的敏感程度有所不同。胶孢炭疽菌对苯并咪唑类杀菌剂多菌灵和甲基硫菌灵的敏感度较高,EC50值分别为0.056 μg/mL和1.564 μg/mL,而对甲氧基丙烯酸酯类的肟菌酯、醚菌酯和嘧菌酯则表现出抗性。睡莲炭疽菌对烟酰胺类杀菌剂啶酰菌胺和苯并咪唑类的多菌灵表现出较高的敏感性,EC50值分别为0.015 μg/mL和0.250 μg/mL,三唑类杀菌剂丙硫菌唑的抑菌效果也较好;然而,对甲氧基丙烯酸酯类的肟菌酯和醚菌酯表现出抗性(表 3)。
2.1. 重庆市核桃炭疽病症状
2.2. 病原菌的分离纯化结果
2.3. 致病性测定结果
2.4. 形态学鉴定结果
2.5. 分子生物学鉴定结果
2.6. 室内药剂筛选结果
-
本研究观察到的核桃炭疽病症状与国内外关于Colletotrichum属病原菌侵染特征的报道一致[18-19]。其中,病斑上的粉红色分生孢子堆是炭疽病的典型标志,这一发现为田间快速诊断提供了直观依据。通过形态学观察与多基因系统发育分析,首次明确重庆市核桃炭疽病的主要病原为睡莲炭疽菌(Colletotrichum nymphaeae)和胶孢炭疽菌(Colletotrichum gloeosporioides),其中睡莲炭疽菌的分离率较高。该结果与既往报道中以C. gloeosporioides为主的病原构成存在细微差异[9]。此外,C. nymphaeae作为核桃炭疽病病原体,于2021年在意大利首次被报道[20],并于2022年在我国首次被确认作为核桃炭疽病的病原[21],这表明Colletotrichum nymphaeae已在我国西南地区建立了稳定的种群,可能与重庆湿润多雾的气候条件以及核桃品种的种植布局相关。
在病原鉴定方法上,本研究突破了单一ITS基因鉴定的局限性。由于炭疽菌属的ITS序列同源性较高且种间差异较小,本研究结合ACT、CAL、GAPDH和Tub2基因,构建了多基因系统发育树,从而显著提升了菌株区分的精度,使得鉴定结果更加准确。这一策略为复杂环境下炭疽菌的精准分类提供了可推广的技术框架,尤其适用于具有高度表型可塑性的植物病原菌鉴定。
化学防治试验结果显示,多菌灵(苯并咪唑类)对胶孢炭疽菌,啶酰菌胺(烟酰胺类)对睡莲炭疽菌表现出高效的抑制活性,EC50值分别为0.056 μg/mL和0.015 μg/mL,这与两类病原菌的遗传背景及药剂作用靶标的差异密切相关[22]。值得注意的是,甲基硫菌灵(同为苯并咪唑类)在室内的抑菌效果弱于多菌灵,推测这一差异与甲基硫菌灵需在植物体内转化为多菌灵的特性有关。在实验室无菌条件下,缺乏植物代谢酶的作用,导致活性成分的转化受到限制。然而,甲基硫菌灵的环境稳定性较好(仅在强碱条件下分解)及其较强的内吸性使其在田间可能具有更持久的防控效果,这一推测需通过田间药效试验进一步验证[23-24]。抗药性检测结果表明,胶孢炭疽菌和睡莲炭疽菌对甲氧基丙烯酸酯类杀菌剂(如肟菌酯和醚菌酯)表现出显著抗性,且胶孢炭疽菌对甲基硫菌灵的抗性存在地域与年份差异[25-28],这与重庆地区长期单一依赖此类药剂的用药历史密切相关。
尽管本研究为重庆核桃炭疽病的防控提供了重要依据,但由于样本量和菌株数量有限,可能未全面代表重庆市核桃炭疽病病原菌的多样性。此外,药剂筛选仅停留在室内抑菌水平,本研究未进行大规模的田间试验,因此实际防效可能受到气候、施药时机等因素的影响。药剂的田间效果和抗药性风险仍需进一步评估。未来研究可通过扩大样本量,更全面地了解核桃炭疽病病原菌的分布情况,并通过田间试验验证室内筛选药剂的防治效果。与此同时,深入研究病原菌的抗药性机制,将为新型杀菌剂的开发提供理论支持。此外,开发综合防治策略,减少对化学药剂的依赖,将有助于实现更加可持续的病害管理。




 下载:
下载: