-
青蒿具有清热解暑,除蒸,截疟的功能,常用于暑邪发热,阴虚发热,夜热早凉,骨蒸劳热,疟疾寒热和湿热黄疸[1],其化学成分包括异蒿酮、桉油精、青蒿素等[2],多糖也是其成分之一.研究表明中草药多糖具有免疫增强作用,对机体的非特异性和特异性免疫功能具有显著的增强作用[3].青蒿多糖在体外能够有效地诱导淋巴细胞增殖转化,能够有效地促进淋巴细胞分泌IL-2和IFN-γ,在体内青蒿多糖能够明显地抑制小鼠S180瘤体生长,刺激低下的免疫功能和器官质量恢复到正常水平[4].本试验采用木瓜蛋白酶提取青蒿多糖,对其总糖质量分数及理化性质进行检测,并对青蒿多糖在小鼠体内的免疫调节作用进行初步探究.
全文HTML
-
青蒿(广西太华药业有限公司),木瓜蛋白酶(沃凯国药集团化学试剂有限公司),小鼠的IL-1β,IL-2,IL-6,IFN-γ检测试剂盒(购自上海联硕生物科技有限公司).
-
喷雾干燥仪器(常州,双环);DK-98-Ⅱ水浴锅(天津,泰斯特);TD-5A台式低速离心机(湖南,凯达);Uvmini1240紫外分光光度计(日本,岛津). AB104-L分析天平(瑞士,梅特勒),iMark全自动酶标仪(美国,Bio-Rad),1-14型微量离心机(美国,Sigma),WP25台式电热恒温培养箱(天津,泰斯特).
-
昆明种小鼠50只,SPF级,18~22 g,健康,雌、雄各半,购自广西医科大学动物实验中心.
-
参照以前所确定的方法[5]提取青蒿多糖并对其进行质量分数测定和理化性质分析.
-
用葡聚糖作为对照品,蒽酮-硫酸法测定青蒿多糖总糖质量分数[6].
-
采用Molish反应,碘-碘化钾和茚三酮反应检测青蒿多糖理化性质[7].
-
将50只昆明种小鼠随机分成5组,每组10只.待小鼠适应3 d后进行正式试验.第Ⅰ组为对照组,腹腔注射生理盐水;第Ⅱ组到第Ⅴ组为青蒿多糖组,分别腹腔注射青蒿多糖,剂量分别为25,50,100,150 mg/kg,连续给药7 d.于末次给药后次日,眼眶采血,分离血清,用试剂盒ELISA法检测血清中IL-1β,IL-2,IL-6和IFN-γ质量浓度.
-
用SPSS17.0软件对结果进行统计学分析,单因素方差分析检验差异的统计学意义,p<0.05表示差异具有统计学意义,p<0.01表示差异极具有统计学意义.
1.1. 材料
1.1.1. 主要试剂
1.1.2. 主要仪器
1.1.3. 动物
1.2. 方法
1.2.1. 青蒿多糖的制备
1.2.2. 青蒿多糖总糖质量分数测定
1.2.3. 青蒿多糖理化性质分析
1.2.4. 试验设计
1.2.5. 数据处理
-
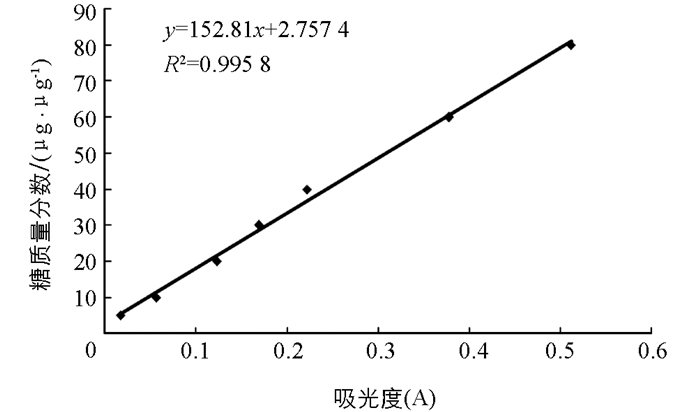
以葡聚糖作为对照品作标准曲线,得到回归方程y=152.81x+2.757 4(R2=0.995 8),见图 1.测得精制的青蒿精多糖管吸光度为0.062 9,经计算其质量分数为0.25 μg/μg.
-
Molish反应后青蒿多糖管中在糖液和浓硫酸的液面间形成紫色环,碘—碘化钾反应后青蒿多糖管中无颜色变化,茚三酮反应后青蒿多糖试管中颜色无变化.
-
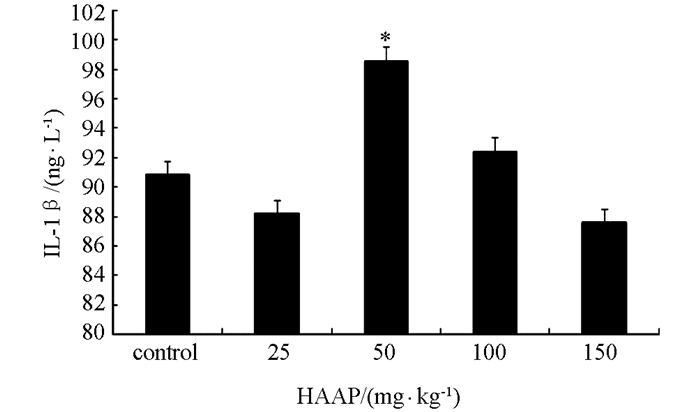
与对照组相比,50 mg/kg青蒿多糖组中IL-1β的水平升高极具有统计学意义(p<0.01),100 mg/kg青蒿多糖组的IL-1β水平均有提高,但是差异不具有统计学意义.而与对照组相比,25 mg/kg,150 mg/kg青蒿多糖组中IL-1β的水平有所降低,但与对照组相比差异不具有统计学意义(图 2).
-
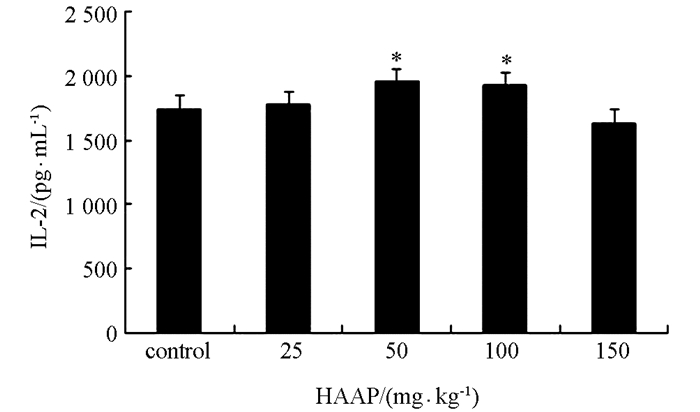
与对照组相比,50 mg/kg,100 mg/kg青蒿多糖组中IL-2的水平均升高极具有统计学意义(p<0.01).而与对照组相比,150 mg/kg剂量的青蒿多糖组IL-2的水平有所降低,但差异不具有统计学意义. 25 mg/kg剂量青蒿多糖组可提高IL-2的水平,但差异不具有统计学意义(图 3).
-
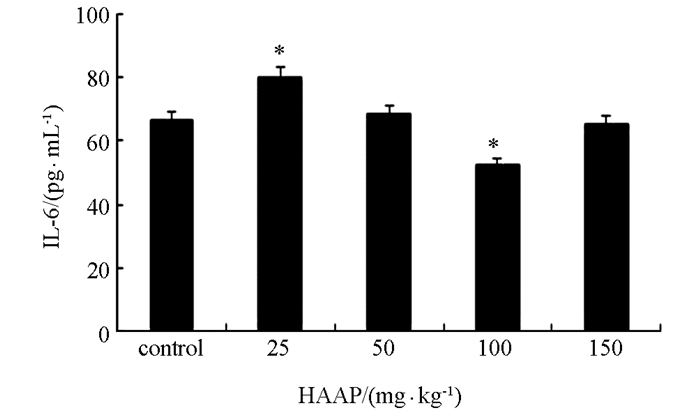
与对照组相比,25 mg/kg青蒿多糖组可提高血清中IL-6的水平,差异极具有统计学意义(p<0.01),50 mg/kg青蒿多糖组有所升高,但差异不具有统计学意义. 100 mg/kg剂量的青蒿多糖组则可降低IL-6的水平,与对照组相比差异极具有统计学意义(p<0.01). 150 mg/kg剂量的青蒿多糖组则可降低IL-6的水平,但与对照组相比差异不具有统计学意义(图 4).
-
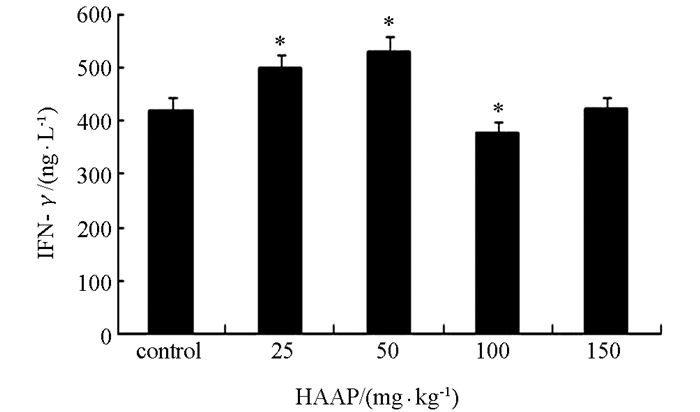
与对照组相比,25 mg/kg和50 mg/kg剂量的青蒿多糖可升高血清中IFN-γ的水平,且差异极具有统计学意义(p<0.01).而100 mg/kg青蒿多糖组则可极显著降低IFN-γ的水平(p<0.01). 150 mg/kg剂量的青蒿多糖对IFN-γ的水平无显著影响(图 5).
2.1. 青蒿多糖质量分数测定
2.2. 青蒿多糖理化性质分析
2.3. 青蒿多糖对小鼠血清中细胞因子水平的影响
2.3.1. 青蒿多糖对小鼠血清中IL-1β水平的影响
2.3.2. 青蒿多糖对小鼠血清中IL-2水平的影响
2.3.3. 青蒿多糖对小鼠血清中IL-6水平的影响
2.3.4. 青蒿多糖对小鼠血清中IFN-γ水平的影响
-
酶辅助提取法是利用酶反应的高度专一性将植物细胞壁降解,使得多糖被释放,从而被提取,此方法多糖提取率高.但是酶辅助提取法对实验条件要求高,需要考虑最适温度,pH值,最适作用时间,酶浓度等因素[8].蒽酮-硫酸比色法测定多糖的质量分数,方法稳定,几乎可以测定所有的碳水化合物,但要新鲜配制,蒽酮溶解于硫酸一次加入即可,简化了操作步骤,减少了产生误差的因素,且该方法所需仪器简单,可在常规试验条件下检测[9-11].而且此方法简单快速,具有灵敏度、精确度和准确性高、重现性好等优点[12].本试验采用木瓜蛋白酶法提取青蒿多糖后,使用蒽酮-硫酸比色法测定出青蒿精多糖的总糖质量分数为0.25 μg/μg,与前期研究结果相似[5]. Molish反应后青蒿多糖管中在糖液和浓硫酸的液面间形成浅色紫环,表明所提物质中有糖成分存在,碘—碘化钾反应后青蒿多糖管中无颜色变化,表明所提物质中不含淀粉,茚三酮反应后青蒿多糖试管中颜色无变化,表明所提物质中不含蛋白质或氨基酸.
IL-1β与IL-1α无种属特异性,IL-1在免疫方面参与NK细胞识别或溶解肿瘤的过程;通过诱导合成IFN并可与IFN协同作用于NK细胞,诱导前B细胞分化和表面IgM刺激的B细胞DNA合成,还可通过增加IL-2,IL-6,IFN-γ的合成或调节其受体而间接增强B细胞功能,促进抗体产生. IL-1还可通过诱生IL-2和其他细胞因子而间接扩大杀伤性T细胞的功能. IL-1还能刺激单核/巨噬细胞合成较高水平的IL-6和IL-4,在机体的炎症过种中起重要作用[13].据报道,一定剂量的黄芪、防风、地黄、蒲公英和板蓝根等中药多糖含药血清对IL-1β具有调节作用[14].本研究表明50 mg/kg青蒿多糖能够提高小鼠体内的IL-1β,从而起到免疫调节作用.
IL-2具有广谱的免疫增强活性,可诱导T与B细胞增殖分化,促进细胞毒性T前体细胞分化为细胞毒性T细胞,并增强其杀伤效应,并可促进NK功能及释放免疫干扰素,具有显著的抗肿瘤作用,并能抵御病毒性感染[15].有报道指出枸杞多糖和马尾藻多糖分别对鸡和猪的IL-2分泌有调节作用[16-17].本试验表明适当剂量(50 mg/kg,100 mg/kg)的青蒿多糖可显著升高小鼠体内的IL-2水平,并由此可见青蒿多糖能通过调节IL-2的水平,从而调节机体免疫功能.
IL-6可诱导B细胞增殖分化并产生抗体,主要作用于成熟的B细胞,产生免疫球蛋白IgM,IgG,IgA,还可促进PHA或conA激活的T细胞增殖生长[18].已有的研究表明杨桃多糖可提高小鼠脾细胞IL-6水平[19],黄芪杂多糖可调节猪血清中IL-6水平[20]. Th2细胞产生的主要细胞因子就包括IL-6,用25 mg/kg的多糖处理后IL-6浓度最高,其可能原因是刺激了Th2细胞分泌增强所致,随着多糖浓度的增加,对Th2细胞活性可能起到抑制作用,故IL-6质量浓度随着青蒿多糖浓度的增加而降低.
干扰素是重要的免疫调节分子,IFN-γ具有抗病毒、抑制细胞生长及诱导Ⅱ类主要组织相容性复合体抗原分子表达的作用,是细胞免疫的主要参与者,也是调节机体免疫功能重要的细胞因子,在调节机体免疫功能方面发挥着重要作用[21].研究表明灵芝多糖和当归多糖均明显促进外周血T淋巴细胞分泌IFN-γ[22],合适剂量的黄芪多糖、板蓝根多糖、山药多糖、牛膝多糖均能提高淋巴细胞IFN-γ的mRNA表达水平[23].本试验结果表明25 mg/kg,50 mg/kg的青蒿多糖可提高小鼠体内的IFN-γ质量浓度,而100 mg/kg的青蒿多糖对其有下调作用,可见青蒿多糖可通过调节IFN-γ质量浓度而对机体免疫功能加以调节.
Th1细胞主要产生Th1类细胞因子IL-2,TNF-β和IFN-γ;Th2细胞主要产生IL-4,IL-5,IL-6,IL-10和IL-13.正常情况下,机体中Th1/Th2细胞处于相对平衡状态,但机体发生功能异常时常表现出平衡偏向其中一方,此即为“Th1/Th2平衡漂移”.通过研究Th1/Th2细胞亚群漂移状态与人类疾病的关系及其发生机制,我们能够选择性地调节Th1或Th2细胞的水平,逆转其漂移状态,从而达到治疗某些特定疾病的目的[24].从诸多报道中可见,中药对Th1/Th2的平衡有一定的调节作用,并通过这一机制达到治疗疾病的目的[25].本试验结果显示50 mg/kg的青蒿多糖能显著提高IL-2和IFN-γ,对IL-6有一定的降低作用,提示青蒿多糖可能从调节Th1/Th2的平衡方面对机体的免疫功能起到调节作用.
-
用木瓜蛋白酶法提取的青蒿多糖条件温和,所提多糖中不含淀粉、蛋白质及氨基酸,精制后总糖质量分数较高.青蒿多糖对小鼠体内部分细胞因子的质量浓度影响与其使用剂量有关,在小鼠体内可对血清中IL-2,IFN-γ,IL-6等细胞因子质量浓度起到调节作用,而这3种细胞因子主要是由Th1或Th2细胞产生,其质量浓度的改变提示青蒿多糖可能从调节Th1/Th2的平衡方面对机体的免疫功能起到调节作用.



 下载:
下载: