-
颠茄(Atropa belladonna L.)为茄科颠茄属,多年生草本植物,有效化学成分为托品烷类生物碱(Tropane Alkaloids,TAs),主要为莨菪碱、东莨菪碱以及阿托品,是我国药典规定的唯一托品烷类生物碱的药源植物[1-3].莨菪碱和东莨菪碱已在临床上广泛应用,主要用于镇痛、麻醉、抗晕动症、治疗帕金森症、改善微循环、戒毒脱瘾、治疗农药中毒等,市场需求十分巨大[2].
颠茄中莨菪碱和东莨菪碱的主要合成场所在根[4],杨春贤等[5]用农杆菌A4侵染颠茄无菌苗真叶,得到颠茄毛状根.毛状根基本具有植株根的生长功能,具有生长快、分化程度高以及代谢与遗传性能相对稳定等优点,是植物次生代谢产物生产可持续发展的有效途径之一[6].虽然毛状根可在无激素培养基上快速自主生长,且具有次生代谢产物高而稳定的特点,但建立其合适的生长和次生代谢产物产生的离体培养条件,是应用毛状根培养来规模生产其次生代谢产物的前提条件.已有的研究表明,培养基类型是影响毛状根生长和次生代谢产物的一个重要影响因素[7-8],如在供试MS,1/2 MS,B5和1/2 B5培养基中,B5培养基最适宜新疆紫草毛状根的固体培养及生长[9].姚庆收等[10]研究发现1/2MS和MS培养基有利于花生毛状根生物量的积累,而B5和N6培养基有利于其白藜芦醇的积累.但至今为止,未见有关培养基类型对颠茄毛状根生长和次生代谢产物产生的影响.因此,本研究以颠茄毛状根为试验材料,比较颠茄毛状根在B5,MS,N6 3种不同培养基中的生长与次生代谢产物的积累状况,从而为进一步优化并建立适宜的颠茄毛状根培养条件奠定理论基础.
HTML
-
颠茄毛状根由西南大学生命科学学院天然产物与代谢工程实验室保存. 25 ℃,110 r/min,黑暗下悬浮培养.
-
MS,B5,N6[11]3种液体培养基,添加蔗糖30 g/L,MS,N6培养基pH值为5.8,B5培养基pH值为5.5.
-
LC-60A高效液相色谱仪(泵:LC-20AD,柱温箱:CTO-10AS vp,控制器:SPD-20A),日本岛津(Shimadzu);Ultimate XB-C18液相色谱柱(4.6×250 mm,5 μm),月旭科技(上海)股份有限公司;SIGMR 3K15冰冻离心机,北京五洲当方科技发展有限公司;QYC200摇床,上海福玛实验设备有限公司.莨菪碱和东莨菪碱标准品均购自Sigma;植物组织培养所用的蔗糖,冰醋酸,β-巯基乙醇,氯仿,乙酸铵,SDS,氨水等,购自重庆川东化工试剂厂或成都市科龙化工试剂厂;HPLC流动相所用的甲醇为色谱纯,购自天津市光复精细化工研究所.
-
取等量(约0.1 g)来自同一克隆的毛状根,分别接种于装有150 mL无菌MS,B5或N6液体培养基的三角瓶中,置于25±1 ℃,110 r/min转速的摇床中暗培养,并分别于7 d,14 d,21 d后,用蒸馏水冲洗颠茄毛状根上残留的液体培养基,滤纸吸干水分,称其鲜质量后,再取颠茄毛状根置于60 ℃烘箱中烘至质量恒定,并称干质量.
-
取培养21 d的颠茄毛状根于60 ℃烘箱中烘至质量恒定后,检测毛状根中托品烷类生物碱的质量分数.参照Zárate R等[12]的提取方法,略有改动:取上述60 ℃烘干至恒质量的颠茄毛状根,充分研磨成粉过50目筛后,称取0.1 g干粉加入10 mL三氯甲烷-甲醇-氨水(15:5:1) 提取液超声提取30 min,25 ℃室温放置过夜后滤纸过滤,用2 mL CHCl3冲洗2遍,合并滤液;40 ℃真空浓缩至干,残留物用5 mL CHCl3和2 mL 1 mol/L H2SO4溶解,收集硫酸相,于冰浴中用浓氨水调pH值至10,再分两次加入4 mL CHCl3提取;静置分层后收集氯仿层,于40 ℃真空浓缩至干,1 mL甲醇溶解,为样品液;用0.22 μm滤膜过滤样品液,-4 ℃保存备用.
日本岛津(Shimadzu)LC-60A高效液相色谱仪,色谱条件:Ultimate XB-C18液相色谱柱(5 μm,4.6×250 mm),流动相甲醇与醋酸缓冲液(0.05 mol/L醋酸铵,pH值为4.6) 比例为58:42,0.0025 mol/L SDS,流速1.0 mL/min,检测波长215 nm,柱温40 ℃,进样量:10 μL.分别精密称取莨菪碱和东莨菪碱标准品(Sigma公司产品),分别配制成质量浓度为100 μg/mL,200 μg/mL,300 μg/mL,400 μg/mL,500 μg/mL的标准品贮备液,按照上述的HPLC检测条件进行测定,根据峰面积(Y)对标准品质量浓度(X)绘制标准曲线,并分别计算出莨菪碱和东莨菪碱的线性回归方程.东莨菪碱线性回归方程为
莨菪碱的线性回归方程为
1.1. 材料
1.1.1. 颠茄毛状根
1.1.2. 培养基
1.1.3. 仪器与试剂
1.2. 方法
1.2.1. 毛状根生长测定
1.2.2. 毛状根中托品烷类生物碱质量分数检测
-
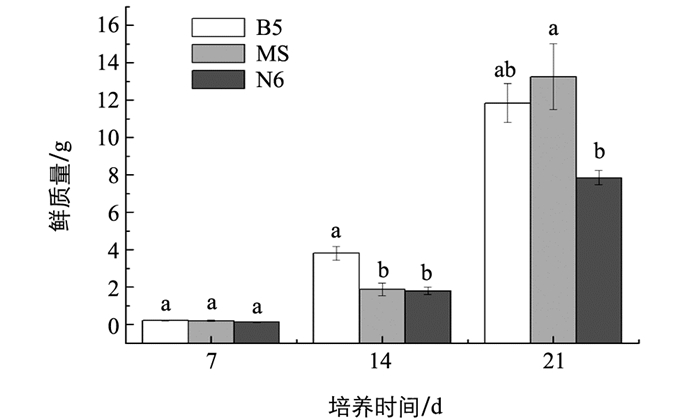
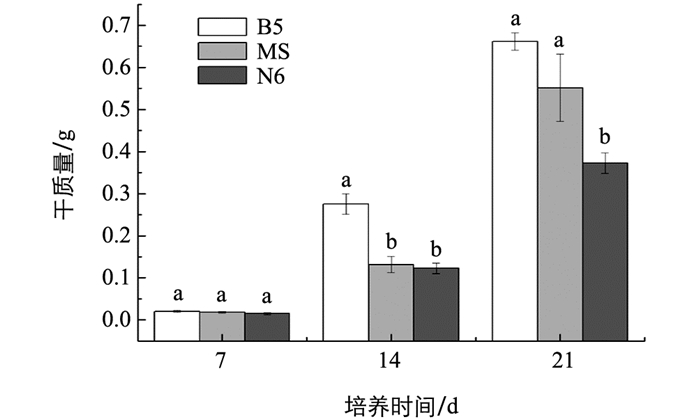
颠茄毛状根暗培养7 d后,在MS,B5,N6 3种培养基中的生长差异无统计学意义.培养14 d后,B5培养基中的毛状根生物量增长最显著.培养21 d后,MS培养基中的鲜质量为13.2 g,B5培养基中的毛状根鲜质量为11.8 g(图 1).这两种培养基中的毛状根生长量增长明显(图 1,图 2),统计结果为3个重复平均值±标准差,字母相同表示差异无统计学意义(p>0.05).观察生长21 d颠茄毛状根的生长状况,发现B5和N6培养基的根系较粗壮白嫩,分支较少. MS培养基中的根分支较多,根体细软变黄,含水量较高(图 3).因此,虽然B5培养基和MS培养基中的毛状根生长量差异无统计学意义,但是B5培养基中的毛状根粗壮,生长状况更好.
-
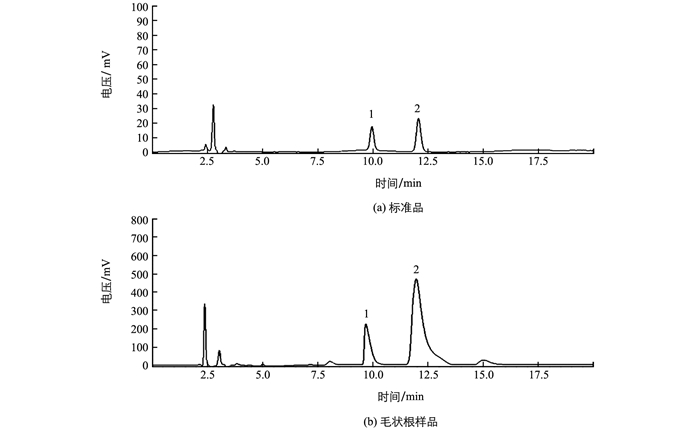
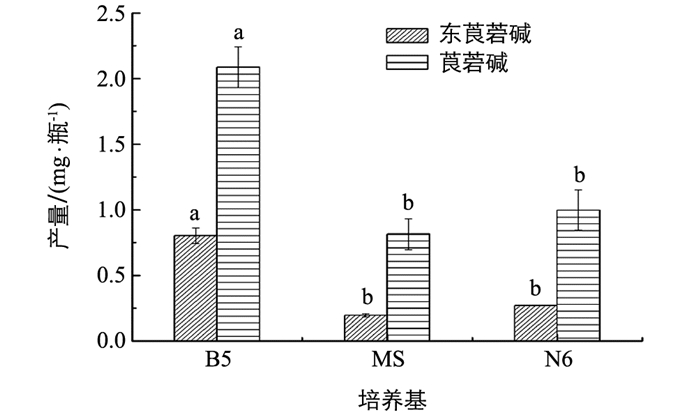
采用HPLC方法检测不同培养基培养的毛状根中东莨菪碱和菪碱质量分数.东莨菪碱对照品的保留时间为9.871 min,莨菪碱对照品的保留时间为11.682 min,样品中东莨菪碱和莨菪碱的保留时间与对照品基本一致,见图 4.图 5为培养基类型对21 d颠茄毛状根托品烷类生物碱质量分数的影响.从图 5可见,培养21 d后,B5培养基中毛状根的东莨菪碱质量分数为1.2 mg/g,是MS培养基中的3.4倍,莨菪碱质量分数为3.1 mg/g,是MS培养基中的2.1倍;而N6培养基培养的毛状根东莨菪碱质量分数为0.7 mg/g,莨菪碱质量分数为1.8 mg/g,分别为MS培养基的2.0倍和1.8倍.可见,B5和N6培养基中的毛状根东莨菪碱和莨菪碱质量分数均显著高于MS培养基,但B5培养基培养的莨菪碱和东莨菪碱质量分数的增加量更大(图 5).图 6为3种培养基对颠茄毛状根托品烷类生物碱产量的影响.从图 6可见,虽然N6培养基培养的毛状根生物碱质量分数显著高于MS培养基,但由于N6培养基培养的毛状根生长量明显低于MS培养基,因而在培养21 d后,MS和N6培养基单瓶毛状根中的生物碱产量差异无统计学意义.而B5培养基中的生物碱质量分数显著高于MS培养基,两组培养基的毛状根生物量差异不大,所以,B5培养基中单瓶毛状根的生物碱产量最高,显著高于MS和N6培养基(图 6).
2.1. 不同培养基对颠茄毛状根生长的影响
2.2. 不同培养基对颠茄毛状根托品烷类生物碱质量分数的影响
-
不同类型的培养基由于所含组分及其比例不同,对毛状根生长与次生代谢产物的积累有不同的影响[13-15].本试验所用的3种类型培养基成分各不相同,MS培养基是富集元素平衡的培养基,营养元素全面,成分丰富[16-17];B5和N6培养基是高硝酸钾培养基.本试验显示:颠茄毛状根培养14 d时,B5培养基中的生物量最高,而21 d时MS培养基培养的颠茄毛状根生物量最高,显著高于N6培养基.这可能是由于颠茄毛状根在生长前期生长速度较慢,对营养元素需求较少,而在14 d后细胞分裂和生长等复杂生化过程加快,所需营养全面,从而MS培养基有助于颠茄毛状根生物量的积累.而N6培养基营养物质种类相对较少,故相同时间内生物量积累少.说明不同培养基对毛状根生物量的影响较大,选择适合颠茄毛状根培养的基本培养基,是提高其生物量的前提.
铵态氮和硝态氮的比例也是影响培养基中毛状根生长和次生代谢产物产生的因素之一[18-21].本试验中,培养21 d时B5和N6培养基有利于莨菪碱和东莨菪碱的产生,显著优于MS培养基.这可能是由于B5和N6培养基属于高硝酸钾培养基,二者所含硝态氮比例高,MS培养基所含铵态氮比例较高.而高硝态氮有助于促进颠茄毛状根次生代谢,更有利于含氮生物碱的积累,从而提高了B5和N6培养基培养的颠茄毛状根的莨菪碱和东莨菪碱质量分数.又因B5培养基培养的颠茄毛状根生物量显著高于N6培养基,故B5培养基培养的颠茄毛状根莨菪碱与东莨菪碱产量最高.
试验表明根据单一的生物量或莨菪碱与东莨菪碱质量分数,并不能判定某种培养基是最适合的颠茄毛状根培养的培养基,需要结合生物量和莨菪碱、东莨菪碱质量分数共同判定.在本试验的B5,MS,N6 3种类型的培养基中,B5培养基不仅有利于生长,也对托品烷类生物碱的合成有促进作用,可作为颠茄毛状根培养的基本培养基.今后应向寻求颠茄毛状根生长速度和莨菪碱、东莨菪碱质量分数达到最佳结合的培养基探索,使之达到生产上的更大效益.








 DownLoad:
DownLoad: