-
我国西南岩溶地区是世界上最大的一片裸露、半裸露岩溶区,以分布面积最大、发育最强烈、发育最典型、发育种类最全、生态环境最脆弱著称[1].重庆是我国碳酸盐分布最广、喀斯特发育最强烈的省区之一,全市碳酸盐裸露面积多达3万km2,占全省总面积的40.02%,喀斯特地区居民占全省人口总数的34.6%[2].碳酸盐抗风蚀能力强,硅酸盐含量低,造壤能力差,成土速率慢;长期的岩溶作用导致地表保水能力差,夏季暴雨冲击后岩石裸露,加之过伐、过垦等不合理的人类活动,人地矛盾更加突出,已经形成了连片半裸露的石山,严重威胁了当地居民的生活[3-4].
对于土壤微生物多样性的研究方法,多数基于纯培养、DGGE和构建克隆文库.据调查,土壤中微生物的可培养率仅为0.1%~1%[5-6],为获得更多不能分离培养的土壤微生物信息,非培养研究为生物多样性的方法应运而生. DGGE和克隆文库均是以传统分子生物学方法——Sanger测序方法为基础的,但由于DGGE可用于分析的片段长度太短,分类信息不够准确,常导致相近的微生物无法区分;而克隆文库方法耗时耗力,花费巨大,只有在克隆数目足够多的情况下才能完整地反应土壤微生物情况[7].近年来,第二代测序方法的出现解决了上述方法通量低、信息量少、耗时长的问题,逐渐成为土壤微生物多样性研究方法的主流[8].原核微生物的16s rRNA/rDNA和真核微生物的18s rRNA/rDNA或ITs rDNA序列都具有一定的保守性,这些保守序列为全体微生物所共有,保守序列中由于进化形成的部分可变区域造成了序列差异性,这些差异性的测定和比对常用于鉴定微生物种类和揭示微生物群落的多样性.
为进一步探索适应石漠化地区特殊生境的微生物种群,加快推动微生物肥料的研发,促进桑树及其他生态树种对石漠化生境的恢复功能的发挥,本研究以石漠化地区长势良好的桑林根际土壤为实验材料,对生态桑林根际土壤微生物群落多样性进行了16s和ITs测序分析,旨在为石漠化地区微生物肥料设计研究提供依据.
HTML
-
于2015年10月在重庆市武隆县长坝镇石漠化区域选样地约700 m2,采用五点取样法,按梅花形确定5个样方,样方是边长3 m的正方形,分别从5个样方内选取3株长势良好的4年生桑树,在其根茎部周围半径0~20 cm范围内去除枯枝落叶后,取水平深度为0~15 cm的根际土壤各100 g,去掉其中的石块、杂草及植物根系等杂质,将每个样方中的土壤混匀后编号,用灭过菌的50 mL塑料离心管装好,并分别做好标记,置于冰盒中运回实验室,然后贮存于4 ℃冰箱中,备用.
采样地点地理坐标为29.30°N,107.50°E,海拔高度608.0 m,精度±4.0 m.气候类型为亚热带湿润季风气候,年平均气温为11.1 ℃,夏季最高平均气温为24.7 ℃,冬季最低平均气温为-2 ℃;年降水量为1 411 mm,年平均降水量为118 mm,夏季最高平均降水量为200 mm,冬季最低平均降水量为27 mm,所采集的土壤类型为黄壤.采样所在地周围植物种类主要有:桑树,栎树,构树,桕树,山麦冬,鬼针草,狗尾巴草,红果子,绞股兰,野人参(红),青蒿,车前草,黄荆,首乌,翠芸苔,斑茅和菊花等.
-
土壤微生物总DNA的提取按照ZYMO RESEARCH微量土壤微生物DNA提取试剂盒说明书进行.
-
将检测后合格的土壤微生物总DNA样品送至成都Rhonin生物科技有限公司,使用通用的16s rRNA基因引物对515F/806R,ITs引物对ITS4/ITS3-KYO2进行PCR扩增,进行16s和ITs序列的扩增、测序.
-
经Illumina公司MiSeq Reagent Kit v3(MS-102-3003) 测序得到的序列,首先用QIIME软件进行序列拼接,同时进行序列过滤,得到可进行后续分析的高质量目标序列后,16s rDNA基因使用RDP数据库进行比对,ITs使用UNITE数据库进行比对,用Usearch,QIIME或Mothur软件进行生物信息学分析,后续统计与作图使用R软件完成,使用Excel对结果进行进一步的统计与分析.
1.1. 材料
1.2. 方法
1.2.1. 土壤微生物总DNA提取
1.2.2. PCR分析
1.2.3. 数据分析
-
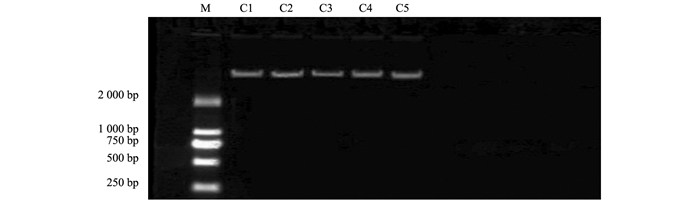
土壤微生物基因组总DNA提取按照按照ZR微量土壤微生物DNA提取试剂盒说明书进行,获得的DNA用100 μL DNA洗脱液洗脱后,转移至预先准备好的Zymo-Spin TM Ⅳ-HRC旋转过滤柱中离心,去掉土壤微生物基因组总DNA中残留的腐殖酸,用1.0%琼脂糖凝胶电泳检测提取的DNA质量(图 1),泳带清晰,杂质较少,无拖尾现象.
-
将所得的OTUs用RDPclassifier贝叶斯算法或Uclust分类法对97%相似水平的OTU中具有代表性的序列进行分类学分析,将获得的门分类水平的数据统计桑根际土壤中原核微生物、真核微生物的群落组成.
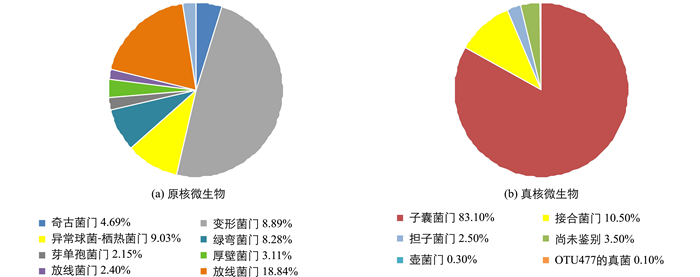
土壤16s测序分析结果反应了土壤细菌和古生菌的群落多样性,由图 2可得,在石漠化地区原核微生物中,排在前5位的门依次是:变形菌门(Proteobactera)、放线菌门(Actinobacteria)、异常球菌-栖热菌门(Deinococcus-Thermus)、绿弯菌门(Chloroflexi)和奇古菌门(Thaumarchaeota). 图 2.2.3中ITs测序分析所反映的土壤真菌群落门水平分析表明,约83.1%的真菌属于子囊菌门(Ascomycota),其次为接合菌门(Zygomycota),约10.5%,担子菌门(Basidomycota)仅为2.5%.
-
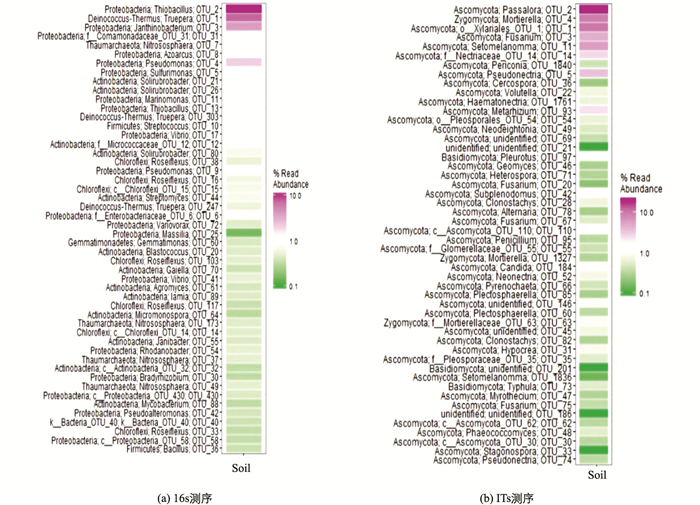
门以下水平分析热图可用于表示样品在不同分类层次水平上的群落组成和丰度.其中横坐标代表样品名称,纵坐标是按照属(Genus)的平均丰度排列的,用颜色深浅表示,图 3中显示了50个平均丰度最高的OTU所对应的属名.
在石漠化地区桑树根际土壤原核微生物群落中,变形菌门的硫杆菌属(Thiobacillus)、紫色杆菌属(Janthinobacterium)和假单胞菌属(Pseudomonas)以及异常球菌-栖热菌门(Deinococcus-Thermus)的特吕珀菌属(Truepera)为优势属;真核微生物群落中,子囊菌以及接合菌真菌为优势.
2.1. 土壤微生物总DNA提取电泳结果
2.2. 土壤微生物16s和ITs片段测序热图
2.2.1. 土壤微生物测序门水平分析
2.2.2. 土壤微生物测序热图
-
土壤微生物群落在不同环境的生态系统中会有不同的体现,特别地,在石漠化生态系统中,优势菌种的存在是对当前生境长时间的适应与调整所形成的,甚至若干有害微生物的存在也是石漠化土壤生态系统保持平衡的微观体现.
-
在石漠化生态桑林根际土壤细菌和古生菌群落中占据优势的硫杆菌属细菌具有硫元素氧化功能,研究证实,接种硫杆菌属细菌能够降低土壤中可交换钠的含量,促进土壤中盐分的渗出,特别是钠盐,降低植物受土壤盐胁迫的可能性[9];另外被证明能与根内球囊霉(Glomus intraradices)——丛枝菌根真菌(Arbuscular mycorrhizal fungi)的一种——协同提高玉米吸收土壤养分的能力[10],是能适应石漠化地区极端环境的有益细菌物种之一.而紫色杆菌属(Janthinobacterium)和假单胞菌属(Pseudomonas)细菌均属于土壤中广泛存在的优势未培养细菌属[11].异常球菌-栖热菌门包括一些能抵抗残酷环境的球状细菌;同时已有实验证明,在受碳氢化合物污染的土壤中,异常球菌-栖热菌门细菌数量发生上调[12],推测该门下的细菌可能具有高效消化土壤有机物的能力.
-
在石漠化生态桑林根际土壤的几种优势真菌中,只有接合菌门的被孢霉属被确定为土壤有益微生物,该门下包含了AM真菌[13].被孢霉属真菌具有溶解土壤中的磷的功能,实验证明,被孢霉属真菌与AM真菌中的摩西球囊霉(Glomus mosseae)双接种能显著降低盐胁迫对土壤的不良影响并显著提高土壤酶活性[14].除此之外的几种优势真菌中,钉孢属真菌常寄生于植物地上部位引起病害[15];类似地,炭角菌属真菌大多为腐生性,少数为寄生性,大多寄生于腐木上,对木质素降解有一定作用[16];镰孢菌属真菌是土壤真菌的主要类群,该属真菌是植物萎蔫病和根腐病的主要病原菌[17];而Setomelanomma属真菌研究极少,2014年首次在国内发现,且仅停留在形态学、系统发育学研究水平,其具体生态功能尚不清楚[18].
3.1. 土壤原核微生物在石漠化地区的生态适应性分析
3.2. 土壤真核微生物在石漠化生境的生态功能分析
-
本研究利用高通量测序方法对石漠化地区桑树根际土壤进行了土壤细菌、古生菌和真菌进行了群落多样性测序分析,结果表明:在测序分析所得的土壤中优势微生物群落中,① 有益微生物包括变性菌门的硫杆菌属、紫色杆菌属和假单胞菌属细菌,异常球菌-栖热菌门的特吕珀菌属细菌以及接合菌门的被孢霉属真菌等;② 与植物病变、腐化有关的真菌种类为子囊菌门(Ascomycota)的钉孢属(Passalora)、炭角菌属(Xylaria)真菌;③ Setomelanomma属真菌的功能尚不明确.以上实验结论将为石漠化地区生态桑林及其他生态树种的生物肥料研发提供参考,为进一步实现石漠化地区的生态修复奠定基础,而本实验所得出的优势微生物群落的具体功能及它们之间的协作关系仍有待进一步探究.






 DownLoad:
DownLoad: