-
苹果醋是鲜榨苹果经过液态或固态发酵所获得的苹果原醋[1],再加以调制而成的醋饮料,由于具有特有的苹果香气物质而备受消费者青睐[2],已经成为果醋饮料、调味品和保健营养食品等行业普遍运用的主要原料醋[3].
乙酸-2-苯乙酯(acetic acid 2-phenylethyl ester,C10H12O2,103-45-7),具有水果香味的酯类化合物,是果品加工发酵过程中主要的特征性香气成分和风味物质[4-5].目前,关于乙酸-2-苯乙酯的研究主要集中在白酒[6-7]、啤酒[8]、葡萄酒[9-10]、米酒[11]、脐橙酒[12]、甘薯酒[13]、酒醅[14]等酿酒行业,刺梨果汁[15]、马铃薯醋[16]、麸醋[17]、醋醅[18]等酿醋行业,以及香精[19]、烟草[20]、玫瑰[21]、链球菌[22]等其他领域.国外学者在酵母发酵酒精类饮料(如啤酒、清酒)的过程中,发现酯类化合物的合成途径有两条:①在酯酶(Esterase)的催化下由酸类和醇类缩合而成,酯酶是一种可逆酶,发酵液中的酯也可能被该酶水解成相应的醇和脂肪酸;②在醇酰基转移酶(AAT)的作用下由酰基辅酶A和醇类形成[23-24].目前,可以通过化学酶法[25-27]和氨基磺酸催化酯化合成法[28]检测酯类化合物的合成途径.然而,有关苹果醋发酵过程中酯类化合物乙酸-2-苯乙酯合成途径的研究还未见报道.
本试验针对苹果醋动态发酵的不同时间段进行取样,采用HS-SPME-GC-MS技术,通过反应体系跟踪法和外源加标法,初步分析乙酸-2-苯乙酯的合成途径与调节,为苹果醋制品香气成分和风味物质的深入研究和其关键工艺控制点提供一定的参考依据.
HTML
-
富士苹果,甘肃庆阳.
菌种1750,20056,购于中国食品发酵工业研究院有限公司.
-
马铃薯培养基:马铃薯200g,葡萄糖20g,自来水1 000 mL,pH值为6.0;液体培养基:葡萄糖1%,酵母粉1%,pH值为4.5.
121 ℃,30 min高压灭菌,备用.
-
氢氧化钠(粒):分析纯,天津大茂;葡萄糖:上海广诺;酵母粉:北京奥博星;琼脂:上海致化;无水乙醇、碳酸钙:天津光复;果胶酶(>50 000 u/g):上海源聚;乙酸、乙醇、β-苯乙醇、乙酸-2-苯乙酯:色谱纯,上海阿拉丁;3-辛醇:色谱纯,589-98-0,美国Sigma;L-苯丙氨酸(99.5%):食品级,湖南奥驰;植物乙酰辅酶A(A-CoA)ELISA试剂盒、植物醇酰基转移酶(AAT)ELISA试剂盒、植物酯酶(Esterase) ELISA试剂盒:北京冬歌.
-
BSA224S-CW电子天平:赛多利斯;YXQ-LS立式压力蒸汽灭菌锅:上海博讯;ZHJH-C1112B超净工作台:上海智城;ZWY-2102恒温培养振荡器:上海智城;LRH-250生化培养箱:上海一恒;TGL-16MC冷冻离心机:长沙维尔康;HH-S4电热恒温水浴锅:北京科伟;KDM-2000型可调式电热套:北京科伟;PZJ-0.5型榨汁机:江苏科威;三重四级杆气质联用仪:GC(TRACE 1310),MS(ISQ-LT),美国赛默飞世尔;Synergy H1酶标仪:Gene Company Limited.
-
富士苹果→选、洗、榨→弃苹果渣→果胶酶处理苹果汁→酵母菌液(酒精发酵)→醋酸菌液(醋酸发酵)→陈酿→苹果醋
-
用75%酒精棉擦拭菌种冻干管表面进行消毒,将管顶端在酒精灯外焰上均匀加热;在加热部位立即滴2~3滴无菌水,用镊子敲打使管壁破裂;用无菌吸管吸取0.5 mL左右液体培养基于冻干管中将冻干菌粉全部溶解;将溶解后的菌悬液转移至盛有5 mL液体培养基的试管中,将试管于24 ℃(CICC1750)/ 28 ℃(CICC20056)恒温培养箱内静置培养.因为菌种经过冻干保藏后,处于休眠状态,一代菌种需适当延长培养时间,转接至2~3代恢复活力,备用.
-
将富士苹果首先分选、清洗,然后破碎、榨汁,最后添加0.04%果胶酶,45 ℃酶解1 h,90 ℃杀菌10 min,过滤,备用.
-
苹果汁1 000 mL,首先接入8%酵母菌液,24 ℃,密封,进行酒精发酵,连续检测苹果汁发酵液中酒精体积分数不增加、糖度不降低时,结束酒精发酵;然后接入10%醋酸菌液,28 ℃,进行醋酸发酵.对苹果醋发酵过程中不同时间段进行取样,分别检测酒精度和醋酸质量浓度.
-
在李小慧[29]、张雪寒等[30]、周倩等[31]报道的香气成分分析方法的基础上进行优化,获得符合苹果醋发酵过程中挥发性物质分析的HS-SPME-GC-MS条件,具体如下:
1) 顶空固相微萃取法:样品前处理采用SPME法处理,分别取5 mL样品加入50 μL 3-辛醇内标,漩涡混匀,装入15 mL顶空瓶中,样品由TriPlus RSH Autosampler-SPME系统处理,萃取头:50/30 μm DVB/CAR/PDMS萃取头.萃取条件:60.0 ℃吸附40 min,保温5 min.外标标准品母液1 000 mg/L,100 mL纯乙醇+ 0.1 g外标(乙酸、β-苯乙醇、乙酸-2-苯乙酯),外标测试样品准备A液10 mL(4%乙醇溶液)+10 μL待测母液,样品瓶5 mL+50 μL 3-辛醇内标.
2) 气相色谱GC条件:进样口温度25 ℃,载气He,流速1.2 mL/min.进样量1 μL,分流进样,分流比40:1.色谱柱为DB-WAX(30 m×0.25 mm×0.25 μm),升温程序40 ℃恒温2 min,以5 ℃/min升至180 ℃,然后从15 ℃/min升到230 ℃,5 min.
3) 质谱MS条件:EI电离子源,电子能量70eV,离子源温度200 ℃,接口温度250 ℃.扫描范围33.00~350.00 amu.
4) 酒精度[32]:以乙醇计,GB 5009.225-2016,密度瓶法测定.
-
利用北京冬歌生物科技有限公司ELISA试剂盒进行乙酰辅酶A,AAT,Esterase酶活性的测定,即采用双抗体一步夹心法酶联免疫吸附试验,根据试剂盒说明,依次加入待测样品10 μL,标准品50 μL,HRP标记的检测抗体100 μL,37 ℃温育后洗涤.底物TMB颜色的深浅和样品中的植物乙酰辅酶A(A-CoA),AAT,Esterase呈正相关.用酶标仪测定450 nm波长处各孔的OD值,计算样品酶活浓度.
-
试验数据采用Microsoft Excel 2010和SPSS 19.0软件进行统计分析,采用Origin 8.5软件作图.
1.1. 材料与试剂
1.1.1. 材料
1.1.2. 培养基
1.1.3. 试剂
1.2. 试验仪器
1.3. 试验方法
1.3.1. 工艺流程
1.3.2. 菌种活化
1.3.3. 苹果汁制备
1.3.4. 酒精发酵和醋酸发酵
1.3.5. 测定方法
1.3.5.1. 挥发性物质
1.3.5.2. 乙酰辅酶A,AAT,Esterase酶活性[33]
1.4. 数据处理
-
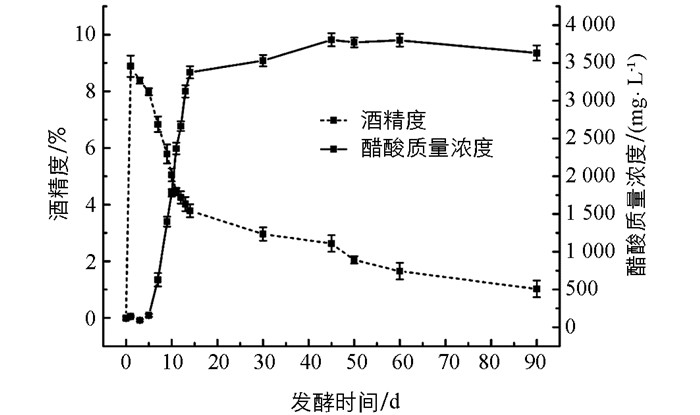
苹果醋动态发酵过程包括酒精发酵和醋酸发酵,检测到苹果汁发酵液在第7 d的酒精体积分数不再增加、糖度不再降低,即酒精发酵结束;然后接入醋酸菌液进行醋酸发酵和陈酿.从图 1可以看出,随着发酵时间的增加,酒精度达到峰值后开始降低,而醋酸质量浓度逐渐升高后趋于平缓.这是因为在苹果醋发酵过程中,酒精发酵是葡萄糖通过EMP途径生成丙酮酸,丙酮酸脱羧生成乙醛,乙醛进一步被还原为乙醇,进而醋酸发酵将乙醇在脱氢酶的催化下生成乙酸,多种微生物参与调控苹果醋发酵的整个阶段.
-
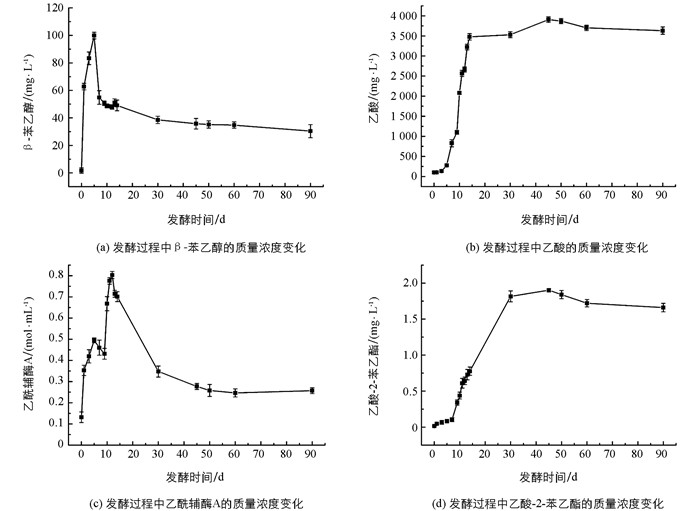
苹果醋动态发酵过程中,与乙酸-2-苯乙酯合成直接相关的组分有β-苯乙醇、乙酸和乙酰辅酶A.从图 2可以看出,发酵液中β-苯乙醇在第5 d达到最大值99.84 mg/L,接着大幅度下降后趋于平稳(图 2a);乙酸质量浓度从第5 d开始大幅度升高,第14 d后保持平缓增长(图 2b);乙酰辅酶A在第12 d达到最大值后开始下降(图 2c);乙酸-2-苯乙酯质量浓度从第7 d开始急剧增高,在发酵第30 d达到最高值,然后虽稍有下降,但仍然保持较高水平(图 2d).
-
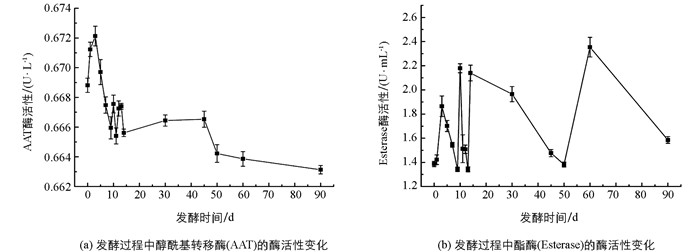
苹果醋动态发酵过程中,与乙酸-2-苯乙酯合成途径直接相关的酶有醇酰基转移酶(AAT)、酯酶(Esterase).从图 3a可以看出,随着苹果醋发酵时间的延长,AAT酶活性在酒精发酵第3 d达到峰值后开始大幅度下降,直至苹果醋陈酿第90 d降至最低,表明AAT在苹果醋发酵前期逐渐积累,发酵后期快速消耗;Esterase酶活性呈“M”形变化规律,即呈现先上升后下降至某水平再次出现先上升后下降的动态变化趋势,酯酶是一种可逆酶,既可以催化发酵液中的酸和醇缩合生成相应的酯,又可以将生成的酯水解成相应的酸和醇(图 3b).
-
根据苹果醋发酵液中相关基质质量浓度和AAT,Esterase酶活性变化的相关系数,可以确定合成乙酸-2-苯乙酯各基质变量之间相互关系的密切程度,初步推测乙酸-2-苯乙酯的合成途径.本试验从乙酸-2-苯乙酯已经大量、充分形成,但还没有完全进入目标物质合成阶段的时间点开始进行相关性统计分析.从表 1可以发现,乙酸-2-苯乙酯与β-苯乙醇,乙酸,乙酰辅酶A,AAT,Esterase之间均存在一定的相关性,表明在苹果醋发酵过程中同时存在合成乙酸-2-苯乙酯的酯酶途径和醇酰基转移酶途径,β-苯乙醇,乙酸,乙酰辅酶A,AAT和Esterase都是影响乙酸-2-苯乙酯合成途径的限制性因素.此外,相关系数的绝对值越大,相关性越强.乙酸-2-苯乙酯与乙酰辅酶A的相关系数绝对值大于乙酸-2-苯乙酯与乙酸的相关系数绝对值,乙酸-2-苯乙酯与AAT的相关系数大于乙酸-2-苯乙酯与Esterase的相关系数,表明乙酸-2-苯乙酯的合成与乙酰辅酶A,AAT的相关程度更高,初步推测合成乙酸-2-苯乙酯的主要途径可能是醇酰基转移酶途径,醇酰基转移酶可能是关键酶.
-
在苹果醋动态发酵过程中的不同发酵阶段,通过外源加标法检测乙酸-2-苯乙酯的生成量.因为酵母自身合成β-苯乙醇浓度比较低,而以L-苯丙氨酸为底物,由酵母细胞生物催化合成β-苯乙醇的主要途径包括:L-苯丙氨酸通过转氨酶作用形成苯丙酮酸,苯丙酮酸在苯丙酮酸脱羧酶作用下脱羧形成苯乙醛,苯乙醛再通过醇脱氢酶催化生成β-苯乙醇.所以,L-苯丙氨酸可作为食品添加剂加入发酵液中,通过艾利希途径[34]能使发酵液中香气成分和风味物质的生成量大幅度提高.从图 4可以看出,和对照样相比,随着L-苯丙氨酸添加量的增加,乙酸-2-苯乙酯的质量浓度极显著增加(图 4a,p<0.01),同时也发现苹果醋发酵过程中醋酸质量浓度也随着L-苯丙氨酸添加量的增加而极显著增加(图 4b,p<0.01).其中,当L-苯丙氨酸添加量大于8 g/L时,乙酸-2-苯乙酯和醋酸的质量浓度均降低.综上所述,L-苯丙氨酸既可以增加特征性香气成分乙酸-2-苯乙酯的生成量,又可以增加苹果醋发酵过程中的醋酸质量浓度,具有剂量依赖性,初步将8 g/L作为L-苯丙氨酸的最佳添加质量浓度.
2.1. 苹果醋发酵过程中酒精度和醋酸质量浓度变化
2.2. 特征性香气成分乙酸2苯乙酯的合成途径
2.2.1. 合成乙酸-2-苯乙酯相关基质的浓度变化
2.2.2. 合成乙酸-2-苯乙酯的主要酶活性变化
2.2.3. 合成乙酸-2-苯乙酯各基质的相关性分析
2.3. 特征性香气成分乙酸2苯乙酯的调节
-
乙酸-2-苯乙酯是苹果醋发酵过程中主要的特征性香气物质,为了初步确定它的合成途径与调节,采用反应体系跟踪法,发现在苹果醋发酵第7 d后,乙酸-2-苯乙酯质量浓度急剧升高,第30 d达到最高值;根据分析乙酸-2-苯乙酯与其合成基质,AAT,Esterase酶活浓度之间的相关系数,初步确定了乙酸-2-苯乙酯的合成途径同时存在酯酶途径和醇酰基转移酶途径,初步推测醇酰基转移酶途径可能是乙酸-2-苯乙酯的主要合成途径,醇酰基转移酶可能是关键酶;通过外源加标法,将食品添加剂L-苯丙氨酸加入发酵液中,和对照样相比,随着其添加量的增大,乙酸-2-苯乙酯和醋酸的质量浓度均极显著增加,8 g/L是L-苯丙氨酸的最佳添加质量浓度,可以有效增加乙酸-2-苯乙酯的生成量和醋酸质量浓度,进而提高苹果醋制品独特的香味和风味.然而,关于合成乙酸-2-苯乙酯与相关底物(醇类、乙酸、酰基辅酶A)、发酵条件、菌种生长周期、微生物群落结构更替、酸碱度降低、代谢产物积累等因素之间的关系非常复杂,为了得到更加充分的试验数据,本课题有待从分子水平和基因水平深入研究苹果醋发酵过程中乙酸-2-苯乙酯的合成途径与调节机制.







 DownLoad:
DownLoad: