-
开放科学(资源服务)标识码(OSID):

-
蟾酥为蟾蜍科动物中华大蟾蜍(Bufo bufo gargarizans Cantor)或黑眶蟾蜍(Bufo melanostictus Schneider)的干燥分泌物,多于夏、秋二季捕捉蟾蜍,洗净,挤取耳后腺和皮肤腺的白色浆液,加工、干燥,即得蟾酥的功能为解毒、止痛、开窍醒神,常用于痈疽疔疮、咽喉肿痛、中暑神昏以及痧胀腹痛吐泻的治疗[1]. 现代药理研究表明,蟾酥具有抗肿瘤、强心、局部麻醉、镇痛、抗炎等多种作用,近年被用于治疗急性心力衰竭、慢性支气管炎、坐骨神经痛等[2-9].
目前市场上蟾酥质量差异较大,一方面所控制成分含量差异较大,另一方面成分之间的组成比例相差较大[10],究其原因可能与产地、加工方法、种质等因素有关[11]. 地理环境因素对产地蟾酥的质量虽有一定报道,但由于产地溯源问题、样本量问题及检验标准低的问题,导致数据不完善甚至存在相互矛盾的地方[12-19]. 为此,本试验建立特征图谱和多成分一测多评方法[20],从源头出发,比较不同产地蟾酥特征图谱的相似度,进行聚类分析和主成分分析[20-24],并检测日蟾毒它灵、蟾毒它灵、蟾毒灵、华蟾酥毒基、脂蟾毒配基的含量,分析蟾酥药材的品质和产地的关系,更全面了解我国蟾酥药材资源特点,并为蟾蜍养殖提供依据.
HTML
-
试验所需的仪器主要有:Agilent 1260高效液相色谱仪(美国Agilent科技有限公司);DZF-6090型真空干燥箱(上海一恒科学仪器有限公司);XS105电子天平(METTLER TOLEDO);KDM型可调控温电热套(山东鄄城华鲁电热仪器有限公司).
试验样品及试剂:华蟾酥毒基、脂蟾毒配基、蟾毒灵对照品(中国食品药品检定研究院,批号分别为110803-201807,110718-201809,111981-201501,纯度分别为99.6%,98.0%,99.2%),日蟾毒它灵对照品(成都普菲德生物技术有限公司,批号为170913,纯度≥98%),蟾毒它灵对照品(上海诗丹德生物技术有限公司,批号为3425,纯度≥98%). 乙腈为色谱纯,水为屈臣氏纯净水,其他试剂为分析级. 蟾酥由本司到吉林、辽宁、黑龙江、江苏、四川、河南、山东、河北实地采集得到,所有样品均由山东中医药大学药学院张永清教授鉴定为蟾蜍科动物中华大蟾蜍(Bufo bufo gargarizans Cantor)或黑眶蟾蜍(Bufo melanostictus Schneider)的干燥分泌物. 样品信息见表 1.
-
分别精密称取日蟾毒它灵、蟾毒它灵、蟾毒灵、华蟾酥毒基、脂蟾毒配基对照品适量,加甲醇稀释,制成浓度分别为51.597 0,102.508 0,87.198 0,97.020 0,51.793 0 μg/mL的混合对照品溶液.
-
分别对提取方式、提取溶剂、提取时间和称样量等进行考察,确定供试品制备方式如下:取本品细粉约25 mg,精密称定,置具塞锥形瓶中,精密加入甲醇20 mL,称定重量,加热回流1 h,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,即得.
-
以十八烷基硅烷键合硅胶为填充剂(柱长为250 mm,内径为4.6 mm,粒径为5 μm);以乙腈-0.3%乙酸溶液为流动相,梯度洗脱:0~15 min,28%~54%乙腈;15~35 min,54%乙腈;柱温为30 ℃;流速为每分钟0.6 mL;检测波长296 nm. 理论板数按华蟾酥毒基峰计算应不低于10 000. 分别精密吸取对照品溶液与供试品溶液各10 μL,注入高液相色谱仪,测定,即得.
-
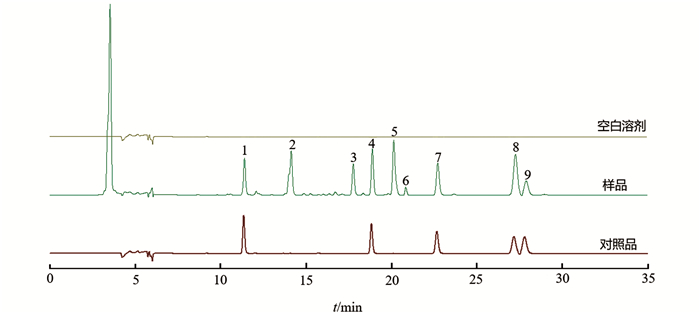
取蟾酥供试品溶液、空白溶剂按“2.2”项下的色谱条件注入色谱仪进行测定,结果表明,阴性样无干扰,方法专属性良好(图 1). 按“2.1”项下方法平行制备6份供试品溶液,按照“2.2”项下色谱条件进样测定,记录色谱图. 以峰8为参照峰,各标识峰相对保留时间RSD(相对标准差)为0.16%~0.41%,相对峰面积的RSD为0.07%~0.84%,表明该方法重复性良好. 不同分析人员在不同时间利用另一台高效液相色谱仪,再次进行重复性试验. 分析两次重复性试验结果,各标识峰相对保留时间RSD为0.16%~0.95%,相对峰面积的RSD为0.10%~1.02%,表明该方法中间精密度良好. 分别在0 h,2 h,4 h,8 h,12 h,24 h,测定同一供试品溶液. 以峰8为参照峰,各标识峰相对保留时间RSD为0.47%~1.82%,相对峰面积的RSD为0.15%~2.03%,表明供试品溶液在24 h内稳定性良好. 采用Agilent 1260和waters e2695两种高效液相色谱系统,4根色谱柱测定同一供试品溶液,各标识峰相对保留时间RSD为0.96%~1.46%,相对峰面积的RSD为1.99%~2.57%;采用不同流速和不同柱温测定同一供试品溶液,各标识峰相对保留时间RSD为1.87%~2.05%,峰面积的RSD为0.98%~1.85%. 以上结果表明方法耐用性良好.
-
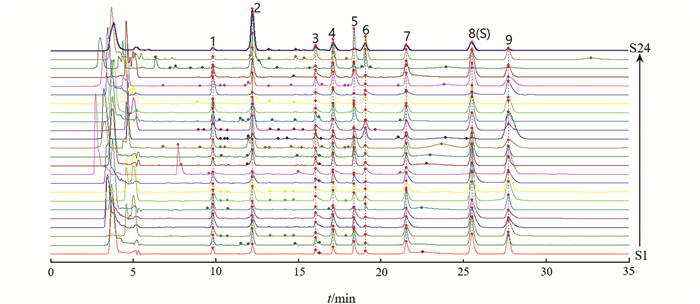
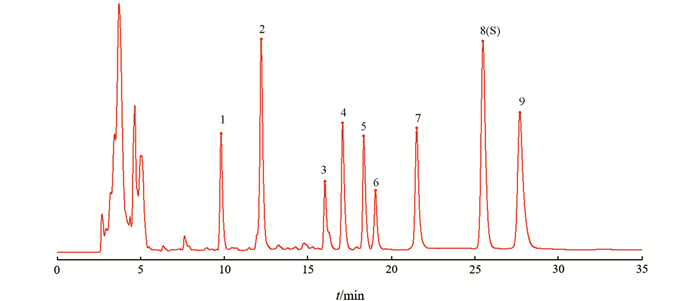
将24批蟾酥样品以“2.2”项下色谱条件分析,将数据导入“中药色谱指纹图谱相似度评价系统(2012版)”叠加色谱图见图 2,对照特征图谱见图 3. 选择出峰稳定、峰形和分离度较好的9个共有峰作为特征峰,经对照品对照,确定峰1为日蟾毒它灵,峰4为蟾毒它灵,峰7~9为蟾毒灵、华蟾酥毒基、脂蟾毒配基.
采用多点校正后对共有峰进行Mark匹配并进行相似度分析,24批次蟾酥样品特征图谱相似度为0.136~0.996,四川样本与其他各省样品相似度最低. 对相同产地样品特征图谱进行比较:HLJ1和HLJ2,特征图谱相似度>0.9;JL1-JL3,特征图谱相似度>0.9;LN1和LN5与其他辽宁批次蟾酥特征图谱相似度小,LN2,LN3,LN5批次相似度>0.9;SD4与其他山东批次特征图谱相似度较小,其余山东批次相似度>0.8;HN1和HN2特征图谱相似度较小,为0.300;JS1和JS2特征图谱相似度>0.9;SC1和SC3特征图谱相似度为0.86,SC2和SC1和SC3特征图谱相似度较小,分别为0.535和0.539. 对不同产地样品特征图谱进行比较:不同省份样品差异性较大,但1批河南样品(HN1)、1批四川样品(SC3)、1批山东样本(SD5)特征图谱相似度大于0.9. 以上结果表明,不同产地蟾酥样品成分差异较大,相同产地蟾酥样品相似性相对较好,但也有同一省份的蟾酥样品差异性较大的情况(表 2). 说明蟾酥作为动物来源药材质量不可控性因素复杂,除地域因素外,可能受药材基原、动物个体间差异及蟾酥产地加工等影响较大[7, 13-14].
以峰8为参照峰(S),各共有峰的相对保留时间RSD为0.00%~2.62%,9个特征峰相对保留时间差异较小,均在平均值±10%范围内,选择相对保留时间的平均值作为规定值. 规定值为:0.38(峰1)、0.48(峰2)、0.63(峰3)、0.67(峰4)、0.73(峰5)、0.75(峰6)、0.84(峰7)、1.09(峰9),允许误差±10%. 峰1至峰7、峰9的相对峰面积分别为0.133~13.116,0.314~89.607,0.114~52.354,0.241~11.359,0.028~35.626,0.271~7.640,0.183~17.895;相对峰面积RSD分别为231.63%,404.85%,426.12%,234.93%,385.20%,189.72%,164.88%,190.05%. 不同批次蟾酥样品共有峰相对峰面积差别较大,其中LN5,SD4,SC1批与其他批次比例差异最大(表 3).
-
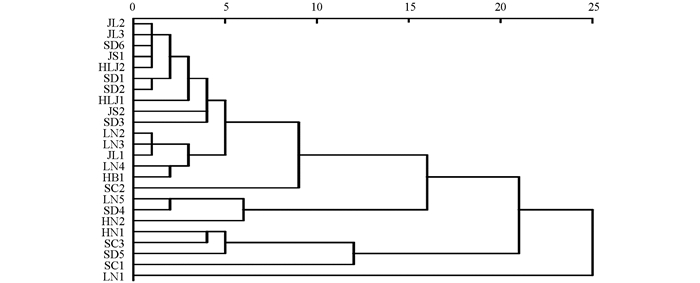
以24批蟾酥特征图谱中9个共有峰峰面积为变量,利用SPSS 20.0软件进行聚类分析,结果见图 4. 当刻度距离为15时,可分为3类,HLJ1,HLJ2,JL1,JL2,JL3,LN2,LN3,SD1,SD2,SD3,SD6,HB1,JS1,JS2,SC2聚为一类,LN5,SD4,HN2聚为一类,HN1,SC3,SD5,SC1,LN1聚为一类,说明蟾酥中二次代谢产物的积累受一定地域因素影响,但同一产地蟾酥质量也存在差异性,不同产地蟾酥质量亦具有相似性. 聚类分析与相似度评价结果基本类似.
-
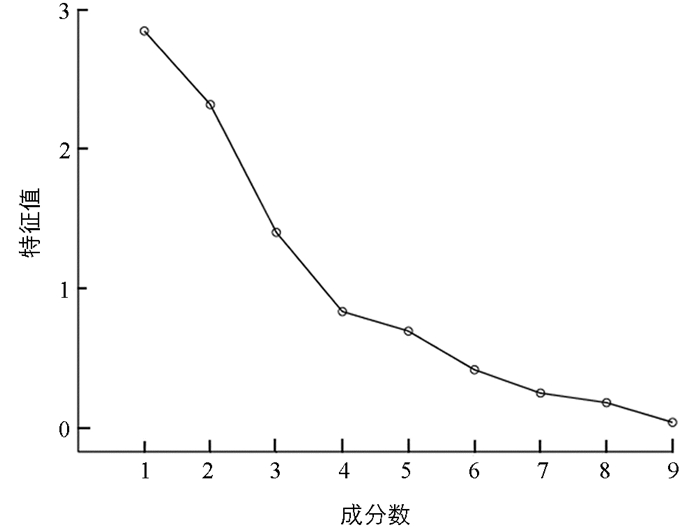
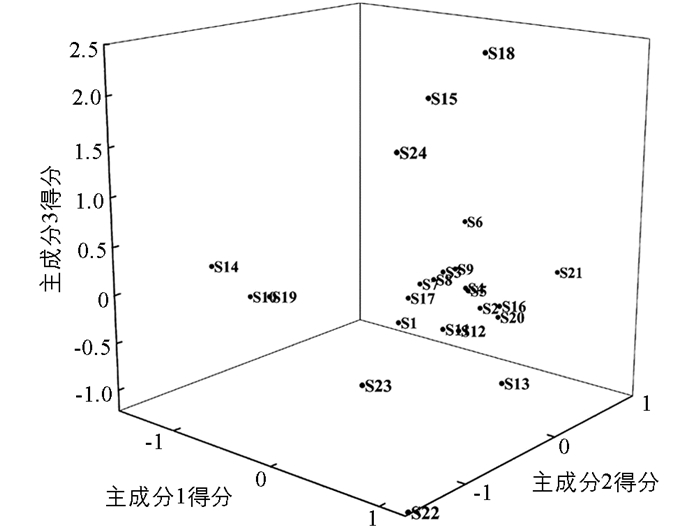
以24批蟾酥特征图谱中9个共有峰峰面积为变量,利用SPSS 20.0软件进行主成分分析,以特征值>1为提取标准得到3个主成分,累计方差贡献率为72.961%,可以代表蟾酥中9个共有峰成分的大部分信息. 碎石图见图 5,特征值及方差贡献率见表 4,各主成分得分见表 5、图 6. 由图 6可知,24批蟾酥样品可分为4类,HLJ1,HLJ2,JL1,JL2,JL3,LN1,LN2,LN3,LN4,SD1,SD2,SD3,SD6,HB1,JS1,JS2,SC2为一类,LN5,SD4,HN2为一类,HN1,SC3,SD5为一类,SC1为一类,主成分分析与聚类分析结果基本相似.
-
取蟾酥供试品溶液、空白溶剂按“2.2”项下的色谱条件注入色谱仪进行测定,结果表明,阴性样无干扰,方法专属性良好. 精密量取混合对照品溶液,采用倍数稀释法分别稀释2,4,8,16倍,按“2.2”项下色谱条件测定. 以对照品溶液的浓度为横坐标(X)、峰面积为纵坐标(Y)进行线性回归并绘制标准曲线,计算回归方程及线性范围,结果显示各成分在一定浓度范围内线性关系良好(表 6). 取蟾酥样品6份按“2.1”项方法进行制备,按“2.2”项下的色谱条件注入色谱仪进行测定,日蟾毒它灵、蟾毒它灵、蟾毒灵、华蟾酥毒基、脂蟾毒配基含量的RSD分别为1.44%,2.08%,1.52%,1.51%,1.50%,表明该方法重复性良好. 不同分析人员在不同时间利用不同仪器进行重复性试验,综合分析2次重复性试验的结果,蟾酥样品中日蟾毒它灵、蟾毒它灵、蟾毒灵、华蟾酥毒基、脂蟾毒配基含量的RSD分别为1.50%,1.72%,1.43%,1.44%,1.47%,表明方法中间精密度良好. 取6份蟾酥粉末约15 mg,精密称定,加入对照品溶液适量,按“2.2”项下进行含量测定,测定5种成分的含量,并计算回收率,日蟾毒它灵、蟾毒它灵、蟾毒灵、华蟾酥毒基、脂蟾毒配基回收率分别为96.98%~100.13%,99.20%~101.66%,96.91%~99.82%,99.91%~100.82%,100.02%~100.99%,符合分析要求. 取同一供试品溶液,按“2.2”项下的色谱条件于0 h,2 h,4 h,8 h,12 h,24 h进样测定,日蟾毒它灵、蟾毒它灵、蟾毒灵、华蟾酥毒基、脂蟾毒配基含量的RSD分别为0.31%,0.22%,0.25%,0.27%,0.21%,表明供试品在24 h内稳定性良好.
-
根据“2.4”项下的线性考察结果,以华蟾酥毒基为内参物,按照公式计算相对校正因子f[f=(As/Cs)/(Ai/Ci)(As为内标峰面积,Cs为内标浓度;Ai为待测物峰面积, Ci为待测物浓度)]. 日蟾毒它灵、蟾毒它灵、蟾毒灵、脂蟾毒配基的相对校正因子分别为0.93,1.04,0.92,1.00(表 7).
-
采用Agilent 1260和Waters e2695两种高效液相色谱系统,3根色谱柱考察仪器和色谱柱对相对校正因子的影响,结果见表 8,相对校正因子RSD值为0.55%~1.11%,表明各待测组分相对校正因子在不同仪器和不同色谱柱之间耐用性良好. 设置不同流速及柱温对相对校正因子进行测定,结果见表 9,相对校正因子RSD值为0.56%~1.23%,不同流速及柱温条件下,各待测组分相对校正因子耐用性较好.
-
分别计算各待测组分与内参物华蟾酥毒基的相对保留时间(ti/s)与保留时间差(Δti/s),并考察其在不同仪器和不同色谱柱之间的重现性,结果见表 10,相对保留时间波动较小,最终选择不同仪器和不同色谱柱中各待测成分的相对保留时间值的平均值作为峰定位依据.
-
分别采用一测多评法和外标法计算待测成分的含量,结果见表 11. 外标法与一测多评法计算的含量经t检验比较,p远大于0.05,表明两种方法测得的含量无明显差异,且两组含量之间相对误差<3%,表明所建立的一测多评方法准确性良好,可用于蟾酥的含量测定.
-
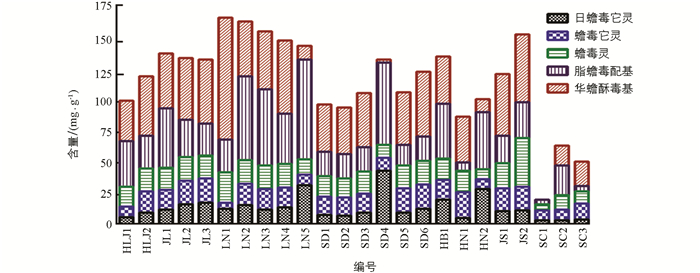
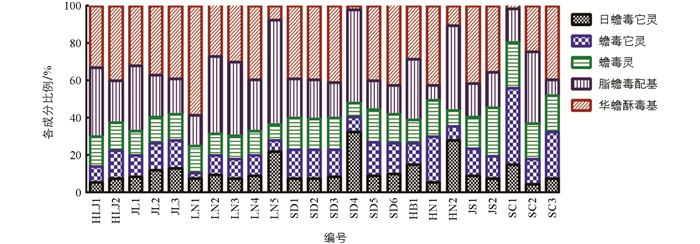
由含量测结果可以看出,日蟾毒它灵、蟾毒它灵、蟾毒灵、脂蟾毒配基、华蟾酥毒基5种蟾毒内酯类化合物总含量范围分别为2.93~43.99 mg/kg,5.17~21.41 mg/kg,4.93~40.23 mg/kg,3.58~82.38 mg/kg,0.36~100.03 mg/g,不同批次样品含量差别非常大,充分体现了动物源性药材质量影响因素的复杂性. 《中华人民共和国药典》2020年版对蟾毒灵、脂蟾毒配基、华蟾酥毒基的总量建立了质量控制标准,24个样本中,蟾毒灵、脂蟾毒配基、华蟾酥毒基3种蟾毒内酯类化合物总含量范围为8.87~152.35 mg/g,不同批次含量由高到低依次为LN1,LN2,LN3,JS2,LN4,JL1,LN5,HB1,JL2,JL3,JS1,HLJ2,SD6,HLJ1,SD3,SD4,SD5,SD1,SD2,HN2,HN1,SC2,SC3,SC1. 日蟾毒它灵、蟾毒它灵、蟾毒灵、脂蟾毒配基、华蟾酥毒基5种蟾毒内酯类化合物总含量范围为20.00~169.81 mg/g. 不同批次含量由高到低依次为LN1,LN2,LN3,JS2,LN4,LN5,JL1,HB1,JL2,SD4,JL3,SD6,JS1,HLJ2,SD5,SD3,HN2,HLJ1,SD1,SD2,HN1,SC2,SC3,SC1(表 11). 由结果可以看出,吉林和辽宁省所收集蟾酥中蟾毒灵、脂蟾毒配基、华蟾酥毒基的总量及日蟾毒它灵、蟾毒它灵、蟾毒灵、脂蟾毒配基、华蟾酥毒基的总量最高,黑龙江、山东和江苏省批次相应蟾毒内酯类含量稍低,但均能符合《中华人民共和国药典》2020年版要求. 《中华人民共和国药典》2020年版规定:“本品按干燥品计算,含蟾毒灵(C24H34O4)、脂蟾毒配基(C26H34O6)、华蟾酥毒基(C24H32O4)的总量不少于7.0%”. 河南、四川所收集蟾酥中蟾毒内酯的含量最低,无法达到药典限度要求,说明蟾毒内酯类化合物的含量与地理环境有关,蟾蜍的栖息地条件在一定程度上影响蟾毒内酯类化合物的生物合成. 结果详见表 12、图 7. 为了进一步考察不同产地样本中蟾毒内酯类化合物的组成比例是否有明显差别,对5种化合物的含量数据做百分比堆积柱形图,如图 8所示,不同批次样本中各成分组成比例差别较大,但未表现出明显的地域特征. 计算蟾毒灵、脂蟾毒配基、华蟾酥毒基3种蟾毒内酯类化合物在日蟾毒它灵、蟾毒它灵、蟾毒灵、脂蟾毒配基、华蟾酥毒基中的占比,结果为44.35%~89.72%,不同批次蟾酥药材占比有一定差别,说明《中华人民共和国药典》2020年版采用3种蟾毒内酯类化合物总量进行质量控制具有一定的局限性.
2.1. 样品制备
2.1.1. 对照品溶液的制备
2.1.2. 供试品溶液的制备
2.2. 色谱条件与系统适用性
2.3. HPLC特征图谱研究
2.3.1. 方法学考察
2.3.2. 特征图谱的建立及检测
2.4. 聚类分析
2.5. 主成分分析
2.6. 一测多评方法建立
2.6.1. 方法学考察
2.6.2. 相对校正因子计算
2.6.3. 校正因子的耐用性
2.6.4. 待测组分色谱峰的定位
2.6.5. 一测多评法与外标法测定结果的比较
2.7. 含量测定结果分析
-
蟾酥具有抗肿瘤、强心等多种药理活性,我国应用蟾酥防病治病已有2 000多年的历史,很多急救或常用中成药如麝香保心丸、六神丸、熊胆救心丸等都以蟾酥为原料[2]. 蟾酥的需求量不断增长,2020年国内蟾酥使用量已经超过5 t. 而蟾酥市场供应量急剧减少,每千克药材价格自2010年2 200元一路上扬,2019年增长至30 000元,2022年达到药典标准的蟾酥价格快速上涨至近90 000元. 野生蟾酥资源趋近枯竭,蟾酥仿生、半仿生养殖关键技术亟待突破,摸清蟾酥品质和地理环境的关系至关重要.
蟾酥中的化学成分主要包括括蟾毒内酯类、吲哚类生物碱、甾醇类及其他类化合物,其中蟾毒内酯类研究最多. 蟾毒内酯类化合物具有强心、升压、增加冠脉血流量、抗肿瘤等多种药理活性,是蟾酥中的主要有效成分[2-4]. 本文针对蟾毒内酯类化合物构建指纹图谱检测方法确认9个特征峰,并指认其中5个峰的分别为日蟾毒它灵、蟾毒它灵、蟾毒灵、华蟾酥毒基、脂蟾毒配基,进行相似度分析,聚类分析和主成分分析. 四川蟾酥样品与其他省份差异较大,相同产地蟾酥样品相似性相对较好,也有一些来源于同一省份的蟾酥样品相似度较小,说明蟾酥药材质量影响因素较多,除具有一定地域规律性外,可能受药材基原、动物个体间差异、蟾酥产地加工等影响也较大[11, 25].
针对特征图谱中的5种有效成分建立含量一测多评检测方法,以廉价、易得的华蟾酥毒基为内参物,实现多个蟾蜍内酯类成分的同步测定,降低检测成本同时解决了对照品不足的问题. 利用所建立的方法对24批蟾酥含量进行测定,不同批次产品中5种蟾毒内酯类化合物含量差异非常大,黑龙江、吉林、辽宁、河北、山东、江苏省所收集蟾酥中蟾毒灵、脂蟾毒配基、华蟾酥毒基的总量及日蟾毒它灵、蟾毒它灵、蟾毒灵、脂蟾毒配基、华蟾酥毒基的总量均较高,且均能符合《中华人民共和国药典》2020年版要求,河南、四川所收集蟾酥中蟾素内酯的含量较低,无法达到药典限度要求,说明蟾毒内酯类化合物的含量与地理环境有关,蟾蜍的栖息地条件在一定程度上影响蟾毒内酯类化合物的生物合成. 另外,不同蟾酥批次样本中各成分组成比例差别较大,但未表现出明显的地域特征. 蟾毒灵、脂蟾毒配基、华蟾酥毒基3种蟾毒内酯类化合物在日蟾毒它灵、蟾毒它灵、蟾毒灵、脂蟾毒配基、华蟾酥毒基中的占比为44.35%~89.72%,不同批次蟾酥药材占比有一定差别,说明《中华人民共和国药典》2020年版采用蟾毒灵、脂蟾毒配基、华蟾酥毒基3种蟾毒内酯类化合物总量进行质量控制具有一定的局限性,可能造成蟾酥资源的浪费及临床用药风险. 本研究建立了蟾酥指纹图谱检测方法及含量一测多评检测方法,该方法在《中华人民共和国药典》2020年版基础上增加特征峰数量及含量测定指标的数量,方法极其简便,在不增加工作量及检测成本的基础上进一步提高蟾酥质控水平,具有推广价值,可以为蟾酥药材真伪判断、质量评价研究提供依据. 在蟾酥样品收集方面,课题组深入到蟾酥产地采集8个省份的24批蟾酥样品,避免购买不同产地原料混合加工品,样品具有代表性. 对蟾酥样品进行检测及化学计量学分析研究结果表明,蟾酥中主要有效成分蟾毒内酯的积累具有一定的地域性,对于蟾蜍药材产地特征研究、仿生及半仿生养殖及蟾酥药材资源的合理开发应用具有重要意义. 下一步课题组将针对濒危名贵道地药材蟾酥规模化生产的痛点为研究内容,重点突破规模化生产中的关键技术,并进行产业化研究,从而为实现蟾酥药材产业化、保证以蟾酥为原料中成药和临床蟾酥用药需求夯实基础.






 DownLoad:
DownLoad: