-
开放科学(资源服务)标识码(OSID):

-
磷是所有生物生长所需要的基本营养物质.但由于化肥、含磷洗涤剂等的使用,大量的生活污水、农业径流污水流入湖泊、河流及滨海地区,在一定程度上引发了富营养化等环境污染问题[1-2]. 植物在生长过程中能吸收大量的磷,再经生理代谢转化为自身生长需要的有机物质,而植物从污染水体中通过营养吸收,使污染水体中的磷转移,可降低污染水体的磷含量,达到除污效果[3],因此可以利用湿地植物对磷的吸收积累来修复富营养化水体. 文献[4]报道了磷在芦苇(Prhagmites australis)、互花米草(Spartina alterniflora)和海三棱藨草(Scirpus mariqueter)3种湿地植物中的分配和积累. 文献[5]报道了不同湿地植物对污水总氮、总磷的去除效能及迁移规律,指出植物对氮、磷含量高的污水去除效果较好.
根表铁膜是植物根系氧化活动的结果,它在湿地植物中普遍存在,是湿地植物适应淹水环境而产生的一种防御机制. 根表铁膜在植物利用营养元素和防御有害物质方面有着积极的意义[6-8]. 至今,已发现多种湿地植物根表可形成铁膜[9]. 根表铁膜有着独特的结构特征,是一种两性胶体,具有特殊的电化学特性,可以通过不同方式对土壤中各种成分进行吸附[10],其性质与自然界的铁氧化物相似[11],对土壤中的一些阴、阳离子有吸附作用,也是湿地植物阻止重金属等污染物进入植物体内的重要屏障[12].
湿地植物根表铁膜对植物养分、重金属元素及其它非金属元素的富集与吸收已进行了大量的研究,但其作用机制并不明确,对于根表铁膜究竟是抑制还是促进了P,Cu,Zn,Pb,Cd,As,Ni等元素的吸收和运输,目前仍是一个争议较大的话题[13-14]. 文献[15]等发现杉木幼苗的根表铁膜含量与根系和地上部磷素积累量均呈显著正相关;文献[16]通过野外调查研究山梗菜时发现,厚的铁膜降低了植株对P的吸收;文献[17]通过研究5种湿地植株根表铁膜与植物吸收重金属的关系发现根表铁膜与植物体内的Cd,Pb,As呈极显著负相关关系. 关于根表铁膜对湿地植物的生长发育的影响,也存在不一致的观点. 文献[18]研究发现,根表覆有铁膜的灯芯草根系和地上部的生物量是无铁膜的2~3倍;而文献[19]则发现,宽叶香蒲(Typha latifolia)根系活力与其根表铁膜量呈显著负相关.
此外,外加铁源对根表铁膜的形成和对元素吸收、运输的影响鲜见报道. 鉴于此,本研究以湿地植物花叶冷水花(Pilea cadierei)为研究对象,采用模拟垂直流人工湿地系统,研究了不同P质量浓度水平下外源铁对花叶冷水花根表铁膜形成的影响,进一步分析了根表铁膜与花叶冷水花生长状况及根系、地上部分磷素吸收的关系,旨在探明根表铁膜对湿地植物花叶冷水花在磷污水处理中的作用,对受磷污染水体的植物修复有着重要的意义.
HTML
-
花叶冷水花是荨麻科冷水花属多年生草本,耐阴耐湿,易于修剪,对磷有较强富集能力[20]. 本试验所用试材购买于四川省雅安市大兴花卉市场,试验前用静置1 d的自来水将购回的花叶冷水花根部冲洗干净,然后用蒸馏水清洗,自然风干10 min后称鲜质量,测定株高,并从中取样测定植物根系、地下部分初始磷含量、根表铁氧化物胶膜量.
-
模拟垂直流人工湿地试验在高14 cm、上口直径20 cm、下口直径16 cm的塑料桶中进行,桶底部布设水管. 试验基质从下到上依次是3 cm厚(约0.5 kg)的砾石层(直径0.5~1.2 cm)和7 cm厚(约1.5 kg)的河沙与土壤的混合层. 砾石与河沙采自雅安青衣江,土壤为紫色土,取自四川农业大学教学科研园区,土壤基本理化性质见表 1. 河沙与土壤过2 mm筛后按2∶1的比例混合,为保证植株在生长过程中有充足的养分供应,每千克沙土中加入0.3 g过磷酸钙、0.4 g尿素和0.3 g氯化钾混匀.
-
试验在四川农业大学环境学院光照培养室中进行,培养室白天温度为25 ℃,晚上温度为20 ℃,光照时长分别为白天14 h、晚上10 h,光照强度为200~230 μmol/(m2·s),湿度控制在70%.
-
模拟P污水:以KH2PO4为磷源配置P质量浓度分别为0,5,10,50,100 mg/L的模拟P污水,分别记为P0,P5,P10,P50,P100.
外源铁(Fe2+):将用作基质的沙土分为3组,加入一定质量的FeSO4·7H2O固体,充分混合,使基质沙土中Fe2+的质量浓度分别为0,500,1 000 mg/kg,分别记为Fe0,Fe500,Fe1 000.
-
将长势一致的花叶冷水花分别种植于3个Fe2+质量浓度基质的试验桶中,每桶种8株,初始鲜质量约为40 g. 植株在自来水下稳定15 d后,分别用0,5,10,50,100 mg/L 5个P质量浓度梯度的模拟P污水进行处理,每次处理间隔7 d(即水力停留时间以7 d计). 各质量浓度模拟P污水的加入量均为0.8 L,系统水力负荷为0.04 m3/(m2·d). 本试验共持续6周,试验期间通过添加蒸馏水补充蒸发、蒸腾等所耗的水分,以保持试验桶中水位.
试验共15个处理:Fe0P0,Fe0P5,Fe0P10,Fe0P50,Fe0P100,Fe500P0,Fe500P5,Fe500P10,Fe500P50,Fe500P100,Fe1 000P0,Fe1 000P5,Fe1 000P10,Fe1 000P50,Fe1 000P100,每个处理重复4次. 同时设置无植物的纯基质模拟人工湿地系统,除无需种植植物外,其余处理方法与植物组人工湿地系统相同.
-
试验结束后,测定植物株高并将植物全株收获,用自来水冲洗干净,风干后称鲜质量,取总根量的1/2用于测定植物根表铁氧化物胶膜,余下的根系与植物地上部分于105 ℃下杀青30 min,再于65 ℃下烘干至恒重后称量,记录根系和地上部分干质量.
-
采用连二亚硫酸钠-柠檬酸钠-碳酸氢钠(dithionite-citrate-bicarbonate,DCB)法提取根表铁膜[21],具体方法为:收获后的植物根系用去离子水冲洗干净后放入250 mL白色塑料瓶中,加入0.3 mol/L柠檬酸钠(Na3C6H5O7·2H2O)40 mL,1 mol/L碳酸氢钠(NaHCO3)5 mL及5 g连二亚硫酸钠(Na2S2O4),浸提根表铁胶膜. 然后在25 ℃,280 r/min的摇床上振荡3 h,溶液过滤至100 mL容量瓶中定容. 取出的根在70 ℃烘箱中烘干,称干质量. 用火焰原子吸收分光计(novAA300Analytik Jena AG)测定提取液中的铁,用钼锑抗比色法(722S型分光光度计)测定提取液中的磷[22].
根表铁膜的计算采用DCB提取液中铁含量与DCB提取后根干质量之比,根表铁膜磷吸附量是DCB提取液中含磷量与DCB提取后根干质量之比[23],单位均为g/kg根干质量,简写为g/kg.
-
植物磷吸收量表示植物从湿地系统中带走的磷素量,是直接反映植物的净化潜力的重要指标. 将烘干的植物根系和地上部分样品分别粉碎,过0.25 mm筛,采用H2SO4—H2O2消煮—钒钼黄比色法(722S型分光光度计)测定植株根系及地上部分磷含量[22].
-
所有数据均采用SPSS,Excel和Origin等软件进行统计分析. 数值为平均值±标准误差. 组间数据进行方差分析并用最小差值法(LSD)进行多重比较,*p<0.05表示差异显著,**p<0.01表示差异极显著.
1.1. 试验材料与设计
1.1.1. 供试材料
1.1.2. 试验装置与湿地基质
1.1.3. 试验地概况
1.1.4. 模拟含磷污水与外源铁的配制
1.1.5. 试验设计
1.2. 指标测定
1.2.1. 植株生长量的测定
1.2.2. 根表铁氧化物胶膜量及胶膜磷吸附量的测定
1.2.3. 植株根系和地上部分磷含量的测定
1.3. 数据处理与分析
-
植物根表铁膜是长期生长于渍水土壤条件下的植物适应淹水环境的结果,通过耐渍水特有的通气组织,将氧气输送到根系,从而把Fe2+氧化成铁的氧化物、氢氧化物胶膜. 因此,渍水土壤中铁膜的形成必须具备两个条件:①局部的氧化条件;②土壤中有一定的可溶性Fe2+存在[24]. 本试验以7 d为一个换水周期,使系统一直处于渍水状态. 局部氧化状态主要通过植物根系氧化作用保持. Fe2+来自于土壤以及外源Fe2+.
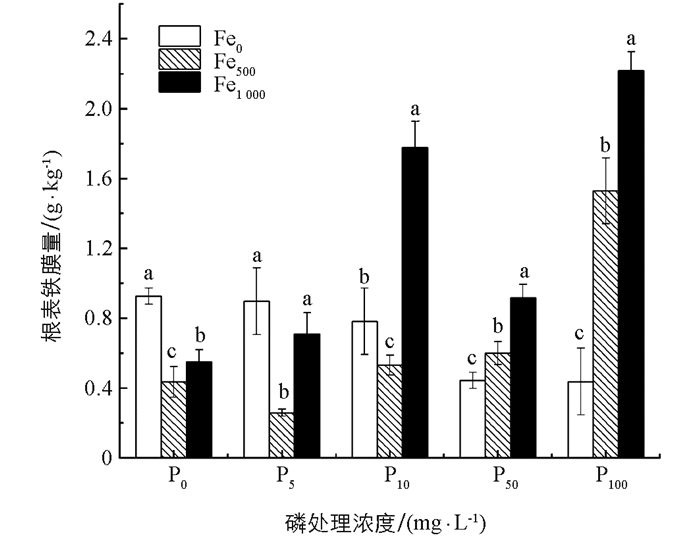
由图 1可知,模拟人工湿地系统基质中外源Fe2+的质量浓度对花叶冷水花根表铁膜形成量具有显著性影响. 外源Fe2+对根表铁膜形成的影响与P质量浓度有关:当P质量浓度不超过10 mg/L时,根表铁膜量随Fe2+质量浓度增加呈先降低后升高趋势,基质中外源Fe2+为500 mg/kg时,根表铁膜量显著低于不加Fe2+和外加1 000 mg/kg Fe2+处理的结果;而当P质量浓度不低于50 mg/L时,根表铁膜量随Fe2+质量浓度的增加而增加,尤其是在P质量浓度为100 mg/L时,这种变化趋势表现得最为明显. 说明在高质量浓度磷处理系统中,外源Fe2+能有效地促进花叶冷水花根表铁膜的形成. 此外,污水中P质量浓度对花叶冷水花根表铁膜形成的影响也与基质中Fe2+质量浓度有关,在未加Fe2+时,根表铁膜量随着P质量浓度的增加而降低,在外加Fe2+为500 mg/kg和1 000 mg/kg时,根表铁膜量随P质量浓度的增大呈现整体上升趋势. 许多报道认为缺磷能诱导根表铁膜的形成[25-26],而通过本试验发现,磷对铁膜形成的影响与环境中铁离子浓度有关:当Fe2+质量浓度较低时,P质量浓度增大会抑制根表铁膜的形成;但外加一定量Fe2+后,P质量浓度的增大不再抑制根表铁膜的形成,而是起到促进作用. 本试验发现,高铁高磷处理下(Fe1 000P100),花叶冷水花根表铁膜形成量最大,为2.22 g/kg.
-
由表 2可知,参试植物在有外源Fe2+的模拟人工湿地系统中,经不同质量浓度P污水持续处理42 d后,P质量浓度水平对植物株高、鲜质量增长量以及根系和地上部干质量均具有显著影响,而Fe2+对地上部分干质量无显著影响.
从表 2还可看出,当模拟人工湿地基质中未加入外源Fe2+时,花叶冷水花株高增长量、根系及地上部干质量随污水P质量浓度的增加变化不明显,而当基质中加入500 mg/kg和1 000 mg/kg外源Fe2+时,花叶冷水花株高增长量、根系及地上部干质量的较大值均出现在高磷处(P质量浓度不低于50 mg/L),说明在基质中加入一定量Fe2+后,高质量浓度磷污水并不抑制花叶冷水花生长,反而起到促进作用,这与有外源Fe2+加入下,磷可促进花叶冷水花根表铁膜的形成结论一致,说明根表铁膜与植物生长可能存在一定相关性. 本试验发现,花叶冷水花地上部分干质量最大值出现在Fe500P50处理下,说明当外源Fe2+质量浓度超过500 mg/kg,P处理质量浓度超过50 mg/L均会在不同程度上影响植株生长,这可能是因为磷是蛋白质和核酸的主要必需元素,根表铁膜可促进植物对磷的吸收[27],在植物可接受水平下,高磷条件培养的植物抗性更强,磷的大量吸收利于植物干物质的积累. 但如果P质量浓度过高,植物会因为无法吸收水分而萎蔫,造成烧苗现象[28].
-
从表 3可看出,根表铁膜量与参试植物株高增长量的相关系数为0.713**,呈显著正相关(p<0.01),但与鲜质量增长量、根系干质量、地上部干质量的相关系数分别为0.423,0.482和0.263,相关性未达显著水平. 表明花叶冷水花根表铁膜的形成有利于其纵向生长,但对干质量积累影响不大,这可能是因为根表铁膜有利于植物地上部分磷素积累,促进植物茎杆生长,而与氮素营养吸收无明确相关性,对植物有机物的积累作用不显著.
-
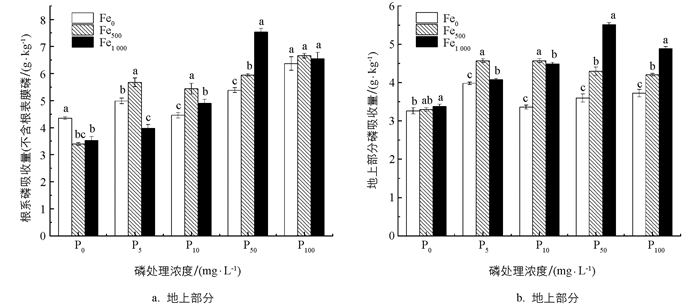
由图 2可知,当污水P质量浓度为0,100 mg/L时,外源Fe2+质量浓度水平对花叶冷水花根系磷吸收量(不含根表膜磷,下同)的影响无显著差异;当污水P质量浓度为5,10,50 mg/L时,外源Fe2+对根系磷吸收量的影响差异显著. 由此可见,P质量浓度过低或过高,向基质中加入外源Fe2+对植物根系磷吸收量没有显著影响. 3个外源Fe2+质量浓度水平下,花叶冷水花根系对磷的平均积累量分别为(5.11±0.12) g/kg,(5.42±0.11) g/kg,(5.30±0.15) g/kg,三者差异不显著,说明铁的加入对花叶冷水花根系磷的积累影响不大,其原因可能是植物根系P主要与土壤P质量分数呈极显著正相关,与其他元素相关性不明显[29].
当污水P质量浓度为0 mg/L时,外源Fe2+质量浓度水平对花叶冷水花地上部分磷吸收量的影响无显著差异;当污水P质量浓度为5,10,50和100 mg/L时,外源Fe2+质量浓度水平与花叶冷水花地上部分磷吸收量差异显著. 在P质量浓度不低于50 mg/L时,花叶冷水花地上部分磷吸收量随着Fe2+质量浓度的增加而增大,即当植物生长于富磷条件下时,外源铁可促进湿地植物地上部分对磷的吸收. 3个外源Fe2+质量浓度水平下,花叶冷水花地上部分对磷的平均积累量分别为(3.58±0.07) g/kg,(4.19±0.06) g/kg,(4.47±0.05) g/kg,三者差异显著,说明铁的加入对花叶冷水花地上部分磷的积累具有显著性影响.
从图 2还可看出,在低P水平下,外加Fe2+质量浓度对花叶冷水花根系和地上部分磷吸收量无显著影响,在P质量浓度为5,10 mg/L时,基质中加入500 mg/kg Fe2+可显著提高花叶冷水花根系和地上部分磷吸收量,在P质量浓度为50 mg/L时,基质中加入1 000 mg/kg Fe2+可使花叶冷水花根系和地上部分磷吸收量达到最大值,说明花叶冷水花对磷的吸收量与P质量浓度和基质中Fe2+含量有关,这为提高花叶冷水花对含磷污水的净化效果提供了数据支撑.
-
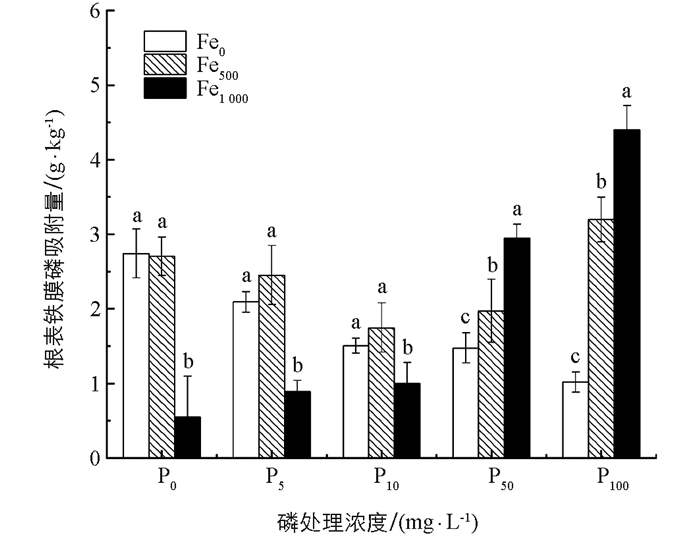
图 3表示0,5,10,50,100 mg/L 5个P质量浓度处理下,3个不同外源Fe2+质量浓度对花叶冷水花根表铁膜磷吸附量的影响. 由图 3可知,当基质中不加入Fe2+时,根表铁膜磷吸附量随污水P质量浓度的增加而降低,说明在Fe2+较低时,P的加入会抑制植株根表铁膜对磷的吸附,这与低Fe2+质量浓度下,P的加入抑制根表铁膜的形成具有一致性;当基质中加入500 mg/kg Fe2+时,根表铁膜磷吸附量随P质量浓度的增加呈先降低再升高的趋势;在加入1 000 mg/kg Fe2+时,根表铁膜磷吸附量随P质量浓度的增加而增大,在Fe1 000P100处理下,根表铁膜磷吸附量达到最大值,为4.40 g/kg.
从图 3还可看出,在P质量浓度水平较低(分别为0,5,10 mg/L)时,Fe1 000处理下根表铁膜磷吸附量始终低于Fe0和Fe500;而在高P质量浓度下(分别为50,100 mg/L)时,根表铁膜磷吸附量从高到低依次为Fe1 000,Fe500,Fe0. 这说明Fe2+对根表铁膜磷吸附量的影响取决于环境中P的质量浓度,当在低磷条件下,Fe2+的加入会抑制根表铁膜对磷的吸附,而在高磷水平下,Fe2+的加入可促进根表铁膜对磷的吸附.
-
根表铁膜是铁氧化物在根系表面形成的一层氧化物胶膜,具有与铁锰氧化物相似的电化学性质,对土壤中某些阴阳离子具有富集作用,在很大程度上影响着植物对养分元素的吸收. 许多研究表明,根表铁膜在近根的区域能富集养分,可以在介质中养分缺乏时被活化吸收[30-31].
文献[32]研究指出,铁胶膜中的磷是植物吸收磷的重要来源. 文献[33]的研究发现,根表铁膜可以促进水稻对磷的吸收,但这种促进作用的大小依赖于根表铁膜数量. 表 4列出了根表铁膜量与花叶冷水花根系、地上部分以及铁膜磷吸附量的线性关系. 从表 4可知,根表铁膜量与参试植物根系磷吸收量无显著相关性,而与植株地上部分磷吸收量和铁膜磷吸附量的相关系数分别为0.386**,0.476**,呈显著正相关(p<0.01),说明花叶冷水花根表形成的铁膜可促进其地上部分和根表铁膜对磷的吸收,这与文献[15, 33-34]等关于根表铁膜量与植物磷吸收的研究观点一致. 从表 4还可看出,花叶冷水花根表铁膜磷吸附量与根系磷吸收量呈显著负相关(r=-0.438**,p<0.01),而与地上部分磷吸收量呈显著正相关(r=0.386**,p<0.01). 表明根表铁膜对磷的吸附作用可阻止磷在植物根系的大量积累,抵御磷素过量对根系的伤害,但并不影响植物地上部分对磷素的吸收,可以认为根表铁膜充当了植物养分的暂时储存库,对调节植物磷素平衡起着关键作用.
2.1. 不同P质量浓度下外源铁对花叶冷水花根表铁膜形成的影响
2.2. 不同P质量浓度下外源Fe2+对花叶冷水花生长状况的影响
2.3. 根表铁膜量与花叶冷水花生长状况的相关性分析
2.4. 不同P质量浓度下外源Fe2+对花叶冷水花磷吸收量的影响
2.4.1. 不同P质量浓度下外源Fe2+对花叶冷水花根系及地上部分磷吸收量的影响
2.4.2. 不同P质量浓度下外源铁对花叶冷水花根表铁膜磷吸附量的影响
2.5. 根表铁膜量与花叶冷水花磷吸收量的相关性分析
-
1) 在人工湿地系统中,外源Fe2+可促进湿地植物花叶冷水花根表铁膜的形成,Fe2+对根表铁膜形成的影响与系统中P的质量浓度有关,当P质量浓度不超过10 mg/L时,根表铁膜形成量随Fe2+质量浓度增加呈先降低后升高趋势,当P质量浓度不低于50 mg/L时,根表铁膜量随Fe2+质量浓度的增加而增加. 污水中磷的质量浓度对花叶冷水花根表铁膜形成的影响也与基质中Fe2+质量浓度有关,铁含量较高时,高磷条件更利于根表铁膜的形成.
2) 外源Fe2+可促进花叶冷水花地上部干质量积累,在高铁高磷交互作用下,植株根系、地上部分干质量显著高于其他处理,但当基质中外源Fe2+质量浓度超过500 mg/kg,P质量浓度超过50 mg/L时,花叶冷水花生长受到影响.
3) 根表铁膜对磷的吸附量与基质中Fe2+含量和污水中P的质量浓度有关. 当基质中无外源Fe2+时,P质量浓度增大会抑制花叶冷水花根表铁膜的形成,降低铁膜对磷的吸附能力. 当系统中加入外源Fe2+,且P质量浓度≥50 mg/L时,根表铁膜磷吸附量随铁质量浓度的增加而增大,本试验在Fe1 000P100处理下,根表铁膜磷吸附量达最大值,为4.40 g/kg.
4) 根表铁膜与花叶冷水花株高增长量呈显著正相关(r=0.713**,p<0.01),可促进其纵向生长,但与鲜质量增长量、根系干质量和地上部干质量的相关性不显著. 此外,铁膜与花叶冷水花地上部分磷吸收量、铁膜磷吸附量也呈显著正相关,相关系数分别为0.386**,0.476**(p<0.01).
因此,在应用湿地植物花叶冷水花净化高磷污染水体,适当加入外源Fe2+有利于花叶冷水花的生长,促进其地上部分对磷的吸收,从而转移污水中的磷,达到净化磷污染水体的作用,对治理磷的面源污染及修复严重富营养化水体具有重要意义.






 DownLoad:
DownLoad: