-
开放科学(资源服务)标识码(OSID):

-
离子界面反应作为土壤环境中影响广泛的物理化学过程[1-2],其理论机制一直是研究者们关注的重点[3-5]. 研究者认为土壤/矿物颗粒表面大量的电荷在其表面形成数量级达108~109 V/m的强电场[6-7],是其具有各种理化性质的根本原因[8],因而土壤溶液中离子的扩散迁移从根本上是受土壤/矿物颗粒表面性质的影响[9]. Li等[10]通过离子吸附动力学实验研究Cu2+,Ca2+,Mg2+在蒙脱石颗粒表面的吸附,平衡吸附量表现出Cu2+>Ca2+>Mg2+的离子特异性效应,同时通过红外光谱和凝聚实验验证得出,具有nsnp轨道(n值指原子轨道波函数中的主量子数)的阳离子,n值越大,离子特异性效应越强烈. 目前的研究多集中于具有不同轨道离子的吸附动力学研究[11],鲜有从吸附材料自身电化学性质的角度去比较其差异对离子吸附行为的影响. 蒙脱石和紫色土为两种典型的恒电荷表面材料,可以忽略边缘处电荷对总电荷的影响,因而就可以忽略二价离子与矿物边缘面的化学键作用,表面电荷数量可以近似为常数,对金属离子的吸附量也较大[12-13]. Mg2+在土壤/矿物带电表面以静电吸附和非经典极化增大的偶极子作用为主,Cd2+,Pb2+作为常见的重金属,在土壤/矿物表面的吸附作用则更为复杂. 本研究以蒙脱石/紫色土为吸附材料,通过Mg2+,Cd2+,Pb2+ 3种二价离子在两种材料表面的吸附动力学结果,分析不同吸附材料表面电化学性质对离子吸附行为的影响,以期为明确带电表面对吸附离子的作用机制提供理论基础.
HTML
-
KCl,LiCl,MgCl2·6H2O,CdCl2·2.5H2O和PbCl2均为分析纯(成都市科龙化工试剂厂);本实验中采用蒙脱石(内蒙古物华天宝矿物资源有限责任公司)和紫色土(采自重庆北碚)作为研究材料. 用0.1 mol/L KCl溶液对蒙脱石和紫色土样品进行前处理,制得K+-蒙脱石饱和样和K+-紫色土饱和样[14]. 根据联合测定法得出蒙脱石的表面电荷数为1 150.0 mmol/kg(-)、比表面积为725.0 m2/g;紫色土样品表面电荷数为276.3 mmol/kg(-),比表面积为90.6 m2/g.
-
采用恒流置换法进行离子交换吸附实验[15]. 室温条件下,浓度为5×10-5,1×10-4,1×10-3,1×10-2 mol/L的交换液MgCl2,CdCl2,PbCl2持续以恒定流速(1 mL/min)通过平铺在交换柱上的样品,并用自动收集器收集流出液. 值得注意的是,由于离子在不同吸附材料表面、不同浓度条件下吸附速率不同,因此各条件下流出液的收集时间是不同的. 在本研究中,浓度为5×10-5,1×10-4,1×10-3,1×10-2 mol/L的交换液通过K+-蒙脱石饱和样所对应的时间间隔为20,20,10,5 min;而通过K+-紫色土饱和样所对应的时间间隔为20,20,10,3 min. 称取试管收集液体前后质量可得到交换液体积,然后用原子吸收分光光度计(Z-5000型,上海傲谱分析仪器有限公司)分别测定交换液和原液中Mg2+,Cd2+,Pb2+的浓度,从而计算出不同条件下的离子吸附量.
-
Li等[16-17]建立了考虑离子特异性效应的离子吸附动力学模型,当土壤颗粒表面对离子存在快速的强吸附作用时,可能存在零级动力学过程. 然而,当表面由于强静电力吸附作用吸附至饱和后,离子将在弱静电力作用下继续扩散,动力学吸附过程表现为一级动力学特征.
假定实验样品比表面积为S,i离子的吸附量Ni(t)可表示为[18]:
由方程(1)可得离子的单位时间吸附量:
式中:fi0为i离子在本体溶液中的浓度(mol/L);l为固定液膜的平均厚度(dm);Dpi为离子i在土壤中的扩散系数;Zi为离子价态;F为法拉第常数(C/mol);φ(x)为x处的电位值(mV).
当离子—界面间存在强吸附力作用,靠近带电界面的离子几乎被完全吸附,此时为快速吸附过程,吸附过程表现出零级动力学特征,其动力学方程为[16, 19]:
式中:ki(0)为离子的零级吸附速率.
当离子—界面间存在弱吸附力作用,靠近带电界面的离子只有部分被吸附,此时为慢速吸附过程,吸附过程表现出一级动力学特征,其动力学方程为[16, 19]:
式中:ki(1)为离子的一级吸附速率.
为了更好地运用实验数据及作图,将方程(3)和(5)改写为差分形式:
式中:m=1,2,3,…;
$N_i\left(t_{m+\frac{1}{2}}\right)=N_i\left(t_m\right)+\frac{1}{2}\left[N_i\left(t_{m+1}\right)-N_i\left(t_m\right)\right]$ .
1.1. 实验材料与样品的制备
1.2. 实验方法
1.3. 理论计算
-
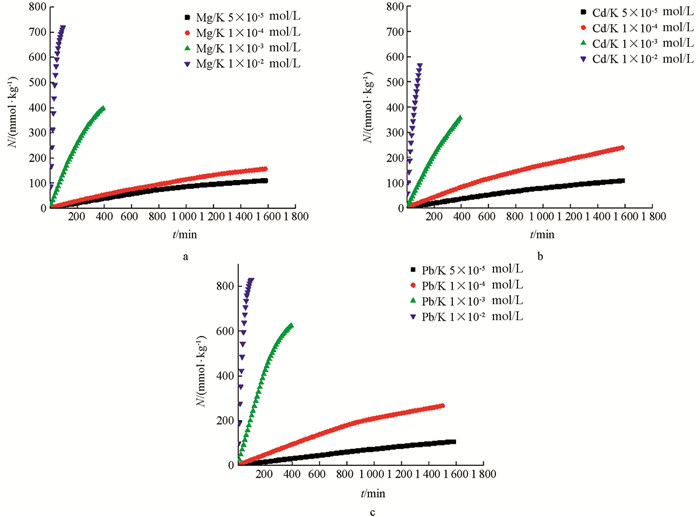
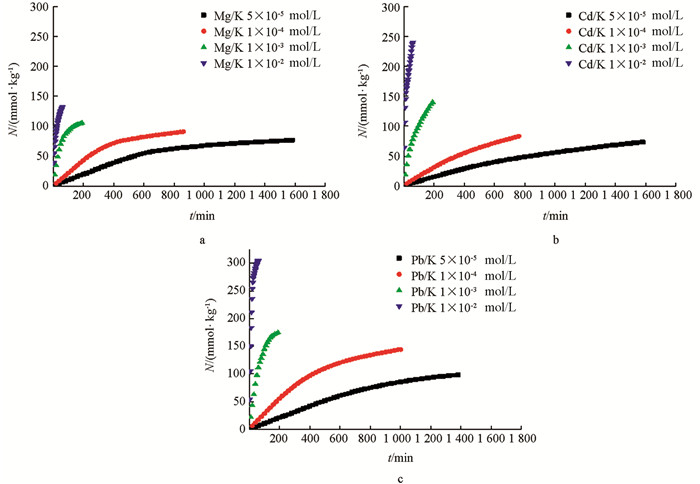
根据恒流实验中不同电解质浓度条件下的Mg2+,Cd2+,Pb2+3种离子在K+-蒙脱石颗粒表面与K+-紫色土颗粒表面的吸附动力学数据,用Ni(t)对t作图,所得结果如图 1、图 2所示.
由图 1、图 2可以得出,相同电解质类型条件下,Mg2+,Cd2+,Pb2+3种离子在K+-蒙脱石颗粒表面与K+-紫色土颗粒表面的吸附量均随电解质浓度的升高而增大. 比如以K+-蒙脱石饱和样为吸附材料时,随着电解质浓度由5×10-5 mol/L依次升高至1×10-2 mol/L,在吸附时间达100 min时,Mg2+的吸附量依次增大为9.65,14.69,142.35,737.44 mmol/kg;Cd2+的吸附量依次增大为8.91,21.76,110.38,584.51 mmol/kg;同样地,Pb2+的吸附量也依次增大为7.33,23.61,221.41,839.26 mmol/kg. 当吸附材料为K+-紫色土饱和样时,仍然满足以上规律. 当电解质浓度由5×10-5 mol/L依次升高至1×10-2 mol/L,在吸附时间达60 min时,Mg2+的吸附量依次增大为5.97,13.10,77.37,132.01 mmol/kg;Cd2+的吸附量依次增大为5.05,10.54,78.04,189.08 mmol/kg;同样地,Pb2+的吸附量也依次增大为6.25,17.12,111.54,304.57 mmol/kg.
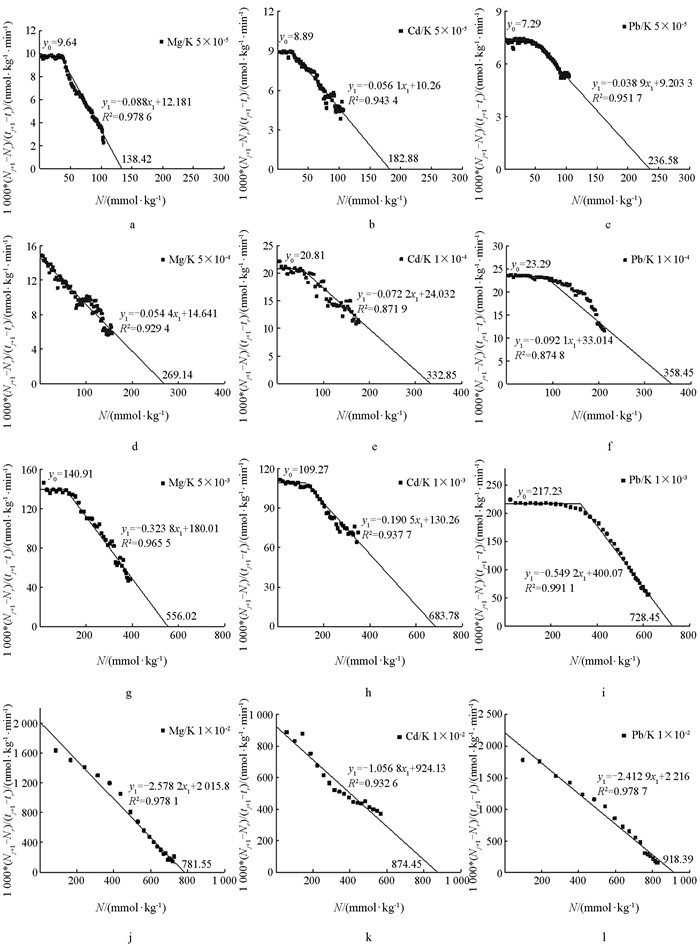
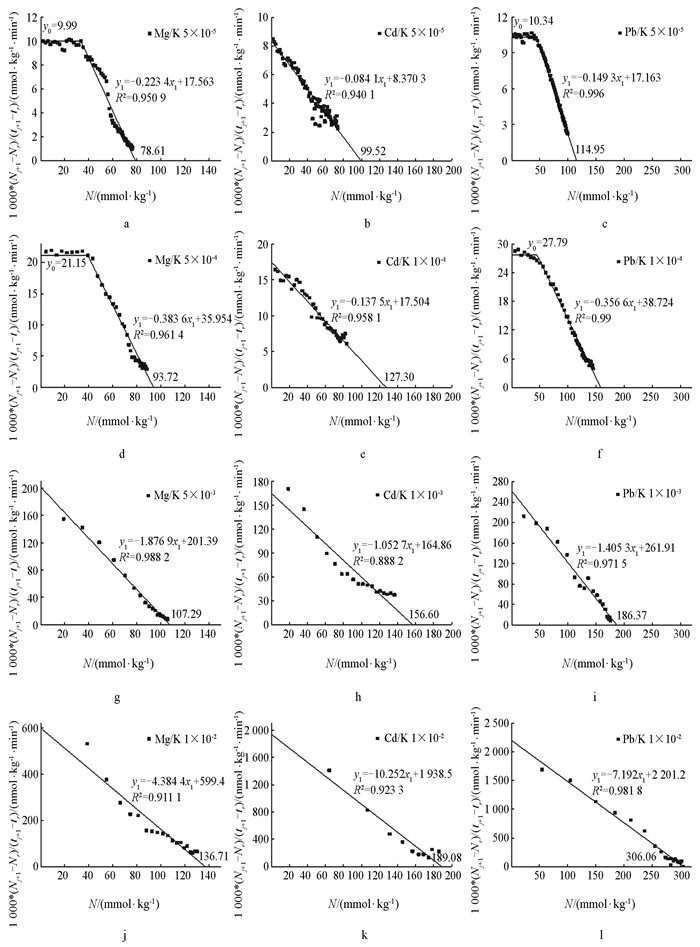
将离子吸附动力学实验数据(图 1、图 2)用{[Ni(tm+1)-Ni(tm)]/(tm+1-tm)}对
$N_i\left(t_{m+\frac{1}{2}}\right)$ 作图,所得结果分别如图 3、图 4所示. 同时将根据图 3、图 4所获得的3种离子吸附平衡量列于表 1中.由图 3、图 4及表 1可以看出,相同电解质浓度条件下,在不同吸附材料表面3种金属离子的平衡吸附量均遵循Pb2+>Cd2+>Mg2+的顺序,存在显著的离子特异性效应. 由于本实验采用的恒流置换法,其吸附平衡不会受到平衡常数的制约,所以从理论上讲,各种电解质浓度下的Mg2+,Cd2+,Pb2+均能将K+-蒙脱石饱和样与K+-紫色土饱和样中的K+完全交换下来,并且其吸附量均等于其自身的CEC值. 但在实际的实验中,不同的离子类型、不同的电解质浓度条件下所得到的平衡吸附量是不同的. 原因是不同交换体系中反应的活化能不同,交换速率也是不同的. 这表明在离子交换吸附动力学实验中所得到的吸附平衡并不是真正的平衡,而是一种亚稳平衡,结果显示的平衡吸附量实际是亚稳平衡吸附量. 亚稳平衡吸附量的差异就代表了离子在带电颗粒表面吸附能力的差异,亚稳平衡吸附量越高,表明在吸附过程中的活化能越低,离子的吸附能力越强.
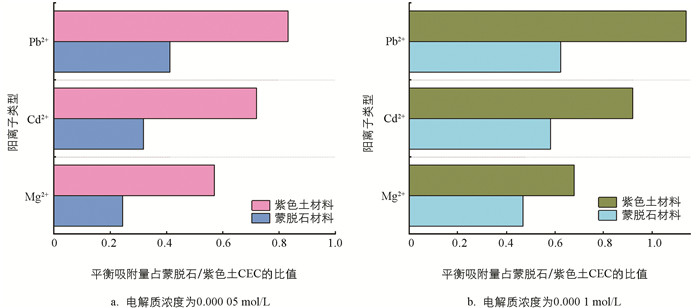
通过Mg2+,Cd2+,Pb2+在紫色土及蒙脱石表面的平衡吸附量与其相对应表面CEC的比值发现(图 5),在低电解质浓度条件下(5×10-5,1×10-4 mol/L),Mg2+,Cd2+,Pb2+在紫色土颗粒表面的平衡吸附量与紫色土CEC的比值,均大于3种离子在蒙脱石颗粒表面的平衡吸附量与蒙脱石CEC的比值(即亚稳吸附程度). 而当浓度继续增大时,3种离子在蒙脱石与紫色土表面的平衡吸附量与其相对应表面CEC的比值的差异则不明显,其原因可能为在不同条件下Mg2+,Cd2+,Pb2+所处环境的电场强度存在差异. 随着电解质浓度的升高,电场强度减弱,导致非对称杂化效应强度减弱,才使得Mg2+,Cd2+,Pb2+在蒙脱石/紫色土颗粒表面吸附能力的差别缩小.
-
根据离子吸附动力学的数据对蒙脱石/紫色土表面电化学参数进行计算[22].
式中:ϕd为距离矿物表面d位置处的电位值;γi为i离子的表观电荷系数;R为标准气体常数[J/(mol·K)];T为温度(K);张烨坤[20]经过胶体凝聚实验得到γMg/γNa=1.47;γCd/γNa=1.67;γPb/γNa=1.92. 而Li等[21]利用激光散射实验研究蒙脱石胶体活化能,估算出Na+在颗粒表面的表观电荷系数γ值为1.18. 本研究得到γMg=1.47×1.18=1.73;γCd=1.67×1.18=1.97;γPb=1.18×1.92=2.27,并代入下式中进行计算.
式中:σd为距离矿物表面d处的电荷密度(C/m2);Ni为i离子的平衡吸附量(mmol/kg);S为比表面积(m2/g).
式中:Ed为距离矿物表面d处的电场强度(mV/m);ε为水的介电常数,为8.9×10-10 C2/J dm. 当d=0时,即为矿物的表面电位(φ0):
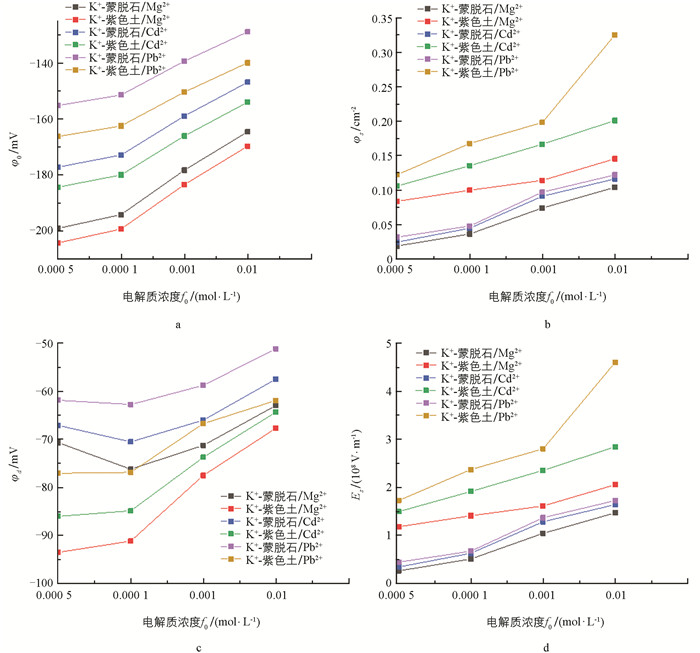
将计算所得不同交换体系中蒙脱石/紫色土表面电化学参数的计算结果列于表 2,为了便于对计算数据进行分析作图 6.
根据表 2及图 6可以得到,在相同电解质类型条件下,土壤/矿物表面电位的绝对值均随电解质溶液浓度的升高而减小,表明土壤/矿物表面电场也随着电解质溶液浓度的升高而减小,说明了高浓度电解质溶液对土壤/矿物表面电场的屏蔽作用更强;在相同电解质浓度条件下,Mg2+,Cd2+,Pb2+在紫色土颗粒的表面电位φ0的绝对值均大于在蒙脱石颗粒的表面电位φ0的绝对值. 以Mg2+为例,当电解质溶液浓度为5×10-5 mol/L时,紫色土颗粒的表面电位φ0的绝对值为204.30 mV,而在蒙脱石颗粒的表面电位φ0的绝对值为199.13 mV;当电解质溶液浓度升高至1×10-2 mol/L时,紫色土颗粒的表面电位φ0的绝对值为169.70 mV,而在蒙脱石颗粒的表面电位φ0的绝对值为164.52 mV. 皮小平[23]研究Li+,Na+,Cs+在高岭石表面吸附实验中发现,碱金属离子极化作用(非对称杂化效应)对高岭石颗粒表面电位产生影响. 本研究发现,土壤/矿物颗粒表面电位对离子的非对称杂化效应也存在巨大影响,表现为:土壤/矿物颗粒表面电位绝对值越大,阳离子受到的非对称杂化效应就越强,阳离子的吸附能力就越强;在相同电解质类型条件下,Mg2+,Cd2+,Pb2+达到吸附平衡时,阳离子距离土壤/矿物表面d处的电荷密度σd和电场强度Ed均随着电解质溶液浓度的升高而增大. 这是因为当电解质溶液浓度升高时,双电层厚度会被压缩,此时阳离子达到吸附平衡时距离土壤/矿物表面的d值(d为阳离子达到吸附平衡时距表面的距离)更小,即距土壤/矿物表面更近,导致对应位置的电荷密度和电场强度增大;在相同电解质浓度条件下,Mg2+,Cd2+,Pb2+达到吸附平衡时,在紫色土颗粒表面的电荷密度σd和电场强度Ed均大于蒙脱石颗粒表面,此处不能忽视表面电场的数量级可达10-7~10-8 V/m. 以Pb2+为例,当电解质溶液浓度为5×10-5 mol/L时,Pb2+达到吸附平衡时在紫色土颗粒表面的电荷密度σd为0.122 4 C/m2,电场强度Ed为1.728 1×108 V/m,而在蒙脱石颗粒表面的电荷密度σd为0.031 5 C/m2,电场强度Ed为4.445 0×107 V/m. 当电解质溶液浓度升高至1×10-2 mol/L时,Pb2+达到吸附平衡时在紫色土颗粒表面的电荷密度σd为0.325 9 C/m2,电场强度Ed为4.601 1×108 V/m;在蒙脱石颗粒表面的电荷密度σd为0.122 2 C/m2,电场强度Ed为1.725 7×108 V/m;在相同电解质类型条件下,各体系下φd的绝对值均小于该体系下的表面电位φ0的绝对值,并且φ0与φd差值的绝对值均随着浓度的增大而减小. 例如,在Mg2+交换K+-蒙脱石体系中,当浓度从5×10-5 mol/L依次增大至1×10-2 mol/L时,φ0与φd差值的绝对值分别为128.45,117.94,107.02,101.55 mV.
2.1. 不同浓度二价金属离子在K+-蒙脱石/K+-紫色土表面的吸附量
2.2. 不同交换体系下K+-蒙脱石/K+-紫色土的表面电化学性质
-
通过Mg2+,Cd2+,Pb2+3种离子在蒙脱石/紫色土颗粒表面的吸附动力学数据,比较Mg2+,Cd2+,Pb2+在蒙脱石/紫色土颗粒表面平衡吸附量与其CEC的比值,发现Mg2+,Cd2+,Pb2+在紫色土颗粒表面的吸附能力较在蒙脱石表面更强. 提出吸附材料电化学性质对离子吸附能力的影响问题. 通过吸附动力学实验数据和理论计算得出结论:在相同电解质浓度条件下,Mg2+,Cd2+,Pb2+在紫色土颗粒的表面电位φ0的绝对值均大于在蒙脱石颗粒的表面电位φ0的绝对值;Mg2+,Cd2+,Pb2+达到吸附平衡时,在紫色土颗粒表面的电荷密度σd和电场强度Ed均大于蒙脱石颗粒表面. 正是由于这些电化学性质的差异,才会出现Mg2+,Cd2+,Pb2+在紫色土颗粒表面的吸附能力比在蒙脱石颗粒表面更强的结果.






 DownLoad:
DownLoad: