-
开放科学(资源服务)标识码(OSID):

-
杂草防控是作物田间管理的重要环节,化学除草剂由于其高效、快速、经济等特点被广泛用于农业生产的除草作业中。近年来,在全球范围内,由于长期大规模使用单一或作用机制相同的除草剂,大量杂草种群主要通过改变功能蛋白质结构或增强对除草剂的代谢能力等多种机制形成了针对不同除草剂的抗药性[1]。为了提升杂草治理的科学性与精准度,科学地选择除草剂类型,减少无效施药作业,针对除草剂药效检测技术的研究显得尤为重要[2]。除草剂药效的检测技术主要包括生物测定技术、分子生物学技术以及生理生化技术等[3]。在作物发芽初期,除草剂的应用时机受到限制,导致可供执行施药的时间窗口相当有限,这一局限性对于除草剂药效评估的时效性提出了较高的标准。
叶绿素荧光检测被广泛应用于植物受到高温、低温、干旱、缺素、弱光、盐渍等胁迫以及不同施肥条件的研究中[4-6]。近年来,由于其非破坏性、高灵敏度和快速响应的优势,叶绿素荧光成像技术在除草剂对植物光合作用特性影响的研究领域已逐步得到应用[7]。具体而言,该技术在暗环境下利用特定波段光源照射经除草剂处理的杂草叶片,随后采用多通道叶绿素荧光光谱仪测量叶片中叶绿素发射的瞬时光合作用释放荧光的强度,以此来分析除草剂的药效情况。一般抗性植株叶片表面的荧光强度小,敏感性生物型叶片表面的荧光强度大[4]。
除草剂对杂草的作用效果是其自身毒力和环境因素综合作用的结果。田间环境因素不仅可以影响作物的生长,还可以通过多种途径影响杂草防控过程中除草剂药效的发挥[8]。针对田间杂草防控的药效评估,Wang等[9]设计研发出一种可应用于田间与温室环境的叶绿素荧光成像检测系统,可以通过植物光系统Ⅱ的最大光量子效率(QYmax)的比较来识别不同物种和不同自然生物类型的抗除草剂杂草。然而,该研究结果受到土壤含水量、温度等环境因素制约,在不控制环境变量的条件下,检测结果会受到不同程度的影响,而土壤含水量显著影响除草剂对杂草的防控效果。在土壤水分充足的条件下,作物和杂草生长旺盛,有利于杂草对除草剂的吸收和内部传导,从而提高除草效果。相反,土壤干旱不仅抑制作物和杂草的生长,减弱作物对药剂的分解能力,还可能导致杂草形成较厚的角质层,减少药剂吸收,并因气孔关闭和根系发达而增加防除难度[10-11]。在针对水分状况以及除草剂对紫色莎草防治效果影响的研究中发现,缺水胁迫在影响紫草块茎的数量和生物量的同时,也影响了除草剂的效率[12]。在针对地肤杂草的研究中也出现了类似的结论:在较低的土壤水势下,丙炔氟草胺和茚嗪氟草胺对植物毒性显著降低[13]。目前大量研究表明,土壤含水量对除草剂的杂草防控效果具有显著的影响,因此土壤含水量是除草剂药效检测过程中需要重点考虑的因素。
反枝苋是一种分布于中国多地的农田杂草,对湿润、干旱等不同的农田与草原环境展现出极高的表型可塑性和基因变异能力,造成了严重的生态影响[14-15]。反枝苋能在多种农作物中混生,阻碍通风,消耗养分,抑制作物生长,降低作物产量。此外,反枝苋还能污染种子,并作为多种病虫害的寄主,进一步加剧了对农业生态的破坏[16]。鉴于反枝苋对农业生产带来的高危害性,本研究采用反枝苋作为供试杂草开展试验工作。
综上所述,目前利用叶绿素荧光成像技术进行的除草剂药效检测模型,没有充分考虑到田间土壤含水量因素对除草剂药效的影响。因此,本研究针对3种不同作业模式的除草剂在不同土壤含水量下对反枝苋呈现的防控效果,研究不同作用模式除草剂对反枝苋的QYmax带来的差异化影响,分析不同土壤含水量情形下除草剂胁迫呈现的结果和内在原因,以期为基于叶绿素荧光的除草剂药效检测模型校正提供理论基础,进而指导当季除草剂施用类型的合理选择。
HTML
-
反枝苋种子采集于江西省赣州市会昌县,2022年12月至2023年8月,在西南大学温室大棚里对反枝苋种子进行萌发处理,利用15 cm×20 cm的多孔托盘铺满蛭石(灵寿县艺川矿产品加工厂,颗粒大小为3~6 mm)进行种子萌发。当种子萌发至两叶一心时,将幼苗移栽到6.5 cm×6.5 cm×7.5 cm育苗盆(4株/盆)中,填充40 g有机营养土(史丹利农业集团股份有限公司,有机质≥60%)。植株在16 h光照时长和8 h黑暗时长的光循环中生长,温度保持在25 ℃。所有的育苗盆都被放置在一个完整的随机区块设计中,有4个区块。试验土壤的最大持水量由环刀法测得为290 g/kg。移栽后的供试杂草被分为5组,分别对应5个不同的土壤含水量:保持土壤最大持水量20%、保持土壤最大持水量40%、保持土壤最大持水量60%、保持土壤最大持水量80%、保持土壤最大持水量100%,通过每天浇灌不同的水量来控制土壤水分,如表 1所示。在供试杂草三叶一心时期,选用3种具有不同作用模式的除草剂,依照推荐使用剂量处理操作,如表 2所示,所有试验处理拥有3个重复。除草剂喷施试验处理通过实验室喷雾试验平台(图 1)实现,平台滑轨处安装1个高压雾化喷头,喷头通过气泵提供压力(0.3 Mpa)实现除草剂的均匀喷施,喷施范围呈扇形,流量为0.84 L/min,利用定速滑轨实现喷头的均匀移动,在育苗盆表面以上50 cm处进行喷施操作。空白对照处理用清水也进行相同操作。该试验于2023年2月至3月以及7月至8月在西南大学重复了2次,对2个试验的数据取平均值。
-
在整个试验阶段结束后,利用AL204电子天平(梅特勒—托利多仪器有限公司,0.000 1 g精度)测量反枝苋根上部茎叶的鲜质量与干质量。测量干质量之前,将受试反枝苋利用电热鼓风干燥箱(GZX-9023MBE,干燥温度最高200 ℃)进行烘干处理,温度控制在105 ℃±1 ℃,烘干12 h。
叶绿素荧光检测采用FluorCam大型植物多光谱荧光成像平台(图 2),系统由LED激发光源、CCD荧光成像镜头及滤波轮等集成于一个高度可上下自由移动的成像平台上。标配620 nm红色光源、冷白光双色光化学光源与735 nm红外光源,LED光源板面积为750 mm×750 mm。高分辨率CCD相机图像分辨率为1 360×1 024像素,在最高图像分辨率下可达每秒20帧,采用动态视频模式来测量叶绿素荧光参数,具备7位滤波轮及相应的滤波器。使用FluorCam 7软件去除背景噪声,该软件还用于控制光源类型和相机灵敏度,并可以作为荧光参数数据处理中心和荧光图像发生器。荧光图像将在该软件中进行初步处理,成像预处理可以自动选区或手动选择不同形状、不同数量以及不同位置的区域(Region of Interest,ROI),依据样品荧光的强弱,给成像图添加相应的颜色。彩标刻度采用软件中的可见光光谱彩标(Extended Spectrum)。计算得到的各项荧光参数,具备“信号计算再平均”模式和“信号平均再计算”模式,在高信噪比的情况下选用“信号计算再平均”模式,在低信噪比的情况下选择“信号平均再计算”模式。本研究主要利用反枝苋研究除草剂胁迫的情况,会出现生理状态较差、荧光现象较弱并且图像噪点较多的情况。为了避免荧光参数过低导致背景噪声过大的情况,选用“信号平均再计算”模式来过滤噪声带来的误差。
试验前期,利用未受到胁迫、生长良好的反枝苋进行预试验,结果表明在最大饱和光强30%及以上的脉冲作用下,空白对照样本的QYmax稳定在0.79左右,已达到饱和点,由此确定正式试验的饱和光强。其他相关参数根据设定要求如表 3所示。本研究假设所选传感器可以检测土壤含水量的单因素胁迫(即使可能存在其他非生物胁迫)。在施药后的1~7 d,利用叶绿素荧光成像系统检测反枝苋的光合作用情况以及叶绿素荧光图像,在每个测量日期的上午9~12点进行测量。叶绿素荧光成像检测前进行暗适应处理,利用遮光布使供试杂草在黑暗环境中处理30 min。
采用FluorCam传感器检测的反枝苋QYmax进行数据分析。QYmax表示光系统Ⅱ吸收的光能用于还原原初电子受体QA的最大效率,被视作评估植物健康状况的关键指标[17],即Fv/Fm。Fv为Fm-F0,F0作为暗适应条件下所呈现出的最小荧光,亦被称作初始荧光,其能够表征QA处于最大氧化状态;而Fm则是暗适应条件下的最大荧光,可体现QA处于最大还原状态。非胁迫条件下QYmax的变化极小,不受物种和生长条件的影响,但在胁迫条件下该参数明显下降。
-
使用R v4.3.0、SPSS 26和Origin 2021软件对数据进行分析和绘图,以此来确定不同除草剂处理是否显著影响反枝苋的生理状况,并研究在除草剂胁迫和不同土壤含水量条件下,反枝苋叶绿素荧光参数值是否可以区分。方差分析显示重复试验之间没有显著性差异(p>0.05),因此所有重复试验的数据均被收集。为了对除草剂胁迫与空白对照之间的差异进行比较,对鲜质量、干质量进行独立样本t检验;为了对除草剂变量胁迫下的差异进行比较,对除草剂单因素影响的结果进行ANOVA检验(p<0.05);为了分析时间和土壤含水量这2个因素对QYmax产生的影响,对多因素影响的结果进行方差分析和事后LSD检验(p<0.05)。
1.1. 试验设计
1.2. 评价指标
1.3. 数据分析
-
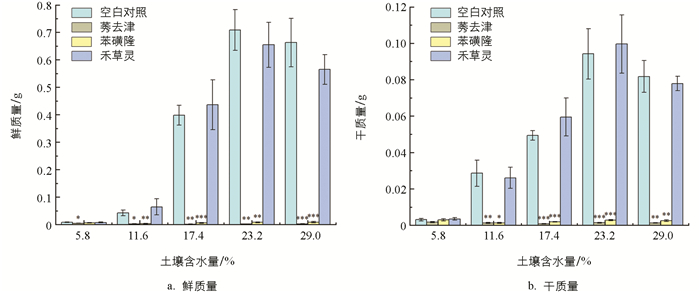
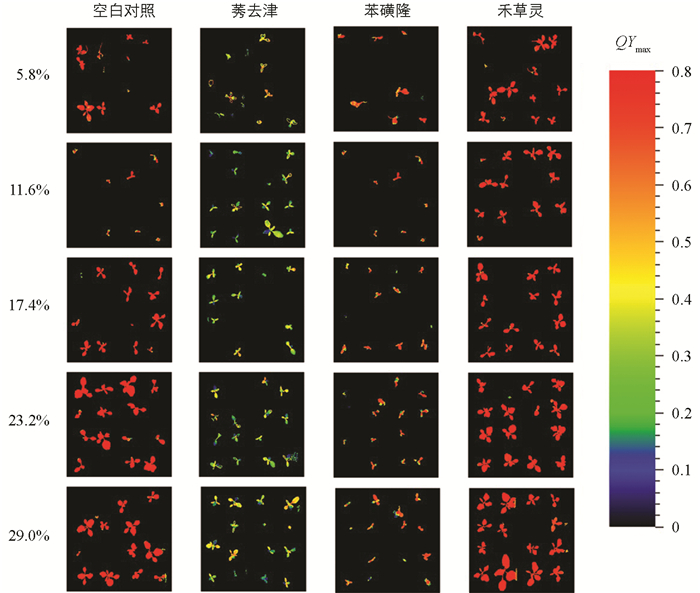
如图 3所示,在11.6%、17.4%、23.2%、29.0%的土壤含水量条件下,以及莠去津和苯磺隆胁迫下,反枝苋的鲜质量与干质量都显著低于空白对照组;在5.8%的土壤含水量条件下,以及莠去津胁迫下,反枝苋的鲜质量显著低于空白对照组,反枝苋干质量和空白对照组未体现显著性差异;在5.8%的土壤含水量条件下,苯磺隆胁迫的反枝苋鲜质量与干质量相较于空白对照组,未体现出显著性差异。禾草灵胁迫下,反枝苋的鲜质量与干质量在所有土壤含水量条件下相较于空白对照组,未体现出显著性差异。在测定除草剂效果时,鲜质量的测量比干质量更具参考价值,因为即便是新近死亡或已坏死的植物,其干质量可能与健康、绿色的植株持平[18]。由反枝苋鲜质量与干质量的测定结果可以得出,莠去津处理和苯磺隆处理显著抑制了反枝苋正常的生长,而禾草灵处理对反枝苋的生长活动并无显著影响。可以认为莠去津和苯磺隆2种除草剂明显抑制了反枝苋的生理状况,其中莠去津的效果比苯磺隆更大。但是在5.8%的土壤含水量条件下,由于极低的土壤水分影响了空白对照组中反枝苋的正常生理活动,可能会使反枝苋的物质累积进程衰减至与受莠去津和苯磺隆抑制后相仿的状况。禾草灵处理的药效对反枝苋不明显。根据反枝苋鲜质量与干质量的数据可知,反枝苋在23.2%的土壤含水量下生长状况最好,在29.0%、17.4%、11.6%、5.8%的土壤含水量条件下依次变差(图 4)。
-
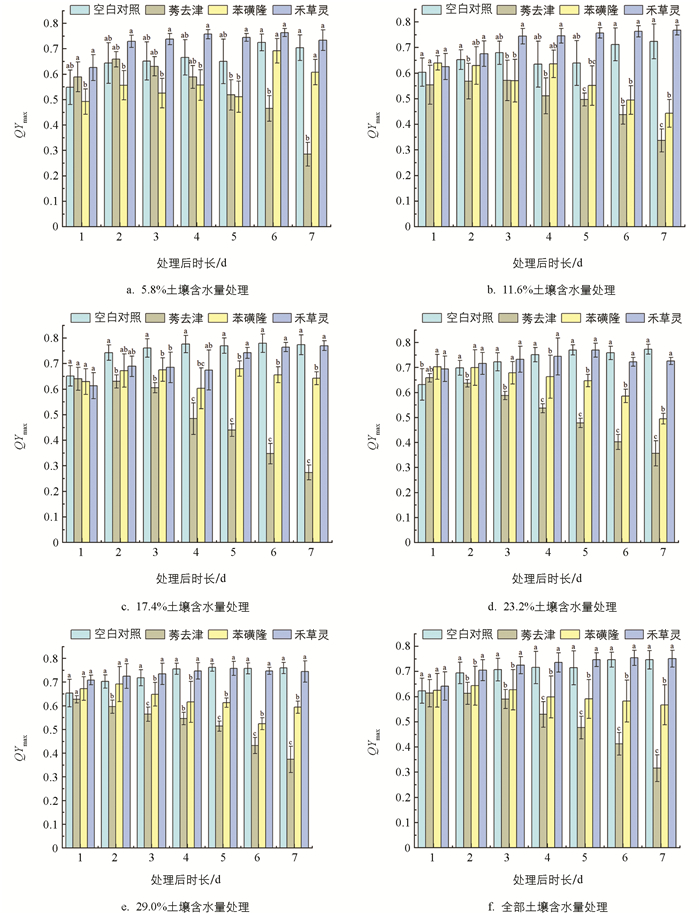
根据图 5f的单因素方差分析结果表明,莠去津和苯磺隆胁迫下,反枝苋的QYmax在处理1 d之后被显著抑制,并且莠去津的影响比苯磺隆更为显著。这种影响随时间的增加而变强,并在4 d时,莠去津和苯磺隆之间也产生了显著性差异,这说明莠去津对反枝苋QYmax的影响更为剧烈。禾草灵的胁迫在7 d内,对反枝苋的QYmax没有显著性的影响。空白对照条件和禾草灵胁迫下,反枝苋的QYmax先逐渐上升,之后趋于稳定;莠去津和苯磺隆胁迫下,反枝苋的QYmax逐渐下降,并且反枝苋QYmax的下降幅度,在莠去津胁迫下的要大于苯磺隆胁迫下的。
图 5c、5d、5e的试验结果显示,此3组处理在显著性差异的表达及变化趋势方面,与图 5f所得结果具有相似性。由图 5b的结果可知,在苯磺隆胁迫下,反枝苋的QYmax呈现出不显著的下降态势;而在禾草灵胁迫下,反枝苋的QYmax于2~4 d内与空白对照组相比呈现出显著性差异。根据图 5a的结果显示,在莠去津胁迫下,反枝苋的QYmax直至5 d才与空白对照组呈现出显著性差异;在1~4 d内,空白对照组及莠去津胁迫下反枝苋的QYmax相对于苯磺隆胁迫下反枝苋的QYmax呈现出显著性差异;并且苯磺隆胁迫下反枝苋的QYmax并非如图 5f的结果一样呈下降趋势,而是呈现出无规律的波动状态。图 5a与图 5b的结果可能是因较低的土壤含水量干扰了反枝苋的正常生理活动,进而导致莠去津和苯磺隆对反枝苋的QYmax产生抑制效应,相较于其他土壤含水量(17.4%、23.2%、29.0%)处理呈现出滞后特性。
-
由2.1节和2.2节的结果可知,禾草灵对反枝苋的鲜质量、干质量和QYmax没有显著影响,因此不讨论禾草灵胁迫下时间和土壤含水量对反枝苋QYmax的交互作用影响。通过分析莠去津和苯磺隆胁迫下时间和土壤含水量对反枝苋QYmax的交互作用影响,可以更好地探究不同土壤含水量下反枝苋受除草剂胁迫时QYmax在时间尺度上的变化规律。
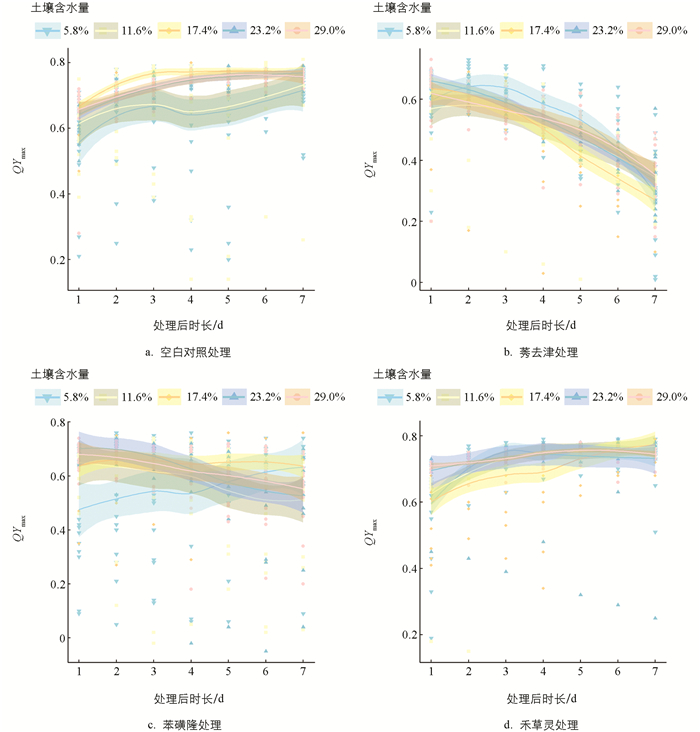
方差分析结果提供了充分的统计证据,在莠去津和苯磺隆胁迫下,土壤含水量和时间对反枝苋的QYmax有显著影响,如表 4和表 5所示。事后分析结果表明:莠去津胁迫下,5.8%土壤含水量处理的反枝苋QYmax最大,为0.531 9;17.4%土壤含水量处理的反枝苋QYmax最小,为0.479 2。苯磺隆胁迫下,17.4%土壤含水量处理的反枝苋QYmax最大,为0.649 4;5.8%土壤含水量处理的反枝苋QYmax最小,为0.555 1。
莠去津胁迫下时间和土壤含水量对反枝苋QYmax产生影响的双因素交互作用的p值为0.000 998 6,小于α(0.05),有95%的统计置信度,可以证明时间和土壤含水量的相互作用会影响莠去津胁迫下反枝苋的QYmax。后置LSD检验结果表明:7 d时,17.4%土壤含水量处理下反枝苋的QYmax最小,平均为0.271 3;1 d时,反枝苋的QYmax在23.2%土壤含水量处理下最大,平均为0.658 8。由图 6b可知:在除草剂胁迫后的2~5 d,反枝苋的QYmax在5.8%土壤含水量处理下大于其他土壤含水量的处理;在除草剂胁迫后的4~7 d,反枝苋的QYmax在17.4%土壤含水量处理下小于其他土壤含水量的处理,这与事后分析结果相符。
苯磺隆胁迫下时间和土壤含水量对反枝苋QYmax产生影响的双因素交互作用的p值为2.639×10-5,小于α(0.05),有95%的统计置信度,可以证明时间和土壤含水量的相互作用会影响苯磺隆胁迫下反枝苋的QYmax。后置LSD检验结果表明:1 d时,反枝苋的QYmax在5.8%土壤含水量处理下最小,平均为0.475 0;2 d时,反枝苋的QYmax在23.2%土壤含水量处理下最大,平均为0.701 3。由图 6c可知,在除草剂胁迫后的1~4 d,反枝苋的QYmax在5.8%土壤含水量处理下小于其他土壤含水量处理,但呈升高的趋势,反枝苋的QYmax在11.6%、17.4%、23.2%、29.0%土壤含水量处理下呈降低趋势。
由图 6a可知,在空白对照条件下,较低土壤含水量处理的反枝苋QYmax低于较高土壤含水量处理的反枝苋QYmax,且呈现出缓慢递增的趋势。基于莠去津与苯磺隆对反枝苋QYmax的影响结果,并与空白对照进行对比分析,可得出:莠去津对反枝苋QYmax的抑制效能显著强于苯磺隆;在较低的土壤含水量(5.8%土壤含水量)条件下,莠去津与苯磺隆对反枝苋QYmax的抑制效应呈现出较为迟缓的态势;在适宜的土壤含水量条件下(17.4%土壤含水量),莠去津对反枝苋QYmax呈现出最为显著的抑制效果。
2.1. 生理指标
2.2. 除草剂单因素分析
2.3. 多因素分析
-
本研究测定试验后的反枝苋鲜质量与干质量,得出如下结果:在5.8%土壤含水量处理时,空白对照组反枝苋的干质量与莠去津、苯磺隆处理组反枝苋的干质量未呈现出显著性差异;而当土壤含水量为11.6%、17.4%、23.2%、29.0%进行处理时,空白对照组与莠去津、苯磺隆处理组之间则具有显著性差异(图 7)。可以认为,在土壤含水量为5.8%的条件下,莠去津与苯磺隆对反枝苋的抑制作用极为微弱,甚至可视为无明显影响,这和前人研究发现的随着土壤湿度的降低,PRE除草剂对地肤杂草的药效显著降低的结果是相似的[13]。因此,本研究聚焦于土壤含水量对除草剂胁迫下反枝苋荧光参数变化的影响,其具备坚实的生理依据支撑。
光合作用主要包括原初反应、电子传递和碳同化3个过程。光系统Ⅱ(PSII)的反应中心色素P680在光激发下产生强氧化作用,促进水分子氧化,启动电子传递链,电子依次通过多个受体最终传递至光系统I(PSI)。PSI的反应中心P700在光激发下迅速传递电子至NADP+,完成电子的传递。此外,PSII的QYmax反映其吸收光能还原QA的最大效率。如果QA还原受阻,PSII的电子传递链会中断,影响植物光合作用和生长。莠去津通过阻碍电子传递到质体醌,直接影响电子传递过程,导致植物细胞损伤甚至死亡[19]。试验结果中,经莠去津胁迫的反枝苋QYmax与其余3组处理(空白对照、苯磺隆、禾草灵)相较,呈现出显著性差异,这与前人研究的结果一致,莠去津总能显著地影响植物的QYmax[20-21]。
在光合作用中,PSII通过吸收光能裂解水分子,释放电子至质体醌,并通过水氧化及PQB2-的还原,在类囊体膜两侧形成H+质子梯度。水的充足与否是电子传递的关键,缺水会减慢水氧化,减少电子产生,影响QA的还原,进而影响QYmax。莠去津通过替代质体醌结合电子,影响光合作用,其效率在缺水时比水充足时低,对还原QA的影响也相对较弱[22]。本研究中,莠去津胁迫且处于5.8%土壤含水量处理下的反枝苋QYmax最低,此结果为上述论证提供了有力佐证。而且随着时间和土壤含水量2个因素的交互影响,尽管反枝苋的QYmax整体呈下降趋势,然而在5.8%土壤含水量处理下,反枝苋的QYmax始终相较其他土壤含水量处理略高。学者指出,土壤水分胁迫降低了光合结构遭受破坏的风险[23],恰是土壤水分与除草剂的协同作用,致使5.8%土壤含水量处理下受莠去津胁迫的反枝苋QYmax相较于其他土壤含水量处理下呈现出滞后特性。关于在17.4%土壤含水量处理下比其他土壤含水量处理下的反枝苋QYmax较低,是由于当水分已经足够支撑光合作用中的电子传递时,更多或更少的水分并不能显著改变电子产生的速率,也就无法影响电子传递过程的速率。当电子传递过程的效率不是决定因素时,那更适宜的生长环境更能使除草剂发挥作用。前人研究发现,莠去津在适中的土壤湿度条件下,除草剂IC50值要更低,诱导凋亡能力更强,这和本研究的结果相符[24]。
苯磺隆属于一种选择性内吸式传导除草剂,其可经杂草的根与叶进行吸收,进而在杂草体内实现传导扩散。它通过结合并抑制乙酰乳酸合成酶的活性,阻断杂草体内3种支链氨基酸的合成,影响蛋白质和DNA的生成,导致杂草有丝分裂受阻,最终停止生长并死亡[18]。研究结果表明,在苯磺隆胁迫下,反枝苋的QYmax数值与空白对照相比,亦呈现出显著性差异。由上文可知,QYmax表示PSII吸收光能用于QA还原的最大效率。PSII包括2个捕光复合物LHCII(由数百个叶绿素和类胡萝卜素分子组成)和1个光反应中心。PSII的功能也依赖于其他蛋白质,如反应中心色素蛋白复合体和外周蛋白。苯磺隆通过抑制蛋白质合成,影响这些组成物质的合成,从而降低PSII还原QA的效率,致使苯磺隆胁迫下反枝苋的QYmax显著低于空白对照组的相应数值[25]。但是又因为苯磺隆抑制蛋白质的合成,却不影响已经生成的蛋白质,所以导致了苯磺隆对PSII系统正常运转的抑制效果弱于莠去津,因此在研究中,苯磺隆胁迫下反枝苋的QYmax显著高于莠去津胁迫下的数值。
在研究结果中,反枝苋的QYmax在苯磺隆胁迫下虽整体数值显著低于空白对照组,但是整体下降趋势不明显,在5.8%土壤含水量处理下,反枝苋的QYmax呈现出上升态势。脱氧核糖核酸(DNA)是由许多核苷酸单体聚合成的生物大分子化合物,而核苷酸合成核酸的时候需要消耗水。当苯磺隆抑制蛋白质和DNA的合成时,本该用于消耗这部分的水分,就会转移到其他生理过程中。可以认为,5.8%土壤含水量处理的苯磺隆胁迫下,本该用于合成蛋白质和DNA的水分被用来参与到PSII系统的电子传递反应中,因此反枝苋的QYmax呈现逐渐上升的趋势。而11.6%、17.4%、23.2%、29.0%的土壤含水量处理由于有充足的水分,从一开始就有足够的水分去支持PSII系统的电子传递反应,因此在苯磺隆胁迫下,反枝苋前期的QYmax高于在5.8%土壤含水量处理下反枝苋的QYmax。但是由于没有后续的蛋白质合成,还原QA的最大效率还是缓慢降低。前人研究证明了,对于同为草本植物的水稻,干旱诱导的支链氨基酸转氨酶(OsDIAT)介导水稻中支链氨基酸的积累以应对干旱胁迫,表明了支链氨基酸氨基转移酶的作用[26],此情形与苯磺隆胁迫低土壤含水量处理下对反枝苋QYmax的影响结果具有相似性。苯磺隆影响氨基酸的合成,并不影响其转移,使较低的土壤含水量(5.8%)处理下的反枝苋QYmax在受抑制的结果中表达出抗性。
禾草灵属于脂肪酸合成酶抑制剂范畴,其主要应用于禾本科杂草的防治,对阔叶杂草并无药效。试验结果亦呈现出相似情形:经禾草灵胁迫后,反枝苋的鲜质量、干质量以及QYmax与空白对照处理相较而言,未出现显著差异。此现象是由反枝苋自身的杂草种类特性所主导的。
综上所述,莠去津与苯磺隆的胁迫对反枝苋的QYmax产生显著影响。与适宜土壤含水量条件相比,在低土壤含水量(5.8%)的情形下,莠去津和苯磺隆的胁迫作用呈现出微弱且迟缓的特征。在后续的研究与应用过程中,可通过对比不同土壤含水量下杂草受除草剂胁迫后的QYmax,以此实现对除草剂药效的分析与判定。
-
1) 本研究证明了土壤含水量的不同可以明显地影响除草剂对反枝苋的药效,这种对药效的影响可以通过叶绿素荧光参数QYmax的变化呈现出来。
2) 本研究探究了不同土壤含水量条件下不同作用模式除草剂对反枝苋荧光参数QYmax的不同影响:较低的土壤含水量(5.8%)会延缓莠去津和苯磺隆的抑制作用。叶绿素荧光成像技术可以反映出受除草剂胁迫以及不同土壤含水量情况下,反枝苋荧光参数的响应特征,并能清晰地观察到整个反枝苋受损程度的变化过程,在农田杂草防控中具有一定的应用潜力。








 DownLoad:
DownLoad: