-
开放科学(资源服务)标识码(OSID):

-
核桃(Juglans regia L.)为胡桃科(Juglandaceae)胡桃属(Juglans)树木,是我国重要的经济林木,以城口县为代表,重庆市有悠久的核桃种植历史[1]。细菌性黑斑病是核桃上的三大病害之一,在我国北京、山东等地及韩国、立陶宛、波兰[2-6]等核桃种植区均有报道,为世界性核桃病害。核桃细菌性黑斑病染病叶片初期大多表现为带有黄色晕圈的不规则黑斑,病部呈现水渍状,严重时造成核桃组织腐烂坏死。王瀚等[7-8]报道甘肃陇南地区核桃细菌性黑斑病的病原物为野油菜黄单胞菌(Xanthomonas campestris)和成团泛菌(Pantoea agglomerans);肖波等[9]报道云南地区核桃细菌性黑斑病的病原物为树生黄单胞菌(X. arboricola)和成团泛菌(P. agglomerans);瞿佳等[10]报道陕西地区的核桃细菌性黑斑病的病原物为野油菜黄单胞菌(X. campestris)和成团泛菌(P. agglomerans)。根据前期的研究发现核桃细菌性黑斑病的病原物主要为野油菜黄单胞菌[11-13]和成团泛菌[14-15]。这两种病原物寄主广泛,除了侵染核桃树,也能侵染李子树、桃树、苹果树等经济林木[16-17]。成团泛菌在空气中广泛存在,与植物共生或者在植物体内生,对植物存在机会性侵染[18],虽然成团泛菌分离率更高,但野油菜黄单胞菌具有比成团泛菌更强的侵染力。
分子标记技术(Molecular Markers)出现于1974年。分子标记以个体间遗传物质内的核苷酸序列变异为基础,反映DNA水平遗传多态性,自第一代分子标记技术限制性片段长度多态性标记RFLP[19]开发以来,又陆续发现了RAPD(随机扩增多态DNA标记技术)[20]、AFLP(扩增片段长度多态性)[21]、SSR(简单重复序列)[22]和ISSR(简单序列重复区间)[23]分子标记技术。分子标记分型技术应用广泛,早在1987年Lazo等[24]就已经利用RFLP技术对野油菜黄单胞菌进行致病变种类型研究,分子标记技术相比于传统的遗传标记方法如形态学标记、代谢表型标记、化学标记等方法具有稳定性强,可处理信息量大,方便快捷的优点,成为研究种群遗传结构的重要研究方法。指纹图谱技术是从选取细菌基因组中的短重复回文序列中的保守区段BOX插入因子[25-26]和大肠杆菌基因间共有重复序列ERIC[27-28]进行多态化扩增,电泳后能获得分离株的指纹图谱,通过多态性条带分布情况来对菌株分型。马来西亚研究人员成功运用该方法对为害当地橡胶产业的短小芽孢杆菌进行了遗传多样性分析[29]。该方法简便快捷,易于在实验室操作,成为目前实验室常用的细菌群体遗传分析分子标记技术。
重庆市长江中上游地区是核桃规模化种植区,以城口县为代表,栽培面积达到2万hm2,核桃年产量达到3 000万t,核桃产业是重庆市重要的支柱产业。近年来,核桃细菌性黑斑病频繁暴发,目前对重庆市核桃细菌性黑斑病的研究较少,且未建立完善的核桃细菌性黑斑病防控体系。核桃细菌性黑斑病的发生导致核桃园减产,严重打击了重庆市核桃种植户的积极性,阻碍了核桃产业的向好发展[30]。本研究通过采集重庆市核桃病害样品,进行系统性的病原鉴定分析,明确为害重庆市核桃的细菌性黑斑病病原种类,在此基础上进行病原菌群遗传多样性分析,评判重庆市病原菌群适应环境变化能力,旨在为核桃细菌性黑斑病的绿色防控奠定实践基础。
HTML
-
本研究于2022年4月至2023年7月踏查重庆市14个区(县)核桃种植园,采集显现细菌性黑斑病症状的病害样品并记录细菌性黑斑病的田间症状,共从重庆市14个区(县)采集包括叶片、枝杆和果实120份样品,样品信息和编号如表 1所呈现,其中石柱土家族自治县、秀山土家族苗族自治县、彭水苗族土家族自治县分别简称为石柱县、秀山县、彭水县。
-
使用营养琼脂固体培养基(NA)来培养和纯化病原菌、使用Luria-Bertani液体培养基(胰蛋白胨10.0 g/L、酵母提取物5.0 g/L、氯化钠10.0 g/L)来培养菌,制备菌液。
-
27F/1492R引物[31]扩增病原菌16S rDNA序列,用于鉴定病原菌种类;ERIC1R/ERIC2[32]用于扩增大肠杆菌基因间共有重复序列,BoxA1R为单引物[33],扩增BOX插入因子,通过多态化扩增结果对病原菌进行分型。本研究所用的引物如表 2所示,由生工生物工程(上海)股份有限公司合成。
-
采用组织分离法从病害样品中分离出病原细菌,按照细菌总DNA提取试剂盒(北京全式金公司,EE161-01)说明书方法提取菌株DNA,PCR扩增体系:2×Taq Master Mix酶10 μL,27F/1492R各1 μL,DNA样品1 μL,ddH2O 7 μL。按照表 2所示PCR程序进行扩增,将PCR扩增产物进行凝胶电泳检测,切胶回收长度为1 500 bp左右的扩增产物,按照DNA胶回收试剂盒使用说明纯化回收PCR产物,将DNA扩增产物送生工生物工程(上海)股份有限公司测序。将测序结果上下游序列拼接后于NCBI网站进行Blast比对,鉴定病原菌的属种。
-
使用接种环蘸取病原细菌菌液在NA固体培养基上划线,置于28 ℃培养基培养,分别于培养1 d、2 d、3 d观察单菌落形态特征并拍照记录。
-
制备浓度为108 CFU/mL的病原菌液,采摘生长状况一致的健康核桃叶片,将托盘用75%乙醇擦洗干净后铺上一层无菌纱布,倒上适量的无菌水,放上“L”形玻璃支架。将叶片清洗干净后晾干,用灼烧灭菌的挑针刺伤叶片,将处理后的叶片放在玻璃支架上。用灼烧灭菌的接种环蘸取菌液涂抹于伤口周围,对照组使用无菌水涂抹。用纱布蘸取无菌水包裹叶柄,托盘用塑料膜封住保湿,于25 ℃温室中保湿培养5 d左右观察结果。将发病叶片病组织再次进行组织分离,将纯化培养物在平板上划线观察并进行16S rDNA分子检测,比对回接材料分离物与分离菌株是否为同一种微生物。
-
挑选获得的核桃细菌性黑斑病分离株共47株,PCR体系:2 × Taq Master Mix酶,上下游引物各1 μL,DNA样品3.5 μL,加ddH2O补足25 μL。使用ERIC1R、ERIC2扩增大肠杆菌基因间共有重复序列,BoxA1R扩增BOX插入因子序列(PCR扩增程序详见表 2)。
将扩增产物进行凝胶电泳(电压146 v,电流277 mA,时间20 min)后拍照,对不同样品的多态性条带分布进行统计,样品在等位基因位点有条带记为1,无则记为0,将电泳图谱整理成0/1矩阵形式的Excel表格,使用NTSYS 2.10软件进行基于UPGMA算法的聚类分析,根据重庆市地貌特征将不同区(县)的菌株样品划分为3个居群(表 3),使用Popgene 1.32软件计算样品的遗传多样性参数。
1.1. 材料
1.1.1. 病害样品采集
1.1.2. 供试培养基
1.1.3. 所用引物
1.2. 试验方法
1.2.1. 16S rDNA分子鉴定
1.2.2. 病原菌单菌落形态观察
1.2.3. 柯赫氏法则证病
1.2.4. 遗传多样性分析
-
在田间采样发现,细菌性黑斑病为害重庆核桃的叶片、枝杆和果实。定期对重庆市北碚区天府镇中心村(106°28′E,29°50′N)的核桃进行观察发现,核桃在3月长出新叶,4月开花,该时期部分叶片出现小黑点;5月核桃长出幼果,此时叶片上出现明显的多角状黑斑;7、8月雨量增大,核桃的叶片、枝杆、果实出现大面积黑斑,植株组织腐烂流出脓水,核桃园受害严重。其具体表现为叶片上出现黑色,多角形病斑,部分病斑周围显现黄色晕圈;枝杆上为条状黑褐色斑块,病斑部位呈水腐状,树皮及韧皮部变黑腐烂,潮湿时韧皮部下方有菌脓;果实受害时表皮出现黑色斑块,后迅速扩大渐凹陷变黑,外围有水渍状晕纹,严重时果仁变黑腐烂(图 1)。
-
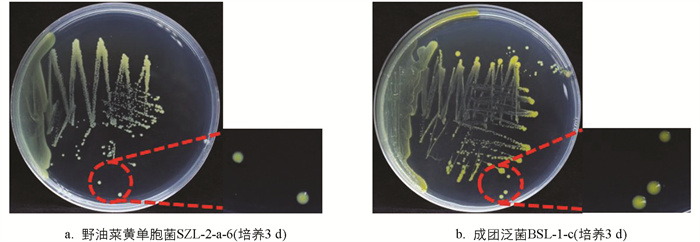
接种在NA固体培养基上的野油菜黄单胞菌和成团泛菌单菌落均为光滑乳脂状,初期1~2 d为乳白色菌落,随着野油菜黄单胞菌和成团泛菌黄原胶等色素类物质[34]的产生,培养3 d后野油菜黄单胞菌呈淡黄色,成团泛菌呈蜡黄色(图 2)。
-
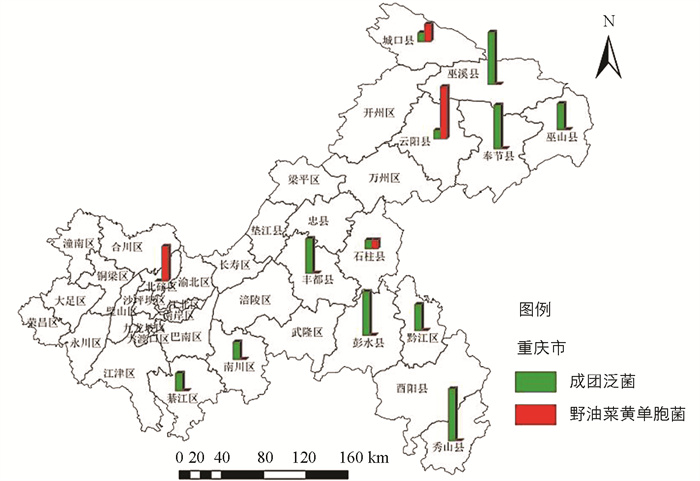
通过DNA测序获得病原菌16S rDNA区段碱基序列,在NCBI网站上与野油菜黄单胞菌(NR119219)、成团泛菌(AB907779)进行DNA碱基序列比对,明确了重庆市核桃细菌性黑斑病的病原菌为野油菜黄单胞菌、成团泛菌。从120份样品中分离到病原细菌54株,其中成团泛菌41株,占比75.9%,分离自綦江区、南川区、丰都县、彭水县、黔江区、秀山县、奉节县、云阳县、巫山县、巫溪县、城口县、石柱县。野油菜黄单胞菌13株,占比24.1%,分离自城口县、云阳县、北碚区、石柱县(图 3、表 4)。
-
用针刺法将病原菌接种至离体核桃样品,5 d后观察到处理组接种部位与对照组相比有明显的黑斑出现,黑斑边缘不规则且呈水渍状,离体接种叶片发病症状与田间病害样品症状相似。将发病的回接材料组织分离纯化,通过形态学观察和16S rDNA鉴定到接种菌和回接材料分离物为同一种细菌微生物,证明病原分离株能侵染核桃植株引起核桃细菌性黑斑病。
-
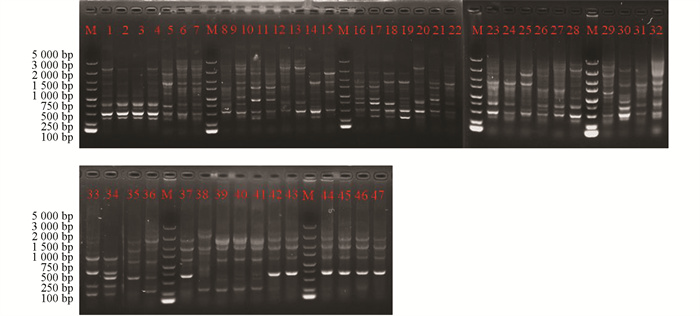
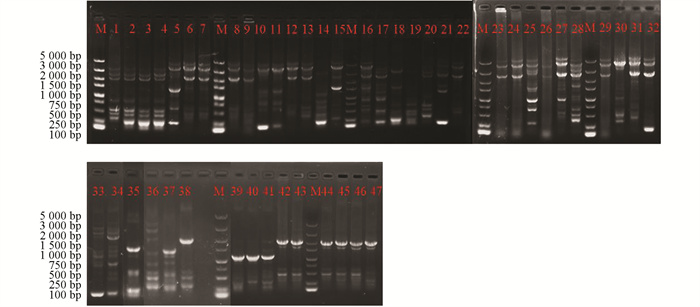
采用rep-PCR技术对本研究所获得的菌株进行ERIC多态化片段扩增(图 4)和BOX多态化片段扩增(图 5),并对获得的多态性条带进行统计。结果显示:野油菜黄单胞菌ERIC多态化片段扩增,片段长度为100~5 000 bp,共计7个总位点,7个多态性位点,多态性比率为100%;BOX多态化片段扩增,片段长度为500~5 000 bp,共计6个总位点,5个多态性位点,多态性比率为74.5%。成团泛菌ERIC多态化片段扩增,片段长度为100~5 000 bp,共计11个总位点,11个多态性位点,多态性比率为100%;BOX多态化片段扩增,片段长度为500~5 000 bp,共统计到9个总位点,8个多态位点,多态性比率为81.6%。
-
根据多态片段扩增结果,统计电泳图谱上的等位条带,将电泳图谱转化为0/1矩阵,将矩阵数据代入NTSYS 2.10软件绘制聚类分析图谱,用Popgene 1.32软件计算菌群遗传多样性相关指标参数。
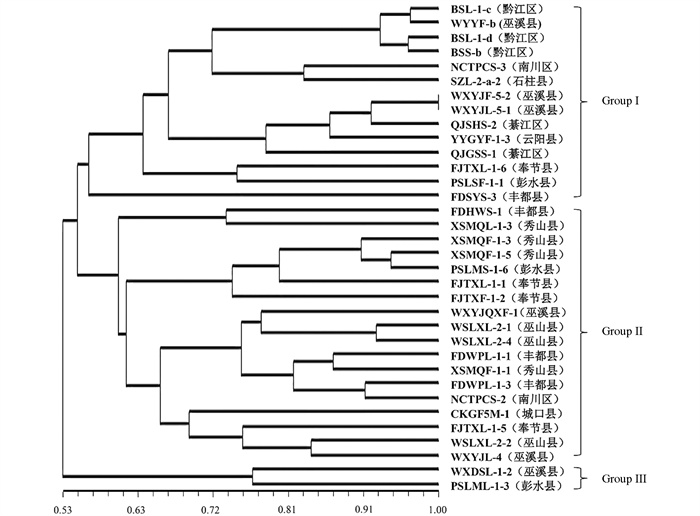
对成团泛菌遗传多样性分析发现菌群遗传相似系数为0.53~1.0,在遗传相似系数0.55时分化为3个亚群(图 6);其中BSL-1-d等14株菌株(黔江区、巫溪县、南川区、綦江区、云阳县、奉节县、丰都县、石柱县)汇聚为亚群Group Ⅰ;FDHWS-1等18株菌株(丰都县、秀山县、彭水县、巫溪县、巫山县、南川区、奉节县、城口县)汇聚为亚群Group Ⅱ;来自巫溪县菌株WXDSL-1-2与彭水县菌株PSLML-1-3单独汇聚为一个分支Group Ⅲ。根据重庆市地形特征将34株成团泛菌划分为3个居群后分析得DSQ居群的Nei's遗传多样性指数(h)为0.278 0,香农指数(I)为0.414 1;YDN居群的Nei's基因多样性指数(h)为0.300 2,香农指数(I)为0.455 0;YDB居群的Nei's基因多样性指数(h)为0.356 5,香农指数(I)为0.526 5(表 5)。成团泛菌3个居群的Nei's基因多样性指数(h)为0.353 9,香农指数(I)为0.525 3(表 6);居群间基因多样性指数(Gst)为0.100 7,基因流(Nm)为4.465 7,3个居群成团泛菌群之间的基因交流水平较高。
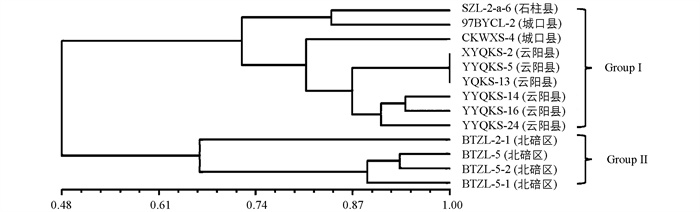
对野油菜黄单胞菌遗传多样性分析得菌群遗传相似系数为0.48~1.0,在遗传相似系数0.48处分化为两个亚群(图 7)。其中Group Ⅰ包括SZL-2-a-6等9株菌株(石柱县、云阳县、城口县);Group Ⅱ包括BTZL-2-1等4株菌株(北碚区)。根据地理区域将13株划分为两个居群后分析得DSQ居群Nei's基因多样性指数为0.168 9,香农指数为0.250 9;YDB居群Nei's基因多样性指数(h)为0.207 2,香农指数(I)为0.311 2;野油菜黄单胞菌遗传多样性指数(h)为0.375 4,香农指数(I)为0.543 7(表 6);居群间基因多样性指数(Gst)为0.519 7,基因流(Nm)为0.462 0,两个居群野油菜黄单胞菌群之间的基因交流水平较低。
2.1. 重庆市核桃细菌性黑斑病症状
2.2. 病原菌单菌落形态观察
2.3. 病原菌16S rDNA分子鉴定
2.4. 柯赫氏法则证病
2.5. 重庆核桃细菌性黑斑病菌种群多态化片段扩增
2.6. 重庆核桃细菌性黑斑病菌遗传多样性分析
-
本研究在对采集自重庆市核桃产区的核桃细菌性黑斑病病害样品进行组织分离后,通过病原菌单菌落形态观察和16S rDNA测序鉴定成团泛菌41株,野油菜黄单胞菌13株。相较于野油菜黄单胞菌,成团泛菌分离率更高,推测原因可能是成团泛菌在自然界分布更广泛。据相关研究,成团泛菌在谷物粉尘和农作物加工设施粉尘中广泛分布,其传播性比野油菜黄胞菌更强[35]。参考王绍雪等[36]的水稻细菌性条斑病接种方法,将菌悬液离体接种到健康核桃叶片,完成了柯赫氏法则证病流程,验证了分离株的致病性,在病原鉴定过程中也发现,除石柱县的病害叶片外,未从同一份病样中同时分离到两种病原物,表明重庆地区这两种病原物在自然状态下不存在明显的复合侵染。
在核桃细菌性黑斑病相关报道中,部分地区鉴定的核桃细菌性黑斑病黄单胞菌属病原物为树生黄单胞菌(X. arboricola)。在分类学上,野油菜黄单胞菌属于黄单胞菌属,目前研究鉴定到侵染核桃的黄单胞菌有树生黄单胞菌胡桃变种(X. arboricola pv. Juglandis)、核桃黄极毛杆菌(X. campestris pv. Juglandis)等,且黄单胞菌X. campestris和X. arboricola两者分类学关系尚不明确,X. arboricola与X. campestris是否为同一病原物暂无明确定论[37]。核桃细菌性黑斑病的黄单胞菌属病原物的界定有待后续进一步研究,本研究分离获得的黄单胞菌鉴定为为野油菜黄单胞菌(X. campestris)。
细菌的传播与风雨因素关联较大[38],采样期间观察到在潮湿阴面的核桃植株核桃细菌性黑斑病发病更重,核桃叶片从3月开始染病,零星出现带黄色晕圈的小黑点,在坐果期发展成为不规则黑斑。核桃细菌性黑斑病在枝干上表现为表皮发黑,严重时扒开树皮有菌脓溢出,皮下组织腐烂,侵染果实时果皮先出现黑斑,由外向内侵染,最终造成果仁腐烂。在重庆7、8月雨量增大,有利于病原菌的传播,核桃种植区细菌性黑斑病为害最严重,这与我国其他地区报道一致[39-41]。本研究暂未对重庆市核桃细菌性黑斑病的流行病学进行探究,后续可对地区降雨量与病害发病情况进行调查,将有助于明确地区降雨对核桃细菌性黑斑病发病的影响。
完成重庆市核桃细菌性黑斑病的鉴定工作后,本研究为探究重庆市病原菌群遗传多样性情况,选取47株分离株作为样本进行遗传多样性分析。基于细菌重复回文序列家族基因多态化片段扩增(rep-PCR)指纹图谱技术,对47个样品多态化片段电泳图谱扩增结果进行统计,大肠杆菌基因间共有重复序列(ERIC)多态性条带比率高于BOX插入因子,表明ERIC序列扩增对核桃细菌性黑斑病病原菌的分型效果优于BOX序列扩增。地理隔离是生物种群遗传分化的主要影响因素[42-43],重庆市野油菜黄单胞菌和成团泛菌聚类分析图谱分析发现,菌株群聚和采样地地理间隔距离呈相关性,但由于农事操作和苗木运输等人为因素的影响,导致出现地理间隔较远地区分离株汇聚在同一个亚群的例外情况。如北碚区的野油菜黄单胞菌分离株与其他区(县)的野油菜黄单胞菌分离株分化为不同的两个亚群;綦江区的成团泛菌分离株和城口县的成团泛菌分离株因地理隔离较远,处在不同分支中,符合地理隔离远、遗传距离越远的规律。但巫溪县成团泛菌分离株和綦江区成团泛菌分离株地理距离较远却处于同一亚群中,属于例外情况。对于地理隔离因素主导种群遗传多样性但存在例外情况的现象,推测可能是人为因素的干扰,核桃苗木运输等农事生产活动会突破地理因素限制,促进菌群之间的基因交流,导致地理相隔较远的地区分离株菌群具有较高的遗传相似度。
根据多态性条带统计结果计算出野油菜黄单胞菌遗传多样性指数(h)和香农指数(I)分别为0.375 4、0.543 7,成团泛菌遗传多样性指数(h)和香农指数(I)分别为0.353 9、0.525 3。遗传多样性参数越高说明菌群的遗传多样性越高,其遗传变异频率较高,这类菌群应对外部逆境的生存能力就越强。对于田间防控来说,遗传多样性丰富的菌群容易在频繁施药的持续选择压力下进化出耐药菌群[44],一旦耐药菌群产生,要么加大药剂使用量,要么更换药剂。若加大药剂使用量,田间耐药菌群会占据生态上位,那么药效会越来越弱,迫使种植户在防治过程中不断加大化学药剂使用量,陷入恶性循环,导致药剂失效。虽然更换药剂可以避免耐药性产生,但目前市面上在售的杀细菌剂种类少且药剂靶标位点单一,可供防治的药剂种类并不多[45],因此在田间防控过程中应建立以化学防治为主,农业防治、生物防治等手段为辅的综合防控体系。







 DownLoad:
DownLoad: