-
烟草作为一种以收获营养器官为主的叶用经济作物,具有不耐连作的特点.但由于目前我国地少人多的现状,烟草连作现象仍旧十分普遍.据调查,我国烟草连作面积占总种植面积的50%左右[1].烟草连作,一方面造成产量减少和品质降低,我国每年因连作所造成的经济损失高达数十亿[2];另一方面,烟草连作为病原物和虫卵的寄生与传播提供了更为便利的条件,导致烟株病虫害加剧,严重制约了烟草产量和质量的提高.病原物和虫卵可在土壤中或烟株残体中存活2~3年,甚至更长时间[3];连作年限越长,烟草花叶病和根结线虫病的发病率越高,二者呈正相关关系[3-4].此外,长期连作还导致土壤有机质、有效养分质量分数和土壤pH值显著降低[5],土壤理化性质恶化[6].
为了研究烟草连作障碍机理,需对存在连作障碍的土壤进行灭菌处理,常用的土壤灭菌手段包括化学灭菌和物理灭菌.由于化学灭菌可能对土壤生物和烟株生长产生抑制作用,高温灭菌常被认为是普遍使用的物理灭菌手段[7-11].一般认为,对存在连作障碍的土壤进行高温灭菌,能显著促进烟株生长和产量的提高,提升叶片养分质量分数和根系活力[12].然而,高温灭菌可能导致土壤养分形态和质量分数的改变,尤其是一些变价微量元素质量分数的大幅度提高,则可能导致烟草植株发生中毒现象[13].此外,高温灭菌对不同类型土壤的影响可能存在较大的差异,对酸性和有机质质量分数高的土壤而言,高温灭菌对pH值和氧化还原电位的影响较大,而对碱性和有机质质量分数低的土壤则影响不大[14].目前,针对高温灭菌对存在连作障碍的不同类型土壤的影响鲜见报道.为此,本研究针对存在连作障碍的红壤(酸性土壤)和水稻土(碱性土壤),研究高温灭菌对幼苗期烟株生长、土壤pH值和Eh值、二价锰质量分数的影响.
HTML
-
供试烟草品种为绿色包衣种子MS K326(玉溪中烟种子有限责任公司).供试土壤为红壤和水稻土,采自云南省玉溪市烟草主产区.其中,红壤采自里山乡芭蕉村(24°01′N,102°45′E,海拔1 840 m),已连作烟草5年,病害较轻,前茬植物为油菜;水稻土采自四街乡六街村(24°11′N,102°45′E,海拔1 837 m),已连作烟草10年,病害较重,前茬植物为蔬菜.供试土壤基础理化性状如表 1所示.红壤表层土壤粘粒质量分数低于水稻土,而砂粒质量分数高于水稻土,粉粒质量分数二者相当;此外,红壤pH值显著低于水稻土,且有机质质量分数也低于水稻土(表 1).供试风干土过2 mm筛,其中一部分用于高温灭菌,调节压力蒸汽灭菌锅(YXQ-LS-18SI,上海博迅实业有限公司)温度为121 ℃,压力105 kPa,灭菌2 h.灭菌结束后,将土壤铺在干净的牛皮纸上风干,待用.
-
本项研究包括2批盆栽试验,均采用二因素随机区组设计.主因素为土壤类型,分别为红壤和水稻土;副因素为灭菌方式,分别为不灭菌和高温灭菌.试验一,每个处理重复12次;试验二,每个处理重复6次.
试验一,于2014年12月22日至2015年3月5日年,在中国农业大学室内智能型光照培养箱(GXZ智能型,宁波江南仪器厂)中进行.其中,2014年12月22日-2015年1月11日为育苗期,于1月12日移栽,3月5日采样收获.移栽时,选取大小一致,三叶一心的烟草幼苗移栽到下述盆钵,进行培养.每个盆钵移栽3株幼苗,成活后间苗,每盆保留1株烟苗.供试盆钵上口径内径7 cm,下口径内径5 cm,高8 cm,体积为300 cm3,每盆装风干土250 g.控制培养箱内温度25 ℃,光照12 h,应用称质量法控制土壤含水量维持在田持的70%~80%.
试验二,为了进一步验证试验一所获得的结果,于2015年4月17日至2015年7月5日,在中国农业大学光温控制玻璃温室中进行了第二次盆栽试验.其中,2015年4月17日-5月20日,为育苗期;于5月22日移栽,7月5日采样收获.每个盆钵移栽3株幼苗,成活后间苗,每盆保留1株烟苗.试验期间日平均温度为25±0.5 ℃,日均最高温度27 ℃,最低温度20 ℃.供试盆钵上口径内径12 cm,下口径内径10 cm,高11 cm,体积为1 000 cm3,每盆装风干土1 000 g.采用称质量法控制浇水量,一般每隔1 d浇水1次,维持土壤含水量介于田持的70%~80%,灌溉用水为无离子水.应用温度自动记录芯片(EBI-20T,Ebro Instruments,Germany),记录温室内每2 h气温.为了降低光照的空间变异对植株生长的影响,每7 d置换一次盆钵摆放位置.
育苗盘钵上口径内径7.0 cm,下口径内径4.8 cm,高6.5 cm.育苗基质为营养土与蛭石按1:1比例混匀,在每个盆钵中均匀地撒入烟草种子,覆盖保鲜膜,并在膜上扎小孔,保证适量的氧气供应.将育苗盆钵放入上述智能型光温培养箱,生长20~30 d左右移栽.
-
移栽后30 d和收获时,选取烟苗中部同一叶位的两片烟叶,测定叶片左右两侧中部、叶基和叶尖1/3处3个点的SPAD值(SPAD502,Konica Minolta Sensing Inc,Japan),计算每株6个测定值的平均值,作为整株烟苗的SPAD值.收获时,测量株高,查数自茎基处至第一花枝处顶叶的总叶片数.用剪刀将地上部植株茎叶分开,在距离叶柄1/3处剪掉烟叶,将每株叶片按照从大到小顺序平铺于A4大小的透明胶片上,叶片间不重叠,放在扫描仪(Scan maker 3870,美国)上,调节缩放比例为100%,用image图像处理软件分别计算单叶面积.用游标卡尺测定距离茎基部2 cm处的直径为茎粗.将叶片和茎秆装入信封中,称鲜质量后,放入烘箱,105 ℃杀青30 min,75 ℃下烘干至恒质量,测定干质量.
地上部烟株收获后,剔除土壤中的烟株根系,将土壤充分混匀后,用于下述测定工作.采用中性醋酸铵对苯二酚混合溶液法,测定土壤二价锰质量分数[15].称取上述新鲜土样10 g,放入250 mL三角瓶中,加入1 mol/L醋酸铵和100 mL 2 g/L对苯二酚溶液,盖好瓶盖,摇匀,放置于往返震荡机上震荡0.5 h,放置6 h,过滤.用电感耦合等离子质谱仪ICP-AES(Optima 7300DV,Perkin Elmer,美国)测定滤液二价锰和其他大量元素、中量和微量元素质量分数.另称取一份新鲜土样,按1:2.5土水比浸提1 h,用pH计(pHTestr 10 BNC,美国)测定浸提液pH值.用Eh计(ORPTestr10,美国)测定浸提液Eh值.采用吸管法[16]测定土壤质地.
-
用Excel 2010进行数据处理和作图分析,用SAS 9.2的GLM过程模型,进行两因素完全随机方差分析.两因素方差分析统计模型包括土壤类型(S)和灭菌方式(St),以及土壤类型×灭菌方式的交互作用.用最小二乘法(LSD)在0.05水平下,进行差异显著性检验.
1.1. 试验材料
1.2. 试验设计和方法
1.3. 测定项目和方法
1.4. 数据统计分析
-
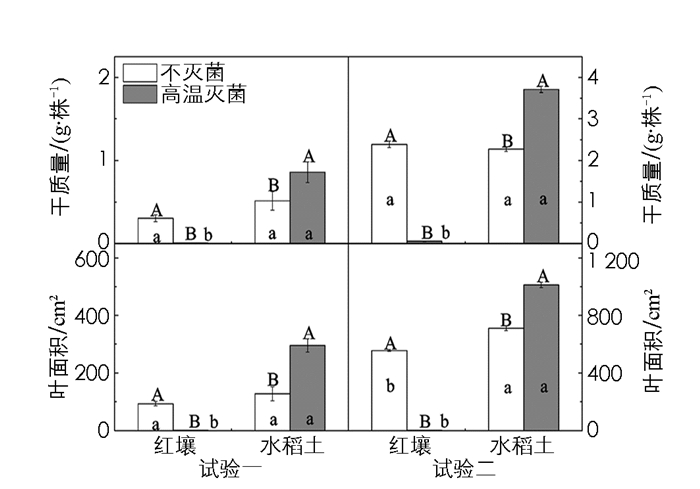
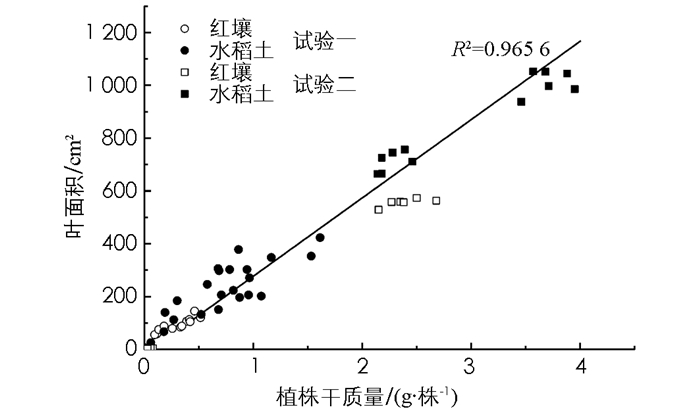
两因素方差分析结果表明,二批试验中土壤类型和灭菌方式,均显著影响了烟草植株鲜干质量和地上部主要农艺性状;并且,二者之间存在显著的交互作用(表 2).与不灭菌处理相比,红壤高温灭菌显著降低了烟株干质量和叶面积,烟株几乎没有生长(图 1);然而,水稻土高温灭菌后,烟株干质量和叶面积则分别显著提高了65%和132%.试验一与试验二的结果相比,尽管生长环境条件不同,除绝对数值存在差异外,灭菌对红壤和水稻土烟株干质量和叶面积的影响,趋势完全一致(图 1).烟株干质量与叶面积间的线性正相关关系具有统计学意义(图 2),并可从图中数据点的分布,看出灭菌对红壤和水稻土烟草生长影响的差异.
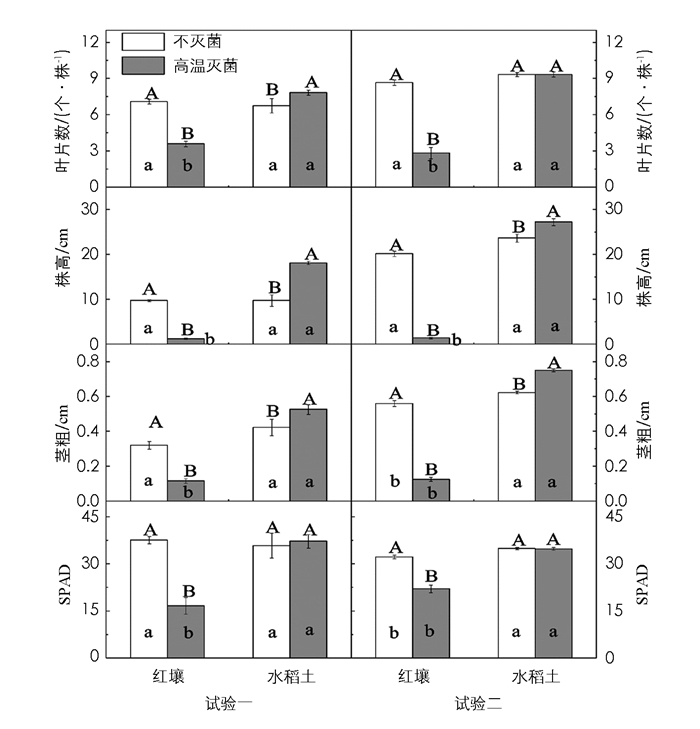
与不灭菌处理相比,红壤高温灭菌显著降低了烟株叶片数、株高、茎粗和叶片SPAD值(图 3);然而,水稻土高温灭菌后,叶片数、株高和茎粗显著增加,叶片SPAD值差异无统计学意义.二组试验间,除水稻土叶片数存在较小差异外,趋势一致(图 3).不灭菌条件下,除试验二中茎粗和叶片SPAD值存在差异外,红壤和水稻土间,烟株叶片数、株高、茎粗和叶片SPAD值差异无统计学意义;然而,高温灭菌后,水稻土烟株上述参数均显著高于红壤(图 3).
-
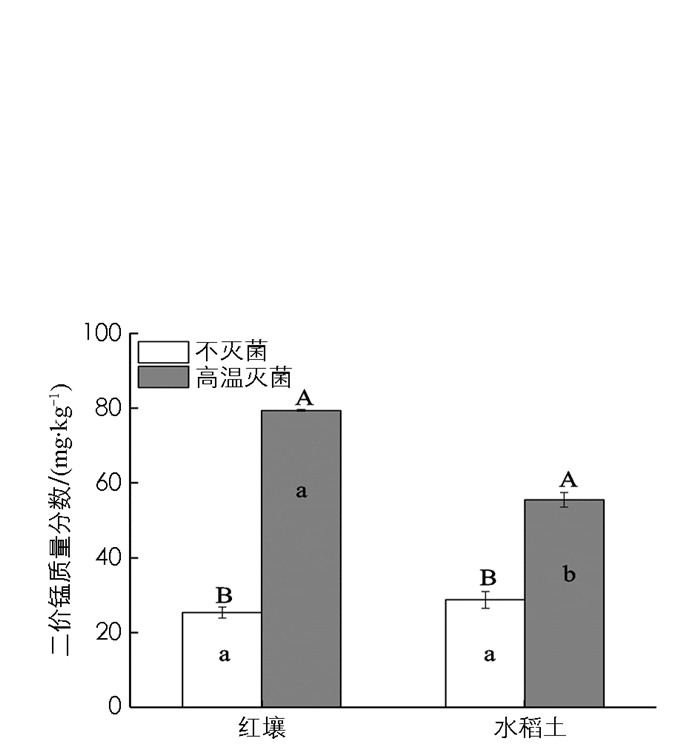
不灭菌条件下,红壤与水稻土间土壤二价锰质量分数差异无统计学意义(图 4).与不灭菌处理相比,高温灭菌均显著提高了两种土壤二价锰质量分数.其中,水稻土提高了96%,达56 mg Mn/kg;而红壤则显著提高了216%,高达79 mg Mn/kg,超过了烟株Mn毒临界值(图 4).
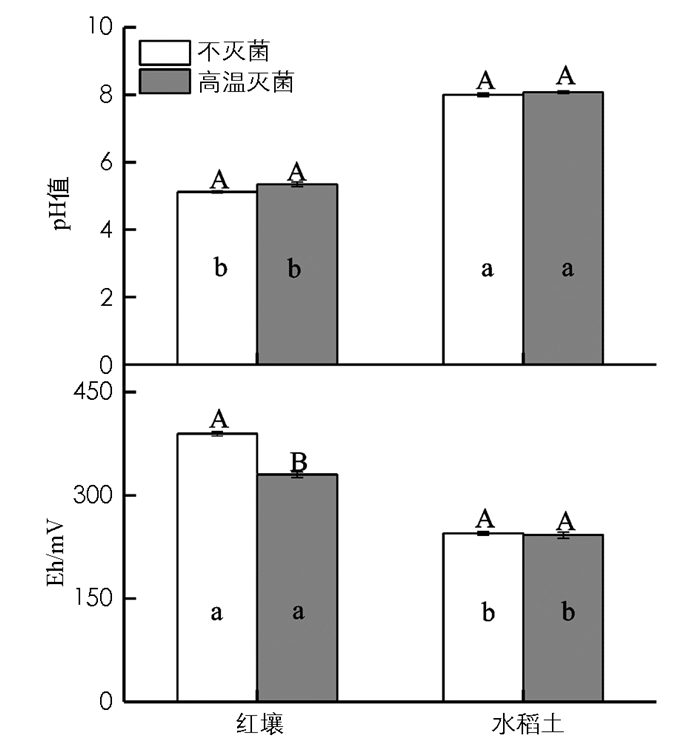
与不灭菌处理相比,高温灭菌提高了红壤土pH值0.1个单位,显著降低了土壤Eh值;然而,高温灭菌对水稻土pH值和Eh值影响均无统计学意义(图 5).与是否灭菌无关,水稻土pH值显著高于红壤(表 1),而Eh值则显著低于红壤土(图 5).
2.1. 烟草幼苗地上部农艺性状
2.2. 土壤二价锰质量分数、pH值和Eh值
-
烟草连作可引起烟株株高降低、叶面积减小、叶绿素质量分数降低、光合作用减弱、农艺性状变差等问题,严重影响烤烟产量和品质的提高[17].此外,长期连作还会导致土壤养分失调、烟草土传病虫害加重等问题.因此,寻找能够有效缓解或消除连作障碍问题的技术途径,是科技工作者一直以来关注的焦点问题.高温灭菌是研究烟草连作障碍机理时常用的土壤灭菌手段.然而,以往的研究报道并未关注到高温灭菌可能造成某些变价微量元素质量分数的改变,进而导致烟草植株发生中毒的现象.我们的试验结果表明,水稻土高温灭菌,显著提高了烟株干质量、叶片数、叶面积、株高等农艺性状(表 2,图 1-图 3).这与以往的研究结果一致,对存在连作障碍的土壤进行高温灭菌,能显著改善烤烟的农艺性状和根系生长[1].然而,与水稻土高温灭菌后的结果截然相反,红壤高温灭菌却显著抑制了烟株的生长(表 2,图 1-图 3).
锰是植物必需的微量元素之一,二价锰是植物可以吸收利用的形态[18].一般情况下,土壤有效态锰质量分数大于60 mg/kg,易引起烟草植株锰质量分数中毒[19].锰毒将造成叶片输导组织坏死,叶绿体合成受阻和叶片叶绿素质量分数降低,光合作用和蛋白质合成受阻[20-22].不灭菌条件下,红壤和水稻土二价锰质量分数分别为25和29 mg/kg(图 4),远低于锰毒临界值[19].高温灭菌后,酸性红壤二价锰质量分数显著提高到79 mg/kg,超过了植株锰质量分数中毒临界值60 mg/kg[19].红壤高温灭菌所导致的烟株锰毒,成为比连作障碍更为严重的限制因子,将造成烟草植株叶片光合作用受阻,烟草长势不良,农艺性状变差(图 1,3).然而,高温灭菌后,碱性水稻土二价锰质量分数未超过锰毒临界值[19],但消除了连作障碍,改善了水稻土烟株幼苗的生长状况,显著提高了烟株鲜干质量、叶面积、叶片数和SPAD值等[12](图 1,3).
高温灭菌过程中土壤有机物分解,可能导致土壤pH值和氧化还原电位变化,进而影响土壤中某些元素的形态和质量分数.土壤二价锰质量分数的高低,主要受土壤pH值与Eh值的影响.本项研究结果表明,与不灭菌处理相比,高温灭菌后,酸性红壤土氧化还原电位显著降低;然而,碱性水稻土未发生变化(图 5).一般而言,土壤Mn2+的质量分数随土壤氧化还原电位的降低而升高,当土壤Eh值<500 mV时,Mn4+会被还原成Mn2+,增加土壤中锰的活性[23].尽管本项研究未发现高温灭菌对土壤pH值的影响,但土壤pH值范围在6~6.5时,是锰氧化还原的临界值.当pH值<6时,有利Mn4+的还原;pH值>6.5时,则有利Mn2+的氧化,即土壤锰的有效性与pH值呈负相关关系[24-25].此外,高温灭菌是否会导致某些还原性有机化合物数量增加,从而降低土壤氧化还原电位,甚或对烟株生长产生直接的抑制作用,有待进一步研究.
-
与不灭菌处理相比,高温灭菌显著抑制了酸性红壤土烟株生长.然而,显著改善了碱性水稻土烟株生长.高温灭菌导致酸性红壤氧化还原电位显著降低,二价锰质量分数显著提高,超过锰毒临界值,是造成上述相反现象的主要原因.因此,在进行土壤生物学障碍机理研究时,应该考虑高温灭菌可能引起的某些土壤性状的改变,可能会诱发次生限制因子的出现,抑制植物生长,从而影响对试验结果的客观评价.






 DownLoad:
DownLoad: