-
甲藻是海洋和淡水中能够形成赤潮和水华的一类浮游藻类[1]. 随着水体富营养化程度的加剧,甲藻水华或赤潮频繁发生,已经成为一个世界性的环境问题[2]. 甲藻水华或赤潮的暴发会造成水质恶化,使水生生物大量死亡[3],严重影响工农业生产及人类生活用水的供水质量,直接威胁到流域生态环境安全及社会经济的可持续发展[4]. 同时,一些甲藻还能产生毒素,如利玛原甲藻产生DSP毒素,网状原角藻产生虾夷扇贝毒素和蛎甲藻产生海葵毒素等. 毒素可在贝类等海洋生物体内积累,威胁食用者的生命健康[5-7]. 近年来,我国重要水体多次暴发甲藻水华[8-10]. 如三峡大坝建成后,随着水库周期性蓄水与泄水,水文情势发生改变,支流回水区成为湖泊型水体,水流速度减缓,水体自净能力减弱. 据不完全统计,三峡库区至少有15条支流回水区发生过甲藻水华[11-12],且水华发生区域逐渐由坝址附近向距离大坝更远的上游支流扩展. 目前,对甲藻赤潮的研究已取得较多成果[13],但对淡水甲藻水华的研究报道还较少.
营养盐浓度是影响浮游植物生长、生物量以及种群结构的重要因素[14-15]. 其中,氮是其生长必需和需求量最大的营养元素,影响微藻的光合作用和藻细胞的生长繁殖[16]. 藻细胞受到氮限制时,光合作用过程中的光能捕获、能量转移和碳素固定均会受到限制[17]. 此外,不同形态的氮源也会影响浮游植物的营养盐吸收、代谢和细胞生长. 因此,不同藻种对氮源形态的需求[18]以及对不同形态氮的吸收利用率可能在藻类水华形成与维持中起着重要的作用[19].
光合作用是藻类对环境最敏感的生理过程之一,在其他特征出现之前,光合作用的变化就可能发生[20]. 光合系统包括PSⅠ和PSⅡ,其中PSⅡ被认为是响应环境变化的原初部位[21-22]. 叶绿素荧光参数能够有效反应PSⅡ系统的能量利用情况,以表征藻细胞的光合活性[23]. 目前,不同氮源对淡水多甲藻PSⅡ影响的研究尚未见报道. 本研究以淡水多甲藻为材料,研究不同氮源对其生长和叶绿素荧光参数的影响,比较其对不同氮源的利用差异,研究结果有助于了解不同氮源对甲藻生长的作用以及对浮游植物群落演替的潜在影响,为甲藻水华的预测和防治工作提供理论依据.
HTML
-
实验所用多甲藻(Peridinium umbonatum FACHB-329)由中国科学院武汉水生所淡水藻种库提供,藻种置于119培养基(pH值为7.5)中培养. 培养条件为光强30 μmol/(m2·s),温度(25±1) ℃,光暗比12 h∶12 h. 至对数期后,于4 000 r/min离心5 min,弃上清液,用无氮的119培养基清洗,去除表面吸附的氮. 重复洗涤、离心3次后,转入无氮119培养基中,进行氮饥饿培养3 d后作为实验用藻.
配制3种不同氮源的119培养基,氮源分别为氯化铵、硝酸钠和尿素. 培养基中氮的终浓度为2 mg/L. 将氮饥饿后的多甲藻等体积接入各培养基中,在上述条件下培养,每个处理设置3个重复.
-
每隔2 d取1 mL藻样,加入100 μL的鲁戈氏液,沉淀浓缩24 h后,从中取出0.1 mL滴在浮游植物计数板上,在光学显微镜下进行细胞计数. 比生长率(μ)计算公式为
式中,N1和N2分别为藻细胞在t1和t2时的细胞密度.
-
取2.5 mL藻液,经30 min的暗适应后,用植物效率分析仪(Handy PEA/LPA2,Hansatech)测定OJIP曲线,测定光强为3 000 μmol/(m2·s),测定结果能够准确记录10 μs到2 s的叶绿素荧光变化. 通过OJIP曲线的变化及计算,分别获得了每个生长时期(第3,21,27 d)的JIP参数,选取的参数及其含义见表 1.
-
实验数据通过SPSS 23.0进行处理与分析,采用单因素方差分析(One-way ANOVA)并用LSD进行多重比较,p<0.05为差异有统计学意义,用Origin 9.1绘制文中所有图形.
1.1. 藻种培养
1.2. 藻细胞密度与比生长率的测定
1.3. 叶绿素荧光动力学曲线(OJIP)的测定及有关参数的获得
1.4. 数据分析
-
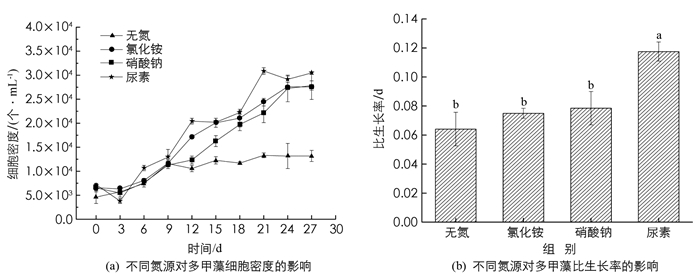
图 1a显示,培养12 d后,无氮处理组与有氮处理组的藻细胞密度差异有统计学意义(p<0.05),无氮处理组的细胞密度趋于稳定(1.06×104个/mL),有氮处理组随着培养时间的延长而增加. 培养21 d后,尿素处理组的藻细胞密度显著高于其他处理组(p<0.05),硝酸钠和氯化铵处理组之间差异无统计学意义(p>0.05).
在不同氮源培养下,多甲藻对数期的比生长率呈现出不同的变化(图 1b). 无氮处理组的比生长率为0.064 d-1,氯化铵、硝酸钠处理组的比生长率(分别为0.075 d-1,0.079 d-1)与无氮处理组比较差异无统计学意义,尿素处理组(0.118 d-1)显著高于其他处理组(p<0.05).
无氮条件下,多甲藻最早进入平台期,且平台期生物量最小. 这是由于在氮胁迫时,一些酶和蛋白质的合成减少,对多甲藻生长造成了一定的限制[24]. 但藻细胞能够利用内源氮进行必需的生理、生化代谢,如光合作用等,进行碳水化合物与能量的代谢及物质再分配[25-27],因此,无氮处理组仍能存活并保持较低的生长. 相较于无氮处理,3种氮源均可以有效促进多甲藻的生长,其中,对数期以尿素为氮源的多甲藻细胞密度最大,比生长率最高,表明在单一氮源存在的情况下,尿素更有利于多甲藻的生长.
-
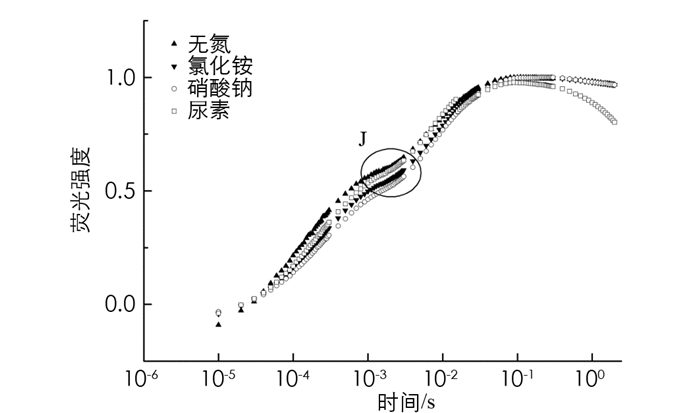
在不同氮源条件下,多甲藻的OJIP曲线变化如图 2,其中多甲藻的相对可变荧光在硝酸钠、氯化铵以及尿素作为氮源时差异无统计学意义(p>0.05). 无氮处理组J点相对可变荧光值(Vj)显著高于3种氮源处理组(p<0.05). 曲线J点处的荧光强度升高,通常反映了电子从QA向QB的传递受到抑制,PSⅡ反应中心受体侧
$ {{\rm{Q}}_{{\rm{\bar A}}}}$ 瞬时大量积累[28]. 相较于无氮处理组,3种氮源条件下,J点的荧光强度均下降,说明含氮处理显著加快了电子在PSⅡ受体侧的传递,从而加快了QA被还原的速率. -
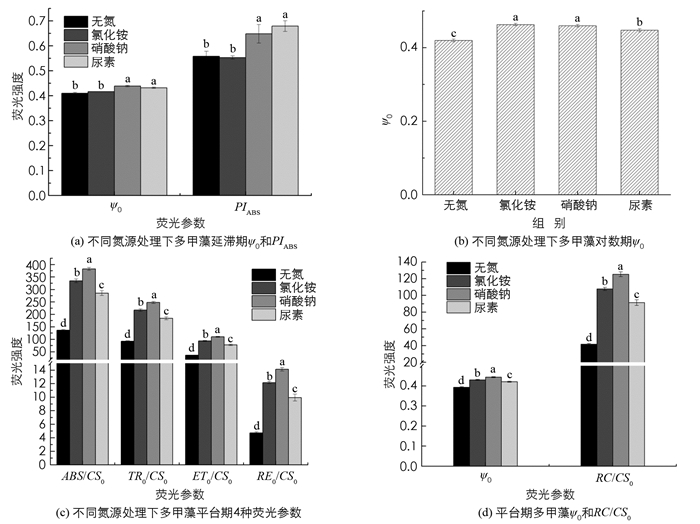
不同氮源对多甲藻延滞期性能指数(PIABS)和概率(Ψ0)的影响如图 3a. 以尿素和硝酸钠为氮源的处理组PIABS显著高于以氯化铵为氮源的处理组(p<0.05),无氮与氯化铵、硝酸钠与尿素之间差异无统计学意义;Ψ0的情况与之相似. PIABS可以更准确地反映光合系统的状态,Ψ0反映了光照2 ms时有活性的反应中心的开放程度[29]. 说明在延滞期时,无氮和氯化铵处理会使光合系统受到一定损害,降低了反应中心的开放程度.
对数期时,不同氮源对多甲藻Ψ0的影响如图 3b. 以氯化铵、硝酸钠、尿素为氮源的多甲藻Ψ0均显著高于无氮处理组(p<0.05),分别提高了10.27%,9.57%和7.51%. 其中硝酸钠和氯化铵处理组显著高于尿素处理组(p<0.05). 以上结果表明,对数期氮源的存在增大了有活性的反应中心的开放程度,其中硝酸钠和氯化铵处理组Ψ0较高,说明其捕获的光能把电子传递到电子传递链中超过
$ {{\rm{Q}}_{{\rm{\bar A}}}}$ 的电子受体的概率更大.不同氮源处理下的多甲藻平台期单位反应面积能量流动情况以及Ψ0和RC/CS0分别如图 3c,3d. 各荧光参数间表现出相同的趋势,其值由大到小均为硝酸钠处理组、氯化铵处理组、尿素处理组、无氮处理组. 且各处理组间差异有统计学意义(p<0.05). 与无氮处理组相比,硝酸钠、氯化铵、尿素处理的ABS/CS0分别增加了180.13%,145.11%和109.07%;TR0/CS0分别增加了168.54%,135.19%和99.52%;ET0/CS0分别增加了202.37%,156.77%和113.29%;RE0/CS0分别增加了199.36%,157.42%和110.38%;而Ψ0和RC/CS0分别增加了12.82%,10.26%,7.69%和200.67%,158.47%,119.24%. 在无氮处理条件下,平台期RC/CS0显著低于含氮处理组,表明氮胁迫使得部分反应中心失活或者裂解,暗示多甲藻PSⅡ受体侧受到了抑制,同时,平台期无氮处理组中的ABS/CS0,TR0/CS0,ET0/CS0和RE0/CS0减少,而在3种含氮处理中,以硝酸钠为氮源的处理组,各荧光参数均为最高,说明无氮处理单位面积传递以及捕获的能量相对减少,电子传递产额降低,传递到电子链末端的能量也降低,导致光能转化效率降低,最终限制了光合作用的正常进行[29],而硝酸钠可以更大程度地增加光能利用率,提高光合效率.
2.1. 不同氮源对多甲藻细胞密度以及比生长率的影响
2.2. 叶绿素荧光诱导动力学曲线(OJIP)
2.3. 叶绿素荧光动力学参数
-
研究表明,甲藻更倾向于吸收还原态氮,能够适应于高尿素的水体环境[30]. Solomon等[31]发现,甲藻比较喜欢吸收利用有机氮中的尿素. 李京[32]也发现米氏凯伦藻对尿素有着较高的吸收速率,更喜欢以尿素为氮源. 本研究得出了与之一致的结论. 然而也有一些研究表明,部分微藻在硝酸钠和氯化铵为单一氮源条件下的生长要优于尿素[33],这说明不同浮游藻类对各种形态氮源的吸收利用存在差异.
叶绿素荧光技术是一种以光合作用理论为基础,利用生物体内叶绿素荧光研究和探测光合生理状况以及外界环境对其细微影响的活体测定技术[20]. 因此,不同环境条件对光合作用中光能的吸收、传递、耗散和分配等反应产生的影响都可通过叶绿素荧光诱导动力学参数的变化反映出来[34]. 叶绿素荧光诱导动力学曲线包括OJIP等,相对可变荧光值(Vj)的变化是电子受体连续还原、PSⅡ反应中心逐渐关闭的过程[17]. 本研究结果发现,无氮(氮胁迫)状态下,多甲藻具有较高的Vj,表明了氮胁迫下甲藻电子从QA向QB的传递受到抑制,PSⅡ反应中心受体侧
$ {{\rm{Q}}_{{\rm{\bar A}}}}$ 瞬时大量积累[35]. 本研究中3种含氮条件下,对比无氮处理组而言,J点的荧光强度均下降,说明含氮处理显著加快了电子在PSⅡ受体侧的传递,从而加快了QA被还原的速率. 根据J点的下降程度,表明硝酸钠为氮源时,QA被还原的速率最大.通常认为,藻类更偏好于吸收氨态氮,这是由于氨态氮可以直接用于合成氨基酸等生命必需物质[16]. 但高浓度的氨态氮会对藻细胞产生一定的毒性,造成光合速率下降,从而抑制浮游植物的生长[35]. 本研究中,在延滞期时,无氮和氯化铵处理PIABS和Ψ0差异无统计学意义. 杨宋琪等[17]在对杜氏盐藻的研究中也得出了相应的结论,这表明了无氮和氯化铵处理会降低延滞期多甲藻反应中心的开放程度. 正常条件下,有活性的PSⅡ反应中心将捕获的光能转化为激发能,并将其中的一部分转化为化学能,推动碳同化反应,其余部分以热和荧光的形式耗散掉. 这三者之间是互相竞争的关系,任何一者的改变都会导致其他二者发生变化[29]. 同时,在无氮处理条件下,平台期各荧光参数值均显著低于含氮处理组,表明氮胁迫使得部分反应中心失活或者裂解,单位面积传递以及捕获的能量相对减少,电子传递产额降低,传递到电子链末端的能量也降低,导致光能转化效率降低,最终限制了光合作用的正常进行. 范丽敏[36]发现硝酸钠处理组的棕鞭藻光能转化效率高于氯化铵和尿素处理组. 梁英等[37]研究也表明,硝酸钠环境使筒柱藻荧光参数更高. 本研究也支持了他们的结论,即在3种含氮处理中,以硝酸钠为氮源的处理组,各荧光参数均为最高,表明硝酸钠可以更大程度地增加光能利用率,提高光合效率. 因此,硝酸盐可能仍是多甲藻优先选择的氮源之一.
-
氮胁迫会抑制多甲藻的生长,并导致其PSⅡ反应中心数量减少,开放程度降低,电子传递链受阻. 多甲藻能够利用硝酸钠、氯化铵和尿素分别作为单一氮源来维系生长,在初始浓度为2 mg/L的条件下,尿素更适合多甲藻的生长,然而,在不同时期,多甲藻荧光参数呈现出不同的变化. 综合各指标总体而言,3种氮源中,硝酸钠更有利于多甲藻的光合作用. 因此,多甲藻对不同形态氮的吸收和利用策略可能促使了其在复杂的水体环境中形成的竞争优势和水华现象.






 DownLoad:
DownLoad: