-
化学数字化实验是利用传感器、数据采集器、计算机及相应软件对实验中各种物理化学量(如pH值、温度、压强、电导率和吸光度等)数据进行实时采集和分析,是信息技术与学科整合的典型代表,在我国中学及高等院校化学教学中占有极其重要的地位. 化学概念是从微观层面界定的,因其涉及的抽象内涵不易被直接感知,学生对概念的认识也仅停留在机械记忆上. 手持技术数字化实验可以使化学反应过程实证化、动态化、定量化、可视化,可作为认知工具帮助学生科学感知和建构抽象的化学概念,为探索化学教学疑难问题提供了一条新途径. 2018年,王立新等[1]首次提出了基于手持技术的TQVC概念认知模型,从认知理论层面分析了手持技术对学生概念建构的促进作用,并据此开发了一系列教学实例[2-5],这为教育工作者科学有效地开展基于手持技术的信息化概念教学提供了理论基础.
此外,开展化学数字化实验教学,对学生的探究兴趣、思维技能及数据图象分析能力的培养均会产生积极影响,这与新课标对学生“宏观辨识与微观探析”“证据推理与模型认知”和“科学探究与创新意识”等学科核心素养培养的要求是相契合的. 手持技术的图像分析功能与近年来高考真题中频出的曲线类实验题相对接,手持技术实验能提升学生的曲线解读及指导能力. 在高等师范院校的化学教学法实验中开设手持技术相关课程也极大地提升了师范生数字化实验技能及信息化教学研究的能力[6-8],促进了本科师范人才专业化发展. 因此,本研究选择2019年人教版选择性必修一中“盐类的水解影响因素”这一内容,开发基于手持技术的数字化实验,为盐类水解相关概念的教学提供案例.
HTML
-
盐类水解平衡移动是对化学反应平衡移动理论、电离平衡理论及盐类水解知识的综合应用,是高中化学反应原理部分的重要内容,综合性较强,理论抽象难懂,仅依靠应用勒夏特列原理进行迁移推理的教学方式对学生的逻辑思维能力要求极高. 2019年人教版高中教材将“影响盐类水解的主要因素”实验列为高中阶段学生的必做实验. 但在实际实验过程中,平衡移动所引起的微弱变化很难被捕捉到,利用FeCl3水解后溶液颜色的变化、pH试纸或指示剂颜色的变化来验证FeCl3水解平衡移动方向都欠缺合理性[9].
目前,基于手持技术探究水解平衡移动影响因素的实验主要集中在利用pH传感器和色度计监测FeCl3水解移动引起的pH值及吸光度变化[10-11]. 但仅由pH值的变化无法解释“稀释有利于水解”的论断,而FeCl3水解后吸光度的变化是由水解和配位反应共同作用引起的[12],因此,通过监测pH值及吸光度的变化来判断FeCl3水解移动方向欠妥. 根据FeCl3水解反应原理,产物Fe(OH)3呈胶体或沉淀,溶液中导电微粒数发生改变,继而会引起电导率的变化[13],因此联用电导率和pH传感器监测FeCl3水解继而形成胶体的过程,可以从直观的动态变化中感知FeCl3水解移动过程,继而从微观层面理解水解平衡移动的主要因素,有利于学生变化平衡观、宏微观和定量观的构建.
-
FeCl3溶液易水解,改变平衡表达式
$\mathrm{Fe}^{3+}+3 \mathrm{H}_2 \mathrm{O} \rightleftharpoons \mathrm{Fe}(\mathrm{OH})_3+3 \mathrm{H}^{+} $ 中不同物质的浓度,促进Fe3+的水解,进行胶体制备实验. 该水解平衡的平衡常数$K=\frac{c^3\left(\mathrm{H}^{+}\right)}{c\left(\mathrm{Fe}^{3+}\right)}=\frac{K_w^3}{K_{\mathrm{sp}}\left[\mathrm{Fe}(\mathrm{OH})_3\right]}=\frac{10^{-42}}{4.0 \times 10^{-38}}=2.5 \times 10^{-5} $ .可溶性Fe3+盐的水溶液有很多种存在形式. 当溶液酸性较强时,Fe3+主要以[Fe(H2O)6]3+离子存在,在高自旋状态下,光吸收弱,呈现淡紫色. 平常人们所熟悉的黄棕色或红棕色液体是铁盐溶于水后发生水解作用引起的. pH值在2~3时,水解的趋势最明显,溶液颜色为黄棕色,聚合倾向增大,形成聚合度大于2的多聚体,结构与Al2Cl6类似,可表示为:
当pH值继续升高,溶液由黄棕色逐渐变为红棕色,析出红棕色胶状Fe(OH)3. 要探究Fe(OH)3胶体的形成,则需要把pH值的范围控制在2~3之间.
-
体系内存在的各种微粒之间相互作用,会影响体系的导电能力,电导率也就有了差异. 影响体系电导率的因素有:可移动离子的浓度、离子所带电荷数、温度等. 强电解质溶液的电导率随溶液浓度的增加而增加,如在一定浓度范围内,NaCl溶液电导率随浓度的变化呈线性关系. Fe3+易水解,其溶胶胶团的结构可表示为:
$\left\{\left[\mathrm{Fe}(\mathrm{OH})_3\right] m \cdot n \mathrm{FeO}^{+} \cdot(n-x) \mathrm{Cl}^{-}\right\}^{\mathrm{x}+} \cdot x \mathrm{Cl}^{-} $ . 水解形成的胶体微粒表面积大,容易吸附凝聚其他带电微粒,从而使体系导电率发生改变. -
经查阅文献[14]及进行预实验发现,FeCl3浓度越高,溶液颜色越深,一加热极易出现大量沉淀,干扰数据采集,对电极损伤较大;FeCl3浓度过低,胶体不易出现,实验效果不明显. 因此,本实验选择0.02 mol/L的FeCl3溶液进行研究. 为避免因滴定试剂浓度过小导致消耗量过大以及滴定时间过长,引起体系中Fe3+浓度改变,继而影响电导率,本实验将所有滴定试剂的浓度定为0.1 mol/L.
因此,本研究借助手持技术的电导率传感器、pH传感器和温度传感器,定量地探究温度、反应物浓度、外加碱性氧化物和盐对FeCl3水解平衡移动的影响,摸索制备Fe(OH)3胶体的适宜条件.
-
仪器:计算机SPARKvue软件,PASCO蓝牙数据采集器,PASCO温度传感器,PASCO电导率传感器(10× Conductivity),PASCO pH传感器,红色激光笔,磁力搅拌器,磁子,微型滴定管,电子天平,烧杯(100 mL、150 mL若干),漏斗,铁架台,滤纸,玻璃棒,胶头滴管.
试剂:FeCl3·6H2O固体(M=270.30 g/mol,20 ℃水条件下的溶解度为0.92 g/mL),0.1mol/L NaOH,0.1 mol/L NaHCO3,0.1 mol/L Na2CO3,0.1 mol/L HCl,CaCO3粉末(AR),CuO粉末(AR),CaO粉末(AR).
-
FeCl3水解后,溶液pH值显酸性. PASCO pH传感器采用二点校准,选择25 ℃下pH=4.00邻苯二甲酸氢钾和25 ℃下pH=6.86的磷酸缓冲溶液. 在计算机SPARKvue软件“校准传感器:输入数值”一栏分别读出两个校准点的传感器数值,再填入标准值.
-
采用一点校准. 校准前将电导探头浸泡在蒸馏水中5~10 min,用1 000 mg NaCl配置成1 L溶液,导电率在25 ℃下为1 990 μS/cm,选择“1~10 k”档进行读数校准.
-
按图 1所示将电脑与手持技术传感器(根据探究因素选择相应传感器:pH传感器、温度传感器或电导率传感器)、蓝牙数据采集器连接,打开电脑上与PASCO手持仪器配套的SPARKvue软件,点击连接相应测量参数,参数设置完毕即可开始实验,采集数据.
2.1. 实验设计思路
2.1.1. FeCl3的水解平衡原理
2.1.2. 水解对体系电导率的影响
2.1.3. 实验试剂浓度的选择
2.2. 实验仪器与试剂
2.3. 仪器校准及操作方法
2.3.1. 仪器的校准
2.3.1.1. PASCO pH传感器的校准
2.3.1.2. PASCO电导率传感器的校准
2.3.2. 仪器的操作方法
-
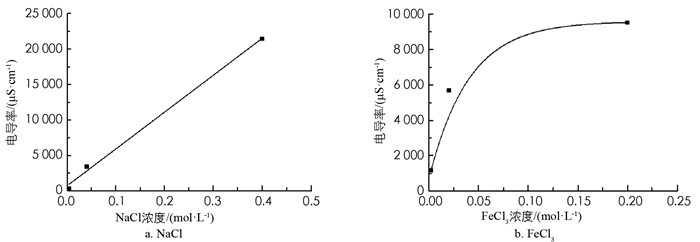
用蒸馏水分别配置0.4 mol/L NaCl溶液和0.2 mol/L FeCl3溶液,分别稀释10倍和100倍,测定不同浓度下其电导率和pH值,结果见表 1.
从表 1中pH值一栏可知,由于体系中存在水解平衡,FeCl3溶液呈酸性,稀释10倍后pH值上升也不足一个单位. 如图 2所示,稀释会降低溶液的电导率,在低浓度下,NaCl溶液的电导率随浓度呈线性变化(图 2a),而FeCl3溶液的电导率不呈线性变化趋势(图 2b). 因为FeCl3溶液水解形成的Fe(OH)3碱性溶胶带正电,会吸附体系中带正电的微粒. 这些带正电的微粒主要有两种:一是没有变成胶体的Fe3+和与其结构相似的FeO+,体系中只会有部分Fe3+会水解为Fe(OH)3胶体,体系是一个动态平衡,反应有一定的限度;二是Fe3+水解产生的H+. Fe3+的水解导致原体系内带电粒子数目减少,但并非呈线性关系地减少,因此电导率下降也呈非线性变化. 由此可见,稀释促进了FeCl3溶液水解平衡向正向移动.
-
向50 mL新制的0.02 mol/L的FeCl3溶液中,依次加入一定量的饱和FeCl3溶液(3滴/次)并搅拌,示数稳定后打破平衡,继续滴加.
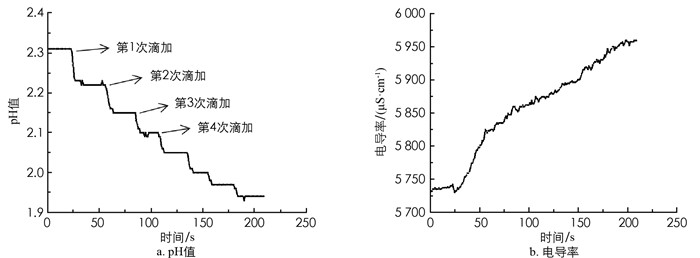
随着饱和FeCl3溶液的滴加,溶液的颜色逐渐加深,由浅黄色变为黄棕色,滴加4次后能看到较弱的丁达尔效应. 随后发现,将新制的0.1 mol/L FeCl3溶液静置0.5 h也能看到丁达尔效应. 实验表明FeCl3的水解聚合要经历一个过程,不同浓度和静置时间会促使水解程度不同[15].
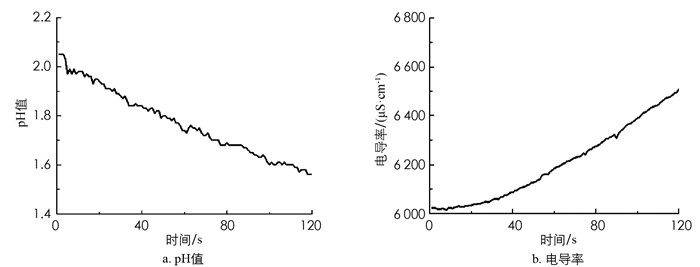
从图 3a可知,每次滴加饱和FeCl3溶液后,pH值先急剧下降,然后维持稳定,且随着FeCl3浓度不断增大,pH值下降趋势越来越小. 说明滴加过程中H+浓度增加,FeCl3溶液水解平衡向正向移动. 图 3b显示,随着饱和FeCl3溶液的滴加,溶液电导率呈上升趋势. 理论上讲,生成胶体会使得体系内的电导率下降,但新增加的参与水解部分的FeCl3相对于体系新增的FeCl3总量要少得多,水解的FeCl3只占一小部分,体系的带电微粒数增多,因此导致电导率不降反升.
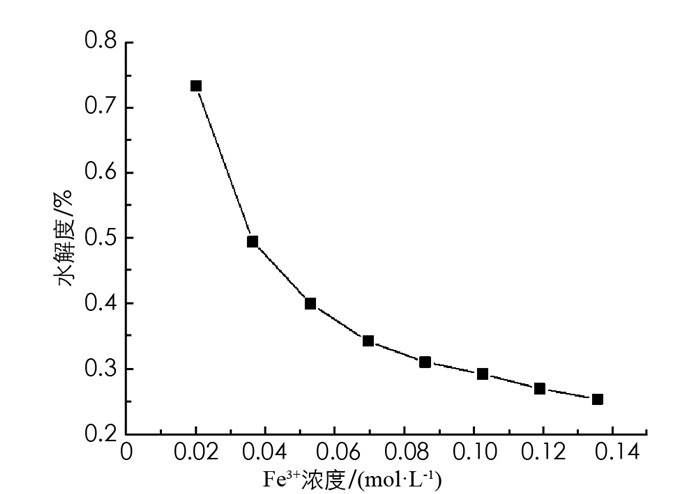
根据滴加饱和FeCl3溶液的滴数计算出投入FeCl3的总浓度,从手持技术实验软件中提取出每次滴加完达到新的水解平衡时的pH值,根据H(%)=3c(H+)/c(Fe3+)[16]计算出FeCl3的水解度(图 4).
从图 4曲线中可以看出向0.02 mol/L的FeCl3溶液中逐步滴加饱和FeCl3溶液,体系的pH值和水解度都降低,说明了随着体系中c(Fe3+)增大,能促进水解平衡正向进行,但水解程度随之降低. 换言之,稀释FeCl3溶液会使pH值和水解程度增大. 由图 4也可看出,盐溶液的水解程度是很微弱的,且盐类水解的概念只适合在稀溶液中提出.
-
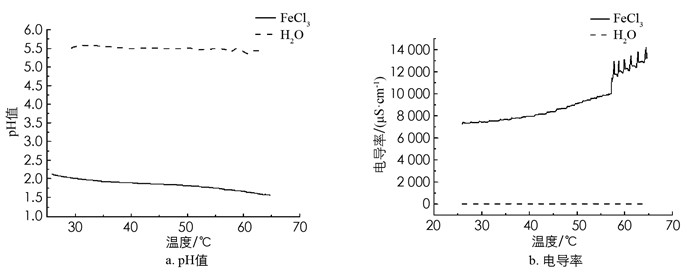
同时连接好温度传感器、电导率传感器及pH传感器,在加热条件下,测定0.02 mol/L FeCl3溶液(新制)的pH值及电导率变化情况,以蒸馏水作为对照实验(图 5),并记录20,40,60 ℃下FeCl3溶液颜色变化及丁达尔现象的情况(图 6). 由于本实验使用的电导率传感器的工作温度范围是0~80 ℃,pH传感器的工作温度范围是5~80 ℃,为防止对电极造成损坏,因此本实验溶液温度最高加热至65 ℃.
如图 5所示,随温度升高,FeCl3溶液的pH值从约2.1逐渐降至1.5,电导率增加了约一倍,而蒸馏水的pH值和电导率只有轻微的波动. 温度低于40 ℃时溶液的颜色变化不大,温度达到60 ℃时颜色加深为红棕色,能观察到明显的丁达尔现象(图 6). 升温能促使FeCl3溶液电离出更多的H+,使得pH值降低;溶液颜色逐渐加深并能观察到丁达尔现象,证明有Fe(OH)3胶体形成,由此可见,FeCl3的水解反应为吸热反应,升温可促进水解平衡向正向移动. 虽然多种羟基配合物在不断聚合,但温度越高,带电粒子运动速度越快,溶液的电阻越小,导电性增强,导致电导率升高.
实验过程中还发现,持续加热至80 ℃以上时,由于温度升高,胶粒运动速率加快,碰撞机会增多,胶核对粒子的吸附能力减弱,很容易聚沉出现红褐色沉淀. 因此,0.02 mol/L的FeCl3溶液形成胶体的最低温度为60 ℃. 值得一提的是,加热形成的胶体冷却后,放置一周仍有明显的丁达尔效应,采用此方法制得的Fe(OH)3胶体可以稳定存在.
-
将0.02 mol/L FeCl3溶液放置冰水浴中,测定其电导率和pH值(表 2实验1). 由表 2发现降温使得体系电导率下降,pH值上升,证明FeCl3水解平衡向左移动,水解被抑制.
将加热至30,40,50,60 ℃的FeCl3溶液(表 2实验2,3,4,5)分别冷却至室温,测定其电导率和pH值. 从表 2中的数据可以看出,电导率有大幅降低,pH值也大都有一定上升,但水解平衡却不能恢复到室温时的状态(7 294 μS/cm,pH=2.10),推测是因为加热过程中会生成Fe2O3·xH2O[17],导致反应平衡的不可逆. 在探究温度对水解平衡的影响系列实验中发现,温度因素对电导率的影响远远大于水解平衡移动所引起的电导率变化,建议改用具有温度补偿功能的电导率传感器.
-
室温下,使用高精度滴定管分别向50 mL新制的FeCl3溶液(0.02 mol/L)中滴加0.1 mol/L的NaOH,Na2CO3,NaHCO3及HCl溶液,控制滴速2~3滴/s,并搅拌,分别测定其pH值及电导率变化,探究碱和酸对体系平衡移动的影响. 表 3记录了FeCl3与碱性和酸性溶液反应的实验现象.
-
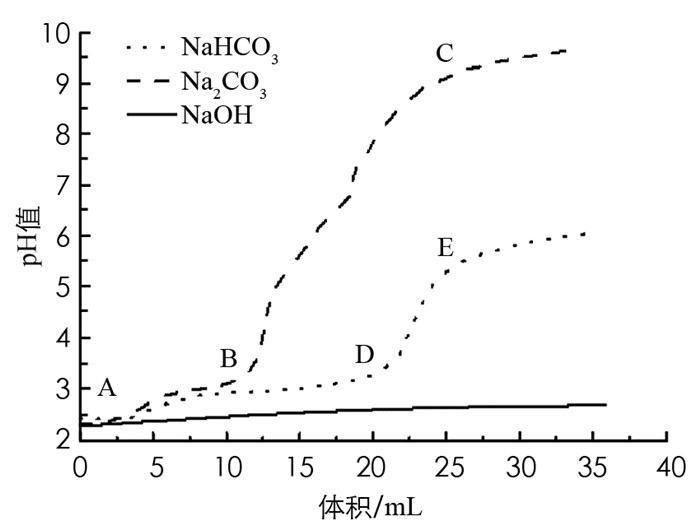
如图 7所示,随着NaOH的加入,溶液的pH值只是微微上升,即使加至反应当量的NaOH(30 mL)时,pH值仅上升至约2.65,溶液呈现明显的丁达尔现象(表 3序号1). 加入NaOH会消耗FeCl3水解产生的H+,但pH值上升趋势不大,这说明体系中有更多的H+被水解出来,抑制了pH值的上升,也证实了水解平衡向正向移动.
向FeCl3溶液中滴加Na2CO3和NaHCO3时,pH值均呈现先缓慢上升、后急剧上升并慢慢趋于平缓的变化. 滴加Na2CO3时,图 7中AB段有微量气泡产生,溶液由浅黄色变为橙褐色,并伴有丁达尔效应(表 3序号2). BC段反应剧烈,有Fe(OH)3沉淀和大量气泡产生. 滴加NaHCO3至约10 mL时有少量气泡产生,溶液由浅黄色变为橙褐色,并伴有丁达尔效应(表 3序号3). DE段反应现象与BC段相同. 结合实验现象及pH值变化曲线,本研究认为,AB段和AD段分别是CO32-和HCO3-与Fe3+水解产生的H+结合生成H2CO3,由于前期生成的H2CO3量较少,逸出液体的气体较少,且受搅拌的影响,只能观察到极少的气泡. 同时,体系中增加的OH-促进Fe3+进一步水解生成Fe(OH)3胶体,因此AB段和AD段发生部分双水解反应,pH值上升缓慢,溶液颜色变为橙褐色并能观察到明显的丁达尔效应. BC段和DE段则发生完全双水解反应,生成Fe(OH)3沉淀和大量气泡. 由两者pH值变化曲线的拐点可看出,相较NaHCO3,Na2CO3与FeCl3的双水解反应更为迅速.
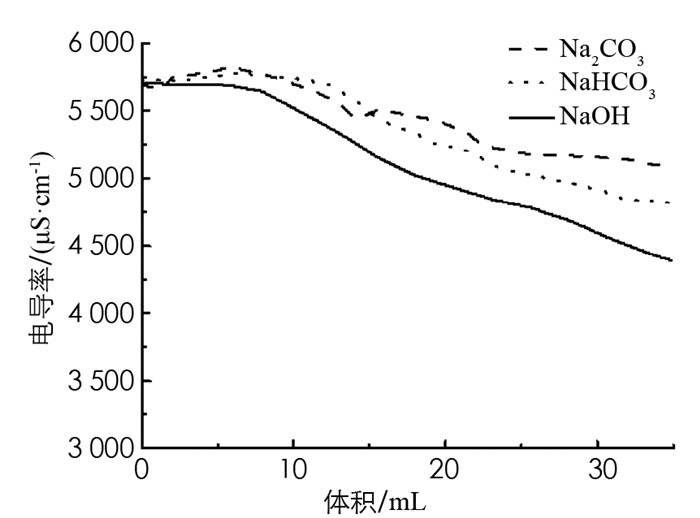
随着碱性溶液的加入,FeCl3溶液发生水解聚集形成胶体或沉淀,体系的导电性不如离子溶液强,体系内电导率均大幅下降(图 8). 综上所述,向水解平衡体系中加入碱和强碱弱酸盐,都能促进水解平衡正向移动. 而且,双水解对反应的促进作用更彻底.
探究本系列实验时,值得注意的是,滴加速度不宜过快,否则局部碱性过强,直接生成Fe(OH)3沉淀. 搅拌时速度不宜过快,磁子不得碰撞电导率及pH计探头,以免测量受波动. 滴加大量碱性溶液时,
$\left(K_{\mathrm{sp}}\left[\mathrm{Fe}(\mathrm{OH})_3\right]=4.0 \times 10^{-38}, \mathrm{pH}>3.5\right) $ ,形成的浊液分散系是不均一的,电导率测量会有偏差. 测量时,电极浸泡时间不宜太长. -
随着HCl溶液的滴入,溶液颜色逐渐变浅,由浅黄色褪为接近无色(表 3序号4). 从图 9a可以看出,随着盐酸的滴加,c(H+)增加,pH值下降,水解平衡逆向移动,使得Fe3+水解程度降低. 溶液中带电粒子H+,Cl-,Fe3+浓度的增加使溶液导电性增强,电导率曲线呈上升趋势(图 9b). 少量的HCl对FeCl3水解的抑制作用都是显著的.
-
本实验继续探究了碱性氧化物(CuO,CaO)和碳酸盐(CaCO3)粉末对FeCl3水解的影响. 依据理论计算,50 mL 0.02 mol/L FeCl3溶液完全发生反应(不考虑Fe3+水解),所需CuO,CaO和CaCO3的最少质量分别为0.12,0.084,0.15 g.
室温下,分别向新制50 mL 0.02 mol/L FeCl3溶液中加入理论计算量的CuO,CaO和CaCO3固体粉末,并用玻璃棒搅拌,静置后过滤,用激光笔照射,实验现象见表 4.
相较新制FeCl3溶液初始pH值及电导率(2.16,5 667 μS/cm),加入CuO,CaO及CaCO3固体后,溶液的pH值均小幅上升,电导率均下降,且溶液均呈现较明显的丁达尔效应. 这是由于CuO,CaO及CaCO3与Fe3+水解产生的H+反应,使体系c(H+)降低. 但pH值只小幅上升,且体系聚集形成胶体使导电离子数减少,因此Fe3+水解平衡正向进行,水解程度增大. 三者反应后均呈现较明显的丁达尔效应,氧化钙尤甚. 值得一提的是,放置一夜后,加入CaO粉末的一组溶液能持久呈现丁达尔效应(图 10),说明利用此方法可制备稳定的Fe(OH)3胶体.
3.1. 探究c(Fe3+)对水解平衡的影响
3.1.1. 稀释对水解平衡移动的影响
3.1.2. 增大c(Fe3+)对水解平衡的影响
3.2. 探究温度对水解平衡的影响
3.2.1. 升温对水解平衡的影响
3.2.2. 降温对水解平衡的影响
3.3. 探究c(H+)对水解平衡的影响
3.3.1. 碱性溶液对水解平衡的影响
3.3.2. 酸对水解平衡的影响
3.3.3. 碱性氧化物及碳酸盐对水解的影响
-
本研究利用手持技术中的pH传感器、电导率传感器及温度传感器,测定了不同外界条件影响FeCl3水解的pH值和电导率变化,佐证了盐类水解的主要影响因素. 同时,由数字化实验呈现的图形和数据分析了水解程度及双水解反应历程,实验过程中也获得了多种制备稳定胶体的方法. 本系列手持技术实验为教材中的实验活动提供了具体方案.
同时,本系列手持技术实验可以作为揭示“影响水解平衡的主要因素”教学的素材,使抽象概念显性化,定性实验定量化、动态化,能够转变学生学习方式及思维方式,培养学生曲线解读能力及“证据推理”素养;通过对比实验,强化学生控制变量的思想,学会分析化学平衡移动的一般思路和方法,培养学生的平衡观、变化观、宏微观及“模型认知”素养,真正践行信息技术与化学教学的深度融合.








 DownLoad:
DownLoad: