-
开放科学(资源服务)标识码(OSID):

-
烟草青枯病是由青枯雷尔氏菌(Ralstonia solanacearum)引起的严重土传病害[1],该病害突发性强、传播速度快、破坏力大,可对全球范围内的烟草、马铃薯、番茄、茄子、辣椒等茄科经济作物构成巨大威胁,严重影响农业生产与食品安全[2-3]。青枯菌能在土壤中存活达数年,一旦遇到高温高湿、根表伤口等触发因子,能迅速完成侵染,可在几日内堵塞维管束,阻碍水分运输,导致植株快速萎蔫[4-5]。由于气候条件适宜,该病害在热带和亚热带地区尤为猖獗[6]。青枯病不仅影响作物生产,还能改变土壤微生物群落结构,影响生态平衡,对后茬作物造成连作障碍[7]。
目前针对烟草青枯病的防治方法多样,其中,化学药剂因速效、易操作在烟叶生产过程中仍占主导地位,但单一长期使用化学药剂,容易造成农药残留和病原菌抗性增加等问题[8]。近年来,生物防治凭借环境友好、不易产生抗性等优势成为研究热点[9],但复杂的田间环境制约了生物防治效果的稳定性,且其速效性不足难以满足紧急防控需求。因此,综合应用抗病品种选育、轮作制度优化、土壤消毒处理及生物防治等多维措施已成为主流防控策略[10-11]。
生物—化学联合防治体系的构建为突破上述瓶颈提供了新思路。该策略既能实现病害的及时控制与持续管理,又可显著降低化学药剂用量及残留风险,同时弥补生防制剂药效不稳定、起效缓慢的缺陷,并为植株根际微生态环境的健康构建创造有利条件[12-13]。国内外学者已围绕此方向开展系列研究,证实化学杀菌剂与生防菌的组合应用具有协同增效潜力[14-15]。鉴于青枯菌在土壤中的持久存留特性及其多样化的传播途径,土壤杀菌剂的研发已成为化学防治领域的重要研究方向[16]。生防菌作为生物防治的重要组成部分,能够与作物的自然生态系统相协调,适应不同的种植环境和作物类型[17]。已有研究表明,特定生防菌与低剂量化学杀菌剂的配伍应用可形成互补机制,化学药剂通过抑制病原菌活性创造有利生态位点,促进生防菌快速定殖并发挥群体效应,从而提升整体防效[18-22]。
三氯异氰尿酸(TCCA)是一种高效广谱杀菌剂,具有杀菌效果好、残留毒性低等特点,因而被广泛应用于多种作物的病害防治[23]。研究发现,TCCA与短小芽孢杆菌、印度梨形孢等生防制剂具有良好的兼容性,二者联用可显著提升青枯病防控效果[24-25]。通过优化组合比例,即可达到增效作用,进而减少单一化学药剂的使用量,降低对环境的影响。研究以团队前期分离获得的具有显著抗病促生功能的DW8土壤谷氨酸杆菌为核心生防菌,室内外评价证实该菌株能有效延缓青枯病发生进程并促进烟株生长。基于此,构建杀菌剂—生防菌联合防控体系,重点探究TCCA与DW8的联合应用对烟草青枯病的防控效果,旨在挖掘DW8的潜在防治效能,为建立高效、环保的烟草青枯病综合防控技术体系提供理论依据与实践指导。
HTML
-
供试品种为云烟121。供试制剂为三氯异氰尿酸。供试菌剂为青枯菌CQPS-1(GenBank登录号为NZ_CP016914.1),由西南大学天然产物农药研究室从重庆市烟草青枯病发病区(重庆市彭水县润溪乡)病株中分离,经室内鉴定为致病性较强的Ralstonia solanacearum菌株,于实验室-80℃冰箱中保存[26]。DW8(Glutamicibacter soli)为课题组前期从发病烟区健康植株根际土壤中分离获得,对烟草青枯病具有显著防控效果。
-
试验采用随机区组设计,设置4个处理,每个处理重复3次,共12个小区,详见表 1。小区面积约67 m2,设置保护行,试验地面积约800 m2。三氯异氰尿酸具体稀释倍数根据土壤湿度调整,不低于1 500倍液,每667 m2施用500 g;菌剂DW8每株烟灌根300 mL。在烟草团棵期进行灌根处理,其中T3处理先灌根三氯异氰尿酸,14 d后开展DW8菌液灌根,旨在消除消毒剂对微生物菌剂的干扰。
-
参照《烟草农艺性状调查测量方法》(YC/T 142—2010),对试验区各处理组烟草生育期(主要包括移栽期、团棵期、旺长期、现蕾期、打顶期、采收期)进行调查记录。
-
各处理组选择有代表性的5株烟株挂牌标记,参照《烟草农艺性状调查测量方法》,在烟草伸根期、团棵期、现蕾期、打顶期后7 d及采收后期测定烟株的农艺性状,主要包括烟株的株高、茎围、有效叶片数、最大叶长、最大叶宽,并计算最大单叶面积。
-
烟草病害发生情况参照《烟草病虫害分级及调查方法》(GB/T 23222—2008)调查。结合当地的根茎病害发生特点,主要对各种病害进行系统调查,调查每个小区的发病株数及发病级数,计算发病率,病害调查可与烟草农艺性状的测定同步进行。根据不同病害的发生情况,在发病初期开始调查,每隔5 d调查一次,连续调查4次以上。病株率及病情指数计算公式如下:
烟草青枯病病害调查以株为单位分级调查,分级标准如下:
0级:全株无病;
1级:茎部病斑不超过茎围的1/3,或1/3以下叶片凋萎;
3级:茎部病斑环绕茎围1/3至1/2,或1/3至1/2叶轻度凋萎,或下部少数叶片出现病斑;
5级:茎部病斑超过茎围的1/2,但未全部环绕茎围,或1/2至2/3叶片凋萎;
7级:茎部病斑全部环绕茎围,或2/3以上叶片凋萎;
9级:病株全部叶片凋萎或枯死。
-
参照沈宗专等[27]的方法,本试验采取5点取样法,在每个小区随机选择烟株5株,拔出烟株,抖落块土,用毛刷刷下根际0~5 mm处的土壤,每2株混合均匀后用采样袋装好,置于冰盒,-80 ℃冰箱保存备用。
-
委托上海美吉生物医药科技有限公司进行Illumina MiSeq测序、质控、拼接和优化数据,获得ASV(Amplicon Sequence Variant)代表序列和丰度信息。基于ASV代表序列及丰度信息,进行群落组成分析、群落多样性分析、物种差异分析和相关性分析。
-
采用Excel 2013对试验数据进行整理,计算出发病率、病情指数和防病效果;采用SPSS 17.0统计软件比较分析相关数据在p<0.05时的差异性。
1.1. 研究材料
1.2. 调查内容
1.2.1. 田间防效验证
1.2.2. 生育期调查
1.2.3. 烟株农艺性状调查
1.2.4. 病害调查
1.3. 烟草根际土壤微生物结构与功能分析
1.3.1. 烟草根际土壤取样
1.3.2. 根际微生物群落分析
1.3.3. 烟草根际土壤微生物DNA提取和文库构建
-
不同处理对烤烟生育期的影响如表 2所示,不同处理烟株生育期基本一致,在防治青枯病的技术体系中,采用消毒剂联合有益菌的防治方法可在不影响生育进程的前提下达到预期效果,这为生产实践提供了重要参考。
-
不同处理对烟草不同时期农艺性状的影响如表 3至表 5所示。消毒剂提前灌根处理后烟株对团棵期前期长势有一定的抑制作用,但不影响后期烟株长势,通过数据分析发现,不同处理与对照组在株高、最大叶长、最大叶宽、茎围及叶面积均未呈现显著差异。但现蕾期和打顶期TCCA+DW8处理组在最大叶面积和茎围方面显著优于对照组,比对照高出8.91%和16.58%(现蕾期)、12.76%和7.30 %(打顶期)。
-
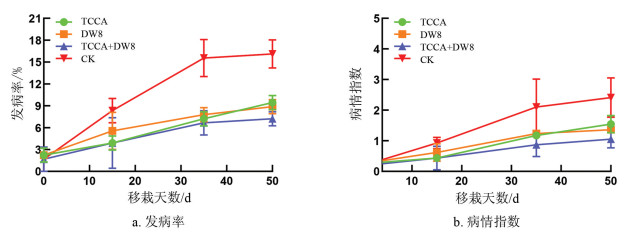
试验区内6月下旬开始发生根茎类病害,系统调查结果如图 1所示,随时间变化,试验区各处理的青枯病的发病率及病情指数逐渐上升。如表 6所示,各处理对烟草青枯病均有一定的相对防效,其中TCCA+DW8对青枯病防治效果最佳,发病高峰期相对防效达到66.57%。
-
对不同处理根际土壤微生物测序数据进行α多样性分析,结果如表 7所示,不同处理的覆盖度指数均大于0.99,表明该群落结构的测序数据可以充分合理反映微生物群落的多样性和丰富度。表中Ace指数和Chao指数反映群落的丰富度,Shannon指数和Simpson指数反映群落的多样性。处理TCCA、DW8、TCCA+DW8和对照组的细菌、真菌Ace指数、Chao指数、Shannon指数和Simpson指数均无显著差异(表 7),表明处理未显著改变土壤微生物群落的物种丰富度或均匀度(p < 0.05)。
-
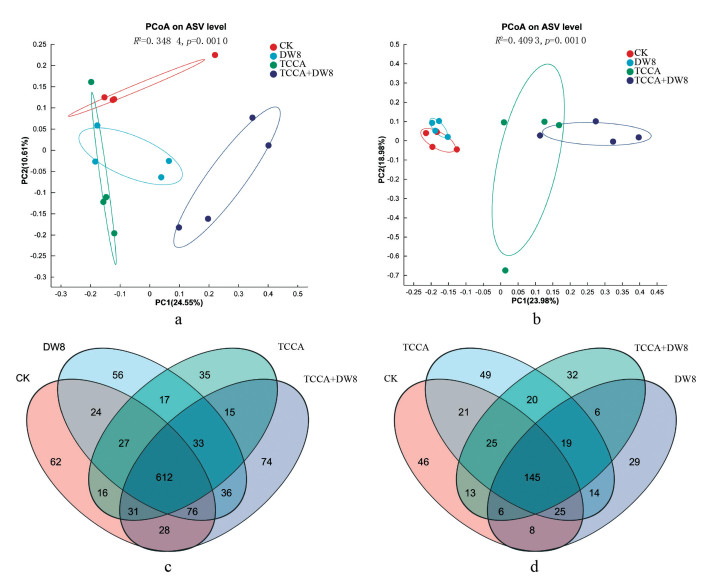
在ASV水平,利用基于Bray-Curtis的PCoA分析,不同处理后根际土壤细菌群落组成的差异如图 2a所示。第一主坐标(PC1)贡献率为24.55%,第二主坐标(PC2)贡献率为10.61%,DW8处理组、TCCA+DW8处理组和对照组明显分离,且DW8处理与对照组分离距离最远,各处理样品间的细菌群落组间差异大于组内差异,细菌群落差异显著(R2=0.348 4,p=0.001 0),表明生防菌(DW8)的添加会显著改变土壤中细菌群落结构。
真菌群落的PCoA分析结果表明(图 2b),第一主坐标(PC1)贡献率为23.98%,第二主坐标(PC2)贡献率为18.98 %,ANOSIM组间差异检验的R值为0.409 3,p值为0.001 0。同时,各处理在PC1轴上分离,其中TCCA+DW8、DW8处理样本点与空白对照距离较远,表明经TCCA+DW8、DW8处理的根际土壤真菌群落结构组成与空白对照相比差异较大。
通过物种VENN图分析统计了不同处理后烟草根际土壤中共有和特有的微生物属的数量(图 2c、d),不同处理后烟草根际土壤中共有的细菌属为302个、真菌属915个,TCCA、DW8、TCCA+DW8和对照处理组特有的细菌属分别为35、56、74和62个;TCCA、DW8、TCCA+DW8和对照处理组特有的真菌属分别为49、29、32和46个,表明各处理间微生物群落结构的显著差异,同时反映出消毒剂TCCA与菌剂DW8联合处理对根际微生态系统的协同调控效应。尤为值得注意的是,TCCA+DW8组在细菌特有属的数量上有显著提升(74个),两种处理的联合应用可能通过功能互补机制创造了新的生态位,促进了特异功能菌群的定殖。
-
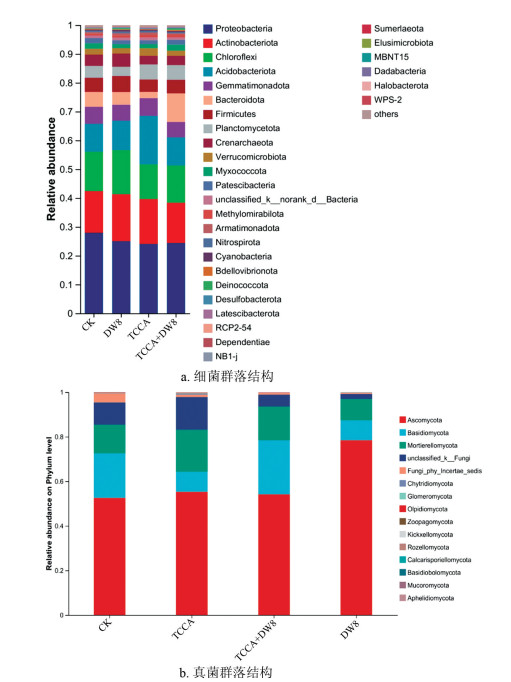
TCCA、DW8、TCCA+DW8和对照组土壤细菌群落在门水平的组成情况如图 3a所示,各处理组细菌群落均以变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteriota)、芽单胞菌门(Gemmatimonadota)、拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、浮霉菌门(Planctomycetota)为优势菌门,其中变形菌门的相对丰度最大,对照组变形菌门相对丰度最高,为27.92%;DW8处理组放线菌门相对丰度为16.31%,绿弯菌门相对丰度为15.27%,厚壁菌门相对丰度为10.05%;TCCA处理组酸杆菌门相对丰度为16.82%、单胞菌门相对丰度为6.21%,浮霉菌门相对丰度为5.24%;拟杆菌门在TCCA+DW8处理组中相对丰度最高,为9.38%。上述结果表明不同处理通过选择性调控特定细菌类群的丰度,显著重塑了根际土壤微生物群落结构,其中联合处理(TCCA+DW8)导致拟杆菌门的特异性富集,反映了两种处理的协同增效机制:TCCA消毒剂缓解病原胁迫后,DW8菌剂进一步通过营养竞争或代谢互作激活了具有有机物降解功能的拟杆菌类群,从而优化根际微环境。
TCCA、DW8、TCCA+DW8处理组和对照组土壤真菌群落在门水平的组成情况发现(图 3b),真菌群落主要以子囊菌门(Ascomyeota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)为主,其中处理DW8能够显著提高子囊菌门(Ascomyeota)相对丰度,相较于对照上升了25.9%;同时,TCCA和DW8处理组均降低了担子菌门(Basidiomycota)的相对丰度,分别降低了11.0%和11.1%。这些结果为解析TCCA消毒剂与DW8菌剂在调控真菌群落、抑制土传病害中的作用机制提供了重要依据,同时也为优化真菌群落结构以增强土壤健康提供了理论支持。
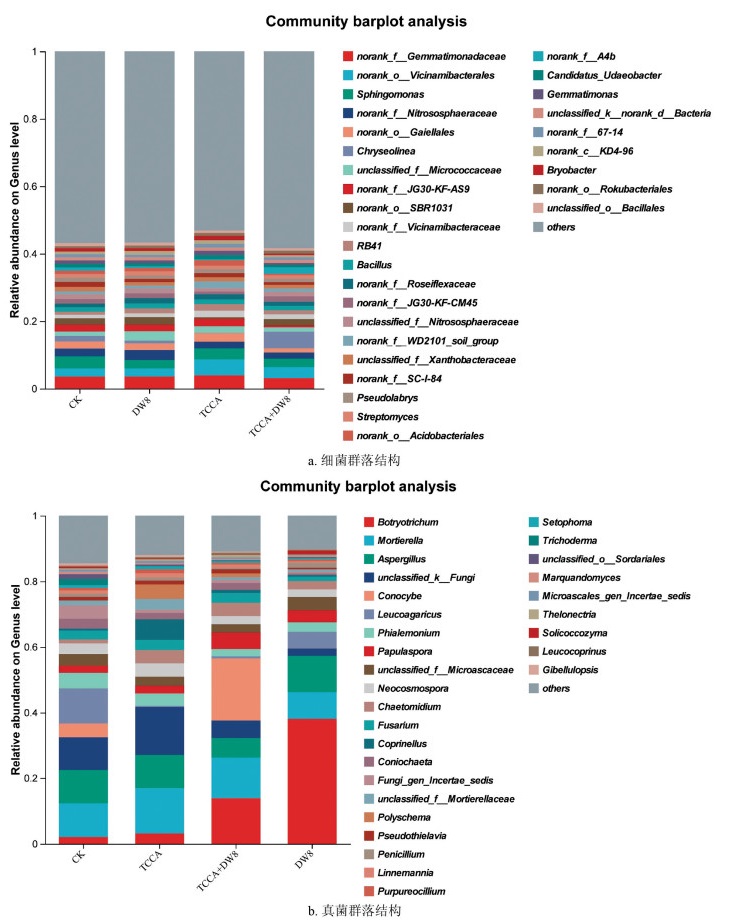
消毒剂TCCA和菌剂DW8处理后土壤细菌群落在属水平下组成如图 4a所示,与对照相比,TCCA处理后鞘氨醇单胞菌属(Sphingomonas)、Chryseolinea相对丰度降低;TCCA+DW8处理后鞘氨醇单胞菌属(Sphingomonas)、链霉菌属(Streptomyces)相对丰度降低;DW8处理后鞘氨醇单胞菌属(Sphingomonas)、Chryseolinea相对丰度降低,而芽孢杆菌属(Bacillus)、链霉菌属(Streptomyces)相对丰度升高,该结论进一步验证了其通过功能菌定殖增强土壤抗病能力的机制。
消毒剂TCCA和菌剂DW8处理后土壤真菌群落在属水平下组成如图 4b所示,TCCA、DW8、TCCA+DW8处理均降低了空白菌属的优势菌属为白环蘑属(Leucoagaricus)、Phialemonium相对丰度,提高了毛葡孢属(Botryotrichum)、丝核菌属(Papulaspora)相对丰度。值得注意的是,相对于CK,处理DW8降低了镰刀菌属(Fusarium)的相对丰度,镰刀菌属通常与多种植物病害相关。总之,不同的处理会通过调节土壤真菌群落的组成,增强了土壤的抑病能力,从而为植物生长提供了更有利的微生物环境。
2.1. 不同处理对烟草生育期的影响
2.2. 不同处理对烟草农艺性状的影响
2.3. 不同处理对烟草青枯病的防治效果
2.4. 不同处理对烟株根际微生物群落的影响
2.4.1. 不同处理根际土壤细菌、真菌群落α多样性分析
2.4.2. 不同处理根际土壤微生物β多样性分析
2.4.3. 不同处理根际土壤细菌群落组成分析
-
青枯病是全球性重要植物病害,严重影响了包括烟草、番茄、茄子等在内的多种茄科经济作物的产量与品质,因此其防治一直是农业科研领域的热点之一。近年来,化学—生物联合防治在青枯病方面取得了显著进展,尤以消毒剂与生防菌的联合应用最具潜力[28]。研究表明,二者协同可在降低病原体初始侵染源的同时,强化作物自身抗病能力,从而实现对青枯病更加持久且高效的控制[29]。低剂量氯基或季铵盐类消毒剂预先处理土壤,可迅速减少病原青枯菌数量;随后引入特定生防菌株。例如,通过使用低浓度的氯基或季铵盐类消毒剂处理土壤,可以有效减少土壤中病原细菌的数量,之后接种特定的生防菌株(如芽孢杆菌属或假单胞菌属)。这些有益微生物不仅能够占据病原菌生存的空间位点,还能分泌抗菌物质抑制病原菌生长,甚至激活植物的系统获得抗性机制,从而达到协同增效的目的[30]。贾喜霞等[31]的研究表明,土壤消毒剂联合微生物有机肥及生防菌剂可有效提升连作茄子的根系吸收功能,增强叶片的光合作用性能,促进植株生长并增加产量。周登博等[32]发现,在降低土壤中病原菌的基础上,将拮抗菌饼肥发酵液与土壤消毒剂配合施用,不仅可以增加土壤中拮抗微生物的种类,还能提高土壤微生物多样性,进而改善土壤微生物生态结构。
本研究通过整合三氯异氰尿酸化学消毒与DW8有益菌拮抗的协同策略,揭示了二者在青枯病防控体系中的互补关系。从作用时序来看,TCCA作为广谱氧化性消毒剂,通过释放次氯酸分子直接灭杀根际土壤中的青枯菌,快速降低病原基数至阈值以下,为后续生防菌定殖创造低竞争的压力环境。而DW8在消毒剂处理后的微生态位中快速增殖,占据病原菌的潜在定殖位点,构建利于植物抗病的微生物屏障。其次DW8还可能分泌抗菌物质,从而激活烟草系统抗性相关基因,具体机制尚待进一步研究。从系统调控角度来看,联合处理通过“化学消杀—生物占位”的级联效应,不仅能够降低病原体基数,还能促进土壤中有益微生物群落的发展,从而构建更加健康稳定的土壤微生物生态系统,强化植物的自然防御能力,实现青枯病的高效防控。该协同策略突破了传统化学防治的耐药性困境,同时规避了单一生物防治响应滞后的缺陷,其揭示的“消毒—定殖—拮抗”动态互作规律为土传病害的生态调控提供了新范式,也为微生态定向调控技术的开发奠定了理论基础。
-
田间试验结果表明,各处理对烤烟生育期无影响,现蕾期和打顶期TCCA+DW8处理在最大叶面积和茎围上显著优于对照组,其中最大叶面积较对照分别提高8.91 %和16.58 %(有效叶面积)、茎围较对照分别提高12.76 %和7.30 %,说明TCCA+DW8协同处理能够有效提高烤烟打顶后的叶面积及抗倒伏能力。病害调查结果表明,所有处理均对青枯病有一定防效,前期消毒剂TCCA单独处理能够有效防治青枯病,但后期其相对防效降低。而生防菌DW8单独处理在后期表现出较好的防效,体现了生物防治的持续性和稳定性。总的来说,TCCA+DW8联合处理对青枯病的防效可达66.57%,显著优于二者单用,说明三氯异氰尿酸50 g/667 m2增施DW8 300 mL/株可有效控制烟草青枯病。上述结果为生物—化学联合防治提供了实践基础,充分验证了其高效性、稳定性和可行性。因此,消毒剂和生防菌联合防治青枯病值得进一步深入研究和开发利用。
在对烟草根际土壤微生物结构与功能的分析中,基于Bray-Curtis距离的PCoA分析显示,DW8处理、TCCA+DW8处理和对照组在主坐标空间内呈现明显的空间分离趋势(图 2a,2b),且DW8处理与对照组的分离距离最大,ANOSIM检验进一步证实,各处理样品间的细菌群落组间差异大于组内差异,细菌群落差异显著(R2=0.348 4,p=0.001 0),表明DW8的引入显著改变了土壤细菌和真菌的群落结构。门水平上,不同处理组的烟草根际土壤微生物群落组成基本一致(图 3),但各处理间优势菌门占比存在差异;在属水平,不同处理组的烟草根际土壤微生物的群落组成部分一致(图 4),但各处理群落组成发生了一定的变化。综合而言,对照组的烟草根际土壤微生物结构与其余处理有较大差异,并且与DW8和TCCA+DW8处理差异最大,该结果与病害调查结果一致,说明使用三氯异氰尿酸消毒剂增施拮抗菌DW8或单独施用拮抗菌DW8能够改变烟草根际土壤微生物群落结构,从而有效防控烟草根茎病害。





 DownLoad:
DownLoad: