-
体外培养的大脑皮质神经元是研究神经元自身生理特征、神经元与非神经元相互关系以及构建诸多神经系统疾病体外模型的重要实验平台[1].原代培养是获得大量大脑皮质神经元的重要途径.
目前神经元培养体系主要分为两类[2-7],一种是Dulbecco's modified eagle medium(DMEM)加胎牛血清(fetal calf serum,FBS)培养体系,另一种是Neurobasal加B27无血清培养体系[8-9].尽管这2种培养体系在基础研究中均被广泛采用,但目前尚缺少比较系统全面的研究[10-15].明确不同培养方法对神经元生长成熟时间、形态特征、纯度及活力等重要细胞生物学特征参数的影响,有助于神经元离体实验研究中合理选择培养基法.
为此,本研究比较了上述2种方法培养所得新生SD大鼠大脑皮质神经元在生长成熟时间、形态特征、纯度及活力等方面的差异,以期明确原代培养方法本身对神经元重要生物学特征的影响,为离体实验中选择恰当的神经元原代培养基法提供参考.
全文HTML
-
DMEM培养基,Hyclone公司;Neurobasal培养基,B27培养基添加剂,Gibco公司;FBS,杭州四季青生物公司;Pen-strep双抗,0.25%胰蛋白酶,Genview公司;L-多聚赖氨酸,MTT,DMSO,Sigma.
-
兔抗神经元特异性相关微管蛋白(Map-2)多克隆抗体,兔抗神经胶质纤维酸性蛋白(GFAP)多克隆抗体,兔抗血小板-内皮细胞粘附分子(CD31)多克隆抗体,兔抗巢蛋白(Nestin)多克隆抗体及FITC标记山羊抗兔二抗,武汉三鹰公司;兔抗磷酸化S6核糖体蛋白(p-S6)单克隆抗体,CST公司.
-
CO2细胞培养箱,ESCO公司;倒置相差显微镜,奥特公司;酶标仪,Bioteck公司;倒置荧光显微镜,莱卡公司;4 ℃/-20 ℃冰箱,海尔公司.
-
SPF级清洁新生24 h内SD大鼠(雌雄不限)购自重庆滕鑫生物技术有限公司.
-
取新生24 h内SD大鼠,用酒精擦拭皮肤,断颈处死后,置于75%酒精内消毒.在盛有PBS的玻璃皿中取出大脑,分离大脑皮质,剥离血管膜,将组织置于预先盛有DMEM培养基的培养皿中,剪碎约1 mm3,收集剪碎的皮质,1 000 r/min离心8 min.弃上清液,加入0.25%胰蛋白酶消化10 min,每5 min振摇1次,加入含10% FBS的DMEM培养基终止消化10 min,每5 min振摇1次,过200目筛网.滤液等分量分配,分别用于后续2种方法培养.
-
取滤液,1 000 r/min离心5 min,弃上清液,加入含10%FBS的DMEM培养基,吹打均匀,计数,调整细胞密度,以1.4×105个/mL和2×105个/mL的密度分别接种在预先用L-多聚赖氨酸包被的96孔板和6孔板上.置于37 ℃,5% CO2的恒温培养箱中培养8 h后,换为含2% B27的Neurobasal无血清培养基,以后每隔2 d半量换液1次.
-
取滤液,1 000 r/min离心5min,弃上清液,加入含2% B27的Neurobasal无血清培养基,吹打均匀,计数,调整细胞密度,以1.4×105个/mL和2×105个/mL的密度分别接种在预先用L-多聚赖氨酸包被的96孔板和6孔板上.置于37 ℃,5% CO2的恒温培养箱中培养24 h后,全量换液,以后每隔2 d半量换液1次.
-
自细胞接种日起,每24 h在倒置相差显微镜下观察细胞的生长状况和形态学变化,并于培养1,3,5,7 d拍照记录[10-16].
-
启用重庆奥特光学仪器显微捕获系统USB2.0 Camera Viewer软件拍照,每组随机拍摄3个视野,拍照后运用手动计数功能计数细胞,计算3个视野细胞的平均数目,数据以平均数±标准差表示.
-
将细胞悬液按1.4 × 105个/mL密度接种于96孔板中,于培养1~8 d采用MTT法检测细胞活力. MTT操作方法:检测前配制MTT溶液,调整浓度为5 mg/mL;每孔加入MTT溶液20 μL,37 ℃继续孵育4 h,终止培养;吸弃孔内培养基,每孔加入150 μL DMSO,振荡10 min;酶标仪检测各组在490 nm波长下的吸光度;实验重复3次;每个观察时点选择6个数据,求平均值,并绘制细胞活力曲线.
-
细胞培养第1,4,7 d,运用Map-2标记神经元、GFAP标记胶质细胞、CD31标记内皮细胞、Nestin标记神经干细胞,采用细胞免疫荧光染色法检测上述分子标记物表达;在显微镜下随机选取10个观察视野(×200)并拍照,分别计数各观察时点Map-2,GFAP,CD31,Nestin阳性细胞数,计算各类细胞的构成比,以鉴定神经元纯度及杂细胞比例.
-
细胞培养第1,4,7 d,用p-S6表征细胞活性状态[18],采用细胞免疫荧光染色法检测p-S6蛋白表达;在显微镜下随机选取10个观察视野(×200)并拍照,计数p-S6阳性细胞数,每个观察时点计数3次,计算每个视野p-S6阳性细胞平均数.
-
上述观察时点,弃培养液,PBS洗5 min,3次;4%多聚甲醛固定15 min,PBS洗5 min,3次;10% BSA 37 ℃封闭1 h,分别加入一抗(Map-2,1:50;GFAP,1:500;CD31,1:300;Nestin,1:50;p-S6,1:25)4 ℃过夜,PBS洗5 min,3次.依据一抗来源,加入相应的FITC标记二抗工作液,37 ℃避光孵育1 h,PBS洗5 min,3次. DAPI染色标记细胞核,室温孵育5 min;PBS洗5 min,3次.封片后荧光显微镜下观察并拍照.阴性对照用PBS代替一抗,其余步骤同上.
-
实验数据表达为平均数±标准差.利用IBM SPSS 20.0统计学软件分析数据的统计学意义;两组间比较采用T检验,多组间比较采用单因素方差分析,p<0.05为差异具有显著性.
1.1. 试剂和仪器
1.1.1. 试剂
1.1.2. 抗体
1.1.3. 仪器
1.2. 实验动物
1.3. 实验方法
1.3.1. 皮质神经元取材及分离
1.3.2. DMEM培养基加Neurobasal无血清培养基法培养[4]
1.3.3. Neurobasal无血清培养基法培养[6]
1.3.4. 形态学观察
1.3.5. 细胞计数
1.3.6. MTT法检测细胞活力[4, 17]
1.3.7. 神经元纯度鉴定及杂细胞构成比检测
1.3.8. 原位检测神经元细胞活性
1.3.9. 细胞免疫荧光染色[4]
1.4. 数据处理及统计学分析
-
初接种时,细胞呈圆形,无突起,胞体透明.培养6h后90%以上已贴壁,镜下见细胞呈圆形或椭圆形,透亮、体积小,周边环绕光晕,少数细胞已有细小短突起.换用无血清培养基培养1 d后,大部分细胞长出突起,少数细胞间可见突起连接;胞体饱满呈圆形或椭圆形,光晕明显.培养3 d,神经元胞体继续增大,呈圆形或纺锤形,表面光滑,折光性强,突起明显增粗增长,呈双极或多极,以双极为主,较多突起相连接,形成稀疏细胞网络.培养5 d后,大量神经元胞体开始聚集,突起进一步增多、增长,细胞间突起相互连接呈网络样.培养7 d,胞体明显聚集,突起增多伸长且分支很多,形成致密细胞网络.各观察时点上述形态学变化特征两组间差异无统计学意义,见图 1.
-
Neurobasal无血清培养基法所培养的细胞数目在第1 d后明显高于另一组,差异具有统计学意义(p<0.05),见表 1.
-
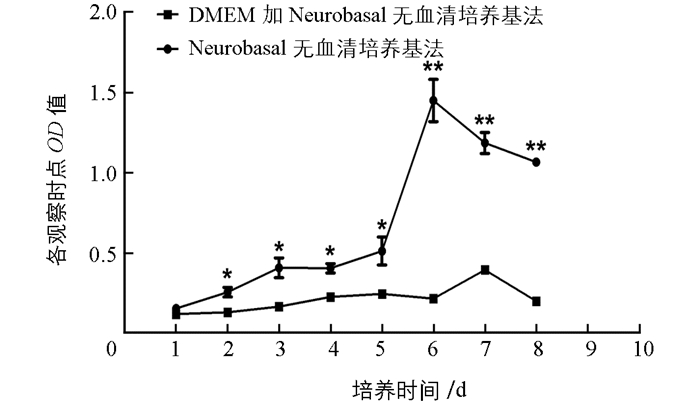
MTT检测显示,细胞培养2~5 d时,两组OD值均上升,且各观察时点OD值组间差异具有统计学意义(p<0.05);Neurobasal无血清培养基法培养6 d时OD值达峰,之后逐渐下降,表明培养6 d时细胞活力最强;而DMEM加Neurobasal无血清培养基法培养7 d时OD值达峰,之后逐渐下降,表明培养7 d时细胞活力最强.且培养6~8 d时,两组间相应时点OD值差异具有统计学意义(p<0.01),见图 2.
-
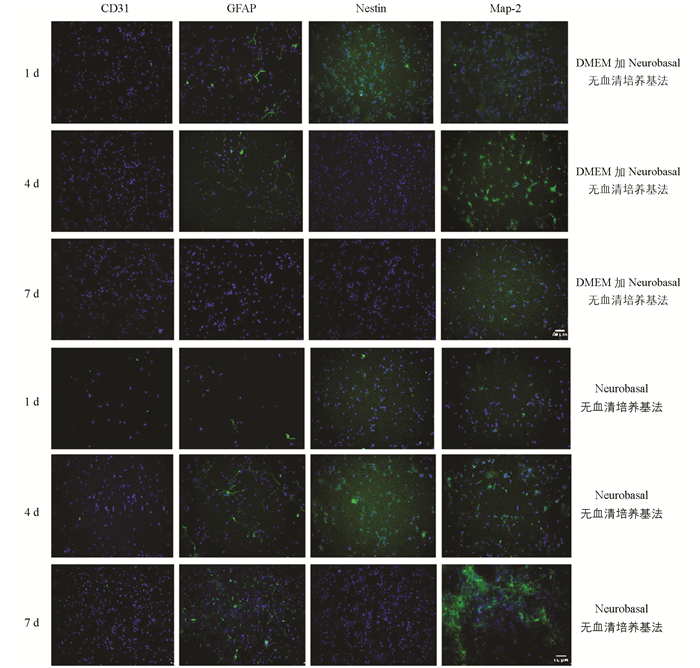
免疫细胞化学染色结果显示,DMEM加Neurobasal无血清培养基法培养所得细胞在前4 d含有较多的非神经元细胞,经鉴定为星形胶质细胞和神经干细胞;4 d后神经元纯度升高,7 d后神经元纯度可达92.43%(图 3,表 2). Neurobasal无血清培养基法培养所得细胞在第1 d含少许神经干细胞和星形胶质细胞,神经元纯度较低;4 d后,神经干细胞减少,星形胶质细胞增多,神经元纯度也迅速升高;7 d后星形胶质细胞减少,神经元纯度可达96.94%(图 3,表 2).
-
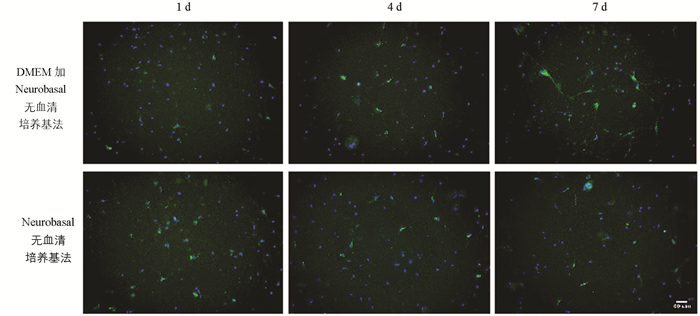
取培养1,4,7 d皮质神经元进行p-S6原位检测,结果显示,p-S6阳性细胞胞质呈绿色,胞核呈蓝色. Neurobasal无血清培养基法培养所得p-S6阳性细胞明显高于DMEM加Neurobasal无血清培养基法(p<0.01),提示Neurobasal无血清培养基法所培养的细胞活性更强,见图 4,表 3.
2.1. 神经元形态学观察
2.2. 培养方法对细胞数目的影响
2.3. 培养方法对细胞活力的影响
2.4. 培养方法对神经元纯度的影响
2.5. 培养方法对细胞活性的影响
-
神经元离体实验研究中,获得纯度高、生命力旺盛的神经元是确保实验顺利实施的关键,明确混杂细胞对实验结果的可能影响有助于优化研究方案,更加科学合理地阐释实验结果.
影响神经元存活的因素很多,除了培养器皿、实验动物之外,培养基的选择及培养基法的制定至关重要[19].目前常用的培养基方案有2类,一类是用含10%胎牛血清的DMEM培养基种植神经细胞,8 h后换成不含血清的Neurobasal培养基[4];另一类是用无血清的Neurobasal培养基种植神经细胞,24 h后全量换液[6].这2种培养基法均简单易行、操作方便,且成功率高;但均不能获得100%纯度的神经元.究竟哪种培养基法获得的神经元纯度更高呢,目前尚缺少系统对照研究.
本研究观察了上述2种不同培养基法下不同观察时点的细胞形态学,结果发现,培养第1 d时,DMEM加Neurobasal无血清培养基法平均计数所得的细胞为(70±1.5)个/视野,而Neurobasal无血清培养基法平均计数所得的细胞为(101±2.1)个/视野,两者相差较大.随着培养时间的延长,2种培养方法的细胞数目均升高,且Neurobasal无血清培养基法的细胞数目在培养第3 d开始,与DMEM加Neurobasal无血清培养基法差异有统计学意义(p<0.05),提示培养方法对细胞数目有重要影响. DMEM加Neurobasal无血清培养基法含有血清,但培养8 h后,再换成Neurobasal无血清培养基培养,含有血清的培养基可以促进细胞的贴壁,培养8 h后,换用Neurobasal无血清培养基选择性的培养神经元,由于细胞生存环境的突然改变,导致了部分细胞死亡,使得细胞数目减少.实验过程中也发现培养1 d后,有较多的细胞漂浮,证实了上述推测.而Neurobasal无血清培养基法不存在8 h换液过程,所以细胞数目显著高于DMEM加Neurobasal无血清培养基法.
Map-2是一种神经元胞体及树突标志物,本实验以Map-2作为成熟神经元的标记,对上述2种培养基法培养的大鼠脑皮质神经元进行纯度鉴定[20],结果显示,培养1,4,7 d,DMEM加Neurobasal无血清培养基法培养所得神经元纯度分别为29.89%,91.86%,92.43%,而Neurobasal无血清培养基法培养所得神经元纯度分别为7.44%,94.86%,96.94%.对比2种培养基法发现,DMEM加Neurobasal无血清培养基法第1 d Map-2阳性细胞百分比远大于Neurobasal无血清培养基法.推测可能的原因是,由于Map-2表征的是成熟神经元,DMEM加Neurobasal无血清培养基法前8 h的培养中含有富含营养因子的血清,不仅为细胞提供了营养,而且促进了细胞的成熟[21];而Neurobasal无血清培养基法,没有血清,细胞在培养第1 d还未成熟,因此染色数目较少.随着培养时间延长,细胞逐渐成熟,Map-2阳性百分比也就升高.且随着培养时间延长,Neurobasal无血清培养基法可以获得更高纯度的神经元.既往纯化神经元,通常采用阿糖胞苷进行干预[20],这不仅实验繁琐,还可能影响神经元生长.而Neurobasal无血清培养基法无需添加阿糖胞苷,培养7 d即可获得96.94%高纯度的神经元,这为神经元离体实验研究奠定了坚实的基础.
神经元纯度究竟受哪些非神经元细胞的影响呢?为明确这一问题,本研究采用GFAP表征星形胶质细胞,nestin表征神经干细胞[22],CD31表征内皮细胞[23].免疫细胞化学染色结果显示,2种方法培养1,4,7 d时,所得细胞均未检出CD31阳性细胞;原因可能是:1)原代神经元取材过程较为粗糙,获得的内皮细胞较少;2)培养方法中Neurobasal无血清培养基的选择性培养,导致内皮细胞无法存活.
而在培养1,4 d时,2种方案所培养出的细胞均含有一定数量的星形胶质细胞和神经干细胞.其中,Neurobasal无血清培养基法培养第4 d时,神经干细胞数量减少,星形胶质细胞与神经元增多,推测其中部分星形胶质细胞和神经元有可能从混杂的神经干细胞分化而来;但7 d后,星形胶质细胞减少,神经元纯度增加达96.94%.表明:1) Neurobasal无血清培养基法有助于神经干细胞选择性地向神经元分化,并促进其存活. 2) Neurobasal无血清培养基法有助于纯化细胞,促进非神经元细胞的死亡.而DMEM加Neurobasal无血清培养基法的纯度达92.43%.这表明,采用上述2种方法原代培养大脑皮质神经元时,影响神经元纯度的细胞主要是星形胶质细胞和神经干细胞;同时强烈提示,神经干细胞的存在可能对培养的神经元数量产生一定的影响.运用Neurobasal无血清培养基可以选择性地培养神经元细胞,提高细胞纯度.
除神经元纯度外,细胞生存能力及其活性状态均是考察培养神经元质量的重要指标.尤其细胞活性制约其对干预因素的反应能力及程度,将明显影响实验结果.本研究对比了2种培养基法对所培养细胞生存能力及活性状态的影响. MTT检测结果显示,Neurobasal无血清培养基法所培养的神经元细胞活力较DMEM加Neurobasal无血清培养基法更高. MTT法不仅可以检测细胞的存活能力,还部分反映了细胞(包括神经干细胞、星形胶质细胞等)的增殖能力,但MTT法却不能表征其细胞生长的内在活性.
为进一步明确2种培养方法对所得细胞活性的影响,本研究选用了p-S6作为细胞活性状态的分子标志. S6蛋白是细胞内蛋白合成、细胞生长和细胞周期调控的关键分子[18].处于生长状态的神经元需要合成大量新的蛋白质,胞内磷酸化核糖体蛋白S6(p-S6)的表达水平会明显上调;因此,p-S6表达水平常作为神经元生长状态及细胞活性状态的分子标志[24].结果显示,在观察时段内,2种培养基法所得细胞活性均随着培养时间的延长而增加;但各观察时点,Neurobasal无血清培养基法所得p-S6阳性细胞数均高于DMEM加Neurobasal无血清培养基法,提示Neurobasal无血清培养基法所得细胞活性更高,且在培养第1 d与DMEM加Neurobasal无血清培养基法相比差异有统计学意义(p<0.01),呈现倍数关系.其原因可能是:1) DMEM加Neurobasal无血清培养基法培养神经元时,前期的培养基中含有血清,可以促进非神经元细胞贴壁生长,影响了神经元的纯度及细胞活性. 2) Neurobasal无血清培养基法中,B27作为无血清培养的添加剂,其中含有多种生长因子,适宜神经元的生长.
综上,本研究表明,原代培养的大脑皮质神经元部分生物学特性受培养方法直接影响.若采用DMEM加Neurobasal无血清培养基法培养神经元,在培养1~4 d内进行神经元相关实验,在阐释实验结果时需考虑星形胶质细胞及神经干细胞对研究结果的可能影响;若要求在高纯度神经元模型上进行实验,建议培养7 d之后进行,以免星形胶质细胞影响实验结果;而选择Neurobasal无血清培养基法培养7 d即可获得高纯度高活力的神经元.这将为实验目的导向的神经元原代培养方法选择提供借鉴,同时,Neurobasal无血清培养基法操作环节少,方便经济,且细胞纯度与活性较高,是体外培养神经元更理想的方法.




 下载:
下载: