-
近年来,生物学家将细胞的死亡形式分为凋亡性程序性细胞死亡(Apoptosis)、自噬性程序性细胞死亡(Autophagy)和细胞坏死(Necrosis) 3种类型[1]. Apoptosis也称为Ⅰ型程序性细胞死亡,Autophagy称为Ⅱ型程序性细胞死亡.自噬在细胞的生长、发育和疾病发生中起着重要的作用.随着参与自噬性程序性细胞死亡途径的关键分子的鉴定成功,我们对其分子机制、生理功能和在病理过程中的作用有了进一步的了解.近年来越来越多的研究提示,自噬与凋亡两种程序性细胞死亡方式某些情况下可以相互拮抗或促进,可先后发生或同时共存于同一细胞,相同诱导因素在不同细胞中可分别诱发自噬或凋亡;参与自噬和凋亡的分子也可能存在交叉,这些分子在自噬与凋亡两种程序性细胞死亡中可发挥正向或负向作用[2-3].
有学者提出Beclin 1可通过增强Caspase-9的活性来提高化疗药物CDDP诱导的人胃癌细胞MKN28的凋亡,说明作为自噬重要调控基因的Beclin 1也可参与细胞凋亡的调控[4].营养剥夺诱导的细胞自噬在Atg基因(Atg5,Atg6/Beclin 1,Atg10,Atg12)干扰RNA或Autophagy特异抑制剂(如3MA)存在的情况下,细胞可发生凋亡形式的程序性死亡[5].
梓醇是地黄的有效成分之一,具有多种药理活性.研究表明梓醇能促进PC12细胞轴突生长[6]、抑制细胞凋亡[7].课题组及其他学者研究表明梓醇能够保护脑缺血,减少脑缺血后缺血区域及半暗带区域神经元[8-10]和非神经细胞如脑内皮细胞和星性胶质细胞的坏死和凋亡[11].研究表明神经细胞缺血后死亡的方式多种多样,包括坏死、凋亡和自噬[11-12].但是梓醇是否可以通过调节自噬发挥保护作用尚未见相关报道.
本研究拟离体培养PC12细胞,以H2O2氧化应激损伤PC12细胞,离体模拟脑缺血急性期自由基损伤神经元模型[13],观察PC12细胞死亡的方式,观察梓醇是否有调控自噬或凋亡对H2O2诱导的PC12细胞发挥保护的作用.
全文HTML
-
倒置显微镜(奥林巴斯),CO2细胞培养箱(ESCO),生物安全柜(海尔),移液器(eppendorft),化学发光成像仪(Tanon-5200),电泳仪(BIO-RAD),PVDF膜(millipore),ECL化学发光液(advansta),BCA蛋白浓度试剂盒(北京鼎国昌盛生物技术有限公司),RIPA裂解液(北京鼎国昌盛生物技术有限公司),肾上腺嗜铬细胞瘤(PC12)细胞(中科院上海细胞所细胞库).
-
马血清和DMEM培养基(Hyclone),胎牛血清(杭州四季青生物公司),0.25%胰蛋白酶(Genview),二甲亚砜(DMSO,北京鼎国昌盛生物技术有限公司),四氮唑蓝(MTT,Sigma),辣根过氧化物酶标记山羊抗兔IgG(H+L)(武汉三鹰生物技术有限公司).梓醇购自石家庄流波百鸟生物技术有限公司,批号20091091015,纯度≥98%.
-
10 mmol梓醇母液:称取36.2 mg梓醇溶解在10 mL细胞培养基中,过滤灭菌,备用. 10 mmol 3MA母液:称取14.9 mg 3MA后用1 mL培养基稀释溶解,过滤灭菌,备用.
-
以不同浓度梓醇(0.01 mmol,0.1 mmol,1 mmol)和3MA预处理PC12细胞,干预2 h后加入H2O2达到所需的浓度,作用12 h.分为阴性对照组,H2O2损伤模型组,梓醇低、中、高剂量组(0.01 mmol,0.1 mmol,1 mmol),3MA对照组.
-
参考Chen等的方法[14],稍加改进:细胞复苏后,接种在含5%胎牛血清,10%马血清,DMEM基础培养基,1%青-链霉素的培养基中,培养条件37 ℃,5% CO2,隔天更换细胞培养液.待细胞融合至85%~90%,倒掉培养液,加入0.25%的胰蛋白酶消化,加入含血清的细胞培养液终止消化,计数,以105个/mL密度进行种板,待细胞密度达90%时用于试验.
-
将处于对数生长期的细胞悬液接种于96孔板中,待细胞贴壁并生长近融合状态时,按照1.3.2项进行分组和相应处理后,加入MTT溶液(5 mg/mL) 20 μL,37 ℃继续孵育4 h,终止培养,吸弃培养基,加入DMSO 150 μL,振荡10 min.用酶标仪490 nm波长测定吸光度(A).本试验同时设立空白组(加入200 μL无血清培养基),采用下列公式计算细胞存活率:
式中,OD试验组为试验组的吸光度,OD空白组为空白组的吸光度,OD正常组为正常组的吸光度.
-
参照文献[15],将培养板置于冰上并吸弃培养基,PBS稍润洗,吸弃PBS,每孔加入80 μL的蛋白裂解液,冰上作用5 min.收蛋白,吸取裂解后的蛋白裂解液转移至1.5 mL离心管中,涡旋混合置于冰上10 min后,4 ℃,13 000 r/min冷冻离心10 min,取上清液(含胞膜和胞浆裂解物)置于4 ℃预冷的离心管中,-80 ℃保存备用.取20 μL样品蛋白上样,SDS-PAGE凝胶电泳分离蛋白,电转蛋白至PVDF膜;5%的血清封闭液室温封闭2 h,分别加入抗LC3Ⅰ/Ⅱ(1:1 000,cell signaling),P62(1:1 000,cell signaling),Beclin1 (1:1 000,cell signaling),Bax(1:500,Proteintech),Bcl2(1:500,博奥森),Cleaved-caspase3(1:1 000,cell signaling),GAPDH(1:5 000,Proteintech)的一抗中4 ℃过夜.次日转入1:5 000辣根过氧化物酶标记山羊抗兔IgG(H+L)室温孵育2 h,洗膜后,ECL试剂盒显影,Tanon 5200化学发光仪采集图像,采用Image J软件进行分析.
-
细胞长至85%~90%后,弃培养液,PBS每5 min振摇3次;95%乙醇,-20 ℃固定45 min,PBS每5 min振摇3次;甲醇破膜作用2 min,PBS每5 min振摇3次;10%山羊血清常温封闭60 min,洗出封闭液,LC3抗体(1:500),4 ℃过夜孵育,PBS润洗每5 min 3次;加荧光标记的二抗-FITC,37 ℃避光孵育1 h左右,PBS润洗每5 min 3次;DAPI染核,室温避光孵育15 min,PBS润洗每5 min 3次洗去DAPI,迅速于荧光显微镜下采集图像.每张爬片200倍镜下观察和拍摄阳性细胞分布密集但互不重叠的3个视野,采用Image J图像分析软件计数细胞共计27个视野的平均阳性细胞数,进行统计分析.
-
结果均以平均数±标准差(x±s)表示.采用Oringin 8.0软件作图,试验数据采用IBM SPSS 20.0统计学软件进行单因素方差分析(ANOVA),组间两两比较用SNK法,p<0.05为差异具有统计学意义.
1.1. 仪器与材料
1.2. 试剂与药物
1.3. 药物配制与干预
1.3.1. 药物配制
1.3.2. 药物干预
1.4. PC12细胞的培养
1.5. 细胞存活率检测
1.6. Western Blot检测
1.7. 免疫荧光染色
1.8. 统计学处理
-
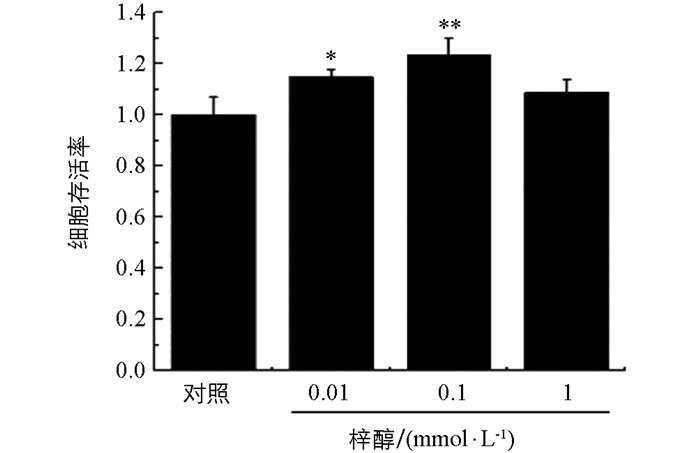
由图 1可见,加入梓醇后细胞OD值均高于对照组,当梓醇浓度为0.01 mmol和0.1 mmol时明显高于对照组(p<0.05,p<0.01),而梓醇为1 mmol时,细胞OD值虽高于对照组,但差异无统计学意义.说明梓醇在该浓度范围内对细胞无毒且可以使细胞活力增加,且较低浓度组效果更好.
-
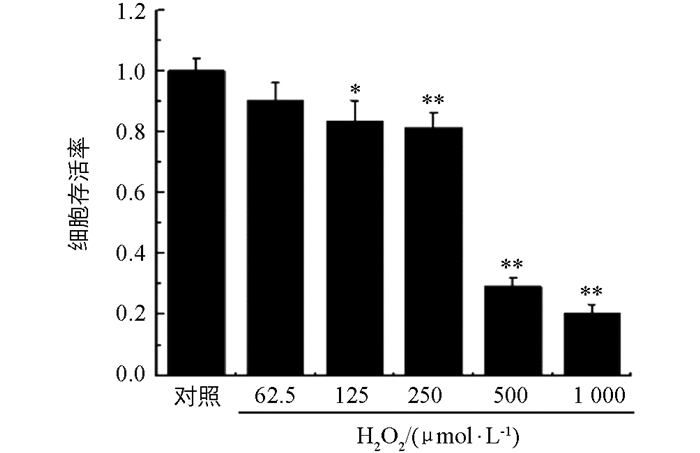
由图 2可知,随着H2O2浓度的升高,细胞的存活率与对照组相比呈现剂量依赖性降低,H2O2浓度低于250 μmol后,细胞存活率约为80%.与对照组相比,500 μmol和1 000 μmol H2O2损伤后细胞存活率显著降低(p<0.01).结果表明选择浓度为250 μmol的H2O2作用12 h作为损伤条件进行后续试验[19-20].
-
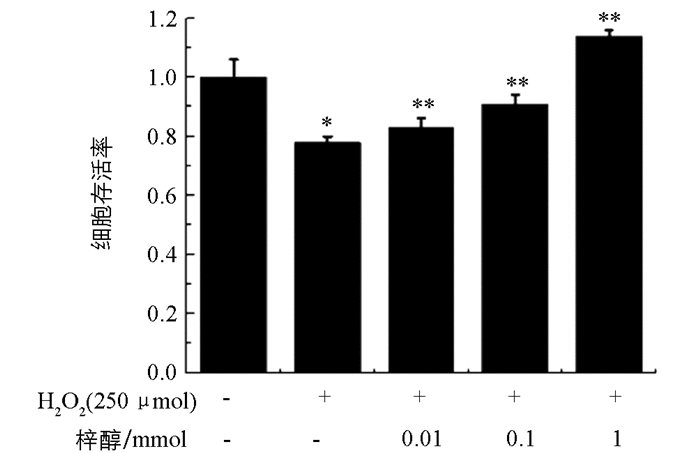
由图 3可知,H2O2损伤组与对照组相比细胞存活率显著降低(p<0.05),表明模型成功.随着梓醇浓度(0.01 mmol,0.1 mmol,1 mmol)的增高,H2O2损伤的PC12细胞存活率也显著提高,呈剂量依赖性增加.结果表明梓醇能够剂量依赖性地保护H2O2诱导的自由基对PC12细胞的病理损伤(p<0.01).
-
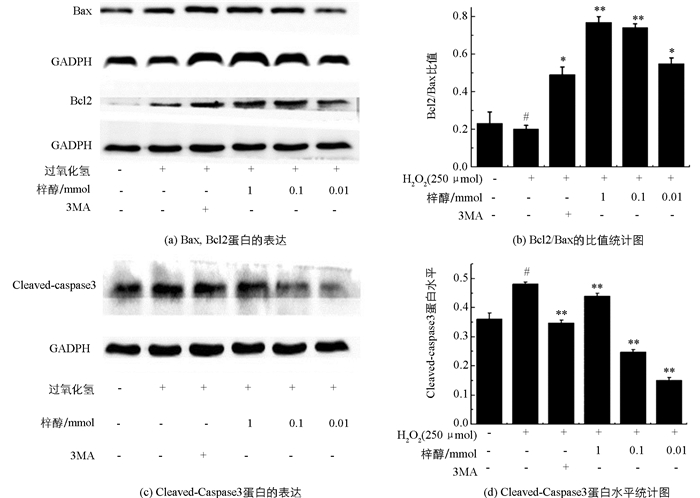
H2O2诱导凋亡12 h后,Western blot检测各组细胞中Bcl2,Bax和Cleaved-caspase3的蛋白表达情况,结果见图 4,模型组Bcl2/Bax的比值明显低于空白组(p<0.05).随着梓醇浓度的增加,Bcl2/Bax比值也在递增,与模型组相比,3MA组和梓醇低、中、高剂量组均显著上调了Bcl2/Bax比值(p<0.05,p<0.01).结果表明,H2O2诱导Bax的表达上升并降低Bcl2的表达,而梓醇能显著逆转这一趋势,通过恢复Bax与Bcl2的平衡,对抗H2O2诱导PC12细胞凋亡的效应.
Cleaved-caspase3的活化是细胞凋亡的典型特征之一,与空白组相比,模型组Cleaved-caspase3的活性显著增加(p<0.05),与模型组相比,梓醇低、中剂量组的Cleaved-caspase3的活性明显降低(p<0.01),且均低于3MA组.结果表明,梓醇低、中、高剂量组均能显著抑制H2O2诱导的Cleaved-caspase3激活,提示梓醇可能通过影响Caspase依赖性凋亡信号通路起到抗凋亡的效应.
-
免疫荧光染色结果显示,LC3Ⅱ聚集于自噬体膜上,自噬后的细胞表现为点状聚集增多,空白组、3MA组、梓醇低剂量组均未见PC12细胞显著表达LC3Ⅱ蛋白;与空白组相比,模型组有较少的LC3Ⅱ荧光表达;与模型组相比,梓醇高剂量组显著促进了LC3Ⅱ的表达,表明梓醇对自噬的调控与其剂量有关,低剂量梓醇抑制自噬,而高剂量的梓醇促进了自噬的激活,结果见图 5.
Western blot检测LC3Ⅱ蛋白表达情况,与空白组相比,模型组中LC3Ⅱ荧光的表达较强,与模型组比较,梓醇高剂量组显著性地促进了LC3Ⅱ/LC3Ⅰ的表达,梓醇低、中剂量组却抑制了LC3Ⅱ/LC3Ⅰ的表达,说明梓醇对H2O2诱导PC12损伤后自噬的调节与浓度相关,低浓度抑制自噬,高浓度激活自噬. Western blot检测与荧光染色结果一致.本试验有趣的现象是,与3MA组相比,H2O2损伤细胞后,自噬是激活的状态,梓醇各剂量组均激活了自噬,只是激活程度各有差异,结果见图 5.
2.1. 不同浓度的梓醇对正常PC12细胞存活率的影响
2.2. 不同浓度H2O2对PC12细胞损伤12 h后细胞存活率的影响
2.3. 不同浓度梓醇对H2O2损伤的PC12细胞存活率的影响
2.4. 梓醇对Bcl2,Bax和Cleaved-caspase3的影响
2.5. 梓醇对LC3的免疫荧光染色和Western blot检测
-
H2O2是一种活性氧分子,它参与了许多神经系统疾病的发病机制,常用作神经细胞氧化损伤的诱导剂.过量的自由基会导致细胞损伤,引起机体衰老及功能障碍.脑组织比其他任何组织器官更易受自由基的攻击,这是由于脑组织具有较高的需氧量、极高的代谢率,而抗氧化防御系统相对较缺乏.本试验利用H2O2模拟细胞微环境活性氧积累,证明250 μmol/L的H2O2处理12 h能显著诱导PC12细胞发生凋亡.利用3个浓度的梓醇作用于PC12细胞,试验结果显示,梓醇预处理后能显著增加抗凋亡Bcl2的表达,证明了梓醇能抑制H2O2诱导的细胞凋亡.这与马泰等[16]研究相符.
除此以外,本研究有以下新发现:1)不同浓度的梓醇对生理条件下PC12细胞存活率有影响,随着梓醇浓度的升高,对PC12细胞的存活率促进作用在下降,提示梓醇浓度过高,可能会抑制PC12细胞的增殖和存活;2)不同浓度的梓醇对PC12细胞凋亡和自噬有不同影响.
LC3Ⅱ免疫荧光显示PC12细胞受到H2O2损伤后,自噬有所激活,其中3MA和梓醇低剂量均抑制了自噬的激活,而梓醇高剂量却促进了PC12细胞LC3Ⅱ荧光的强表达. Western blot检测证明,H2O2可使LC3Ⅱ的表达上调,不同浓度的梓醇可使LC3Ⅱ不同程度上的抑制. LC3是自噬泡形成过程中的关键蛋白,具有2种形式:LC3Ⅰ和其蛋白水解衍生物LC3Ⅱ. LC3Ⅰ定位于胞浆,LC3Ⅱ定位于自噬双层膜上.一旦自噬体与溶酶体融合,自噬体内的LC3Ⅱ便被溶酶体中的水解酶降解,所以LC3Ⅱ含量或LC3Ⅱ/LC3Ⅰ的比值的增高反映了自噬活性的增强[17].
为探讨梓醇是否调控自噬和凋亡来影响PC12细胞的存活,采用3MA作为抑制自噬工具药,发现短期内3MA也促进了Bcl2/Bax的表达,同时抑制了激活型Cleaved-caspase3的表达,抑制了凋亡的发生.上述结果提示梓醇不仅可以通过抑制凋亡发挥保护作用,还可以通过调节自噬来发挥对神经细胞的保护.梓醇低剂量显著性地降低了激活型Cleaved-caspase3的表达,并且表达量比梓醇高剂量更低,显著地抑制了凋亡的发生.但梓醇高剂量抑制Cleaved-caspase3的活化表达量却相对低剂量和中剂量少.两者从不同角度证实梓醇调控自噬和凋亡的程度与其剂量相关.
有研究表明脑缺血时,抑制自噬有利于对脑缺血的保护;也有研究证实激活自噬可以促进对脑缺血的保护.在脑缺血等病理条件下,自噬被激活将会改变细胞的死亡模式,减少细胞的坏死和凋亡[18].因此自噬是一把双刃剑,自噬既可以导致凋亡,也可以挽救细胞免于凋亡[19-20].仅从western blot和免疫荧光结果看,我们尚且不能明确梓醇通过对自噬的调节究竟发挥保护性作用还是抑制作用,但结合PC12细胞的存活力数据,我们认为,梓醇低剂量促进PC12细胞的存活主要与低剂量梓醇抑制凋亡有关,可能是梓醇低剂量对凋亡和自噬综合调控作用的结果;而梓醇高剂量促进细胞存活率的能力最强,提示高剂量的梓醇有可能通过激活自噬促进细胞的存活.
既往研究表明,梓醇对中枢神经系统疾病的防治作用主要集中在梓醇抗脑缺血缺氧、减轻自由基损伤所致的凋亡方面.本研究发现了梓醇促进PC12细胞存活的不同机制,不同浓度的梓醇均能上调Bcl2/Bax的比值,降低Cleaved-caspase3的活化.但梓醇低剂量抑制自噬,高剂量激活自噬,说明梓醇调控自噬、减轻细胞凋亡与其剂量有关,但是梓醇如何通过对凋亡和自噬的交互作用调控细胞的存活尚需要课题组进一步研究.



 下载:
下载: