-
长江上游是我国淡水鱼类资源最为丰富的地区之一, 分布有鱼类261种, 其中特有鱼类112种[1].为保护宝贵的鱼类资源, 该江段建有我国最长的河流型自然保护区[2]—长江上游珍稀特有鱼类国家级自然保护区(以下简称“保护区”).宜宾至江津干流江段是保护区鱼类重要的栖息生境, 亦是铜鱼等在三峡水库和上游干流之间洄游的重要通道[3].近年来受水利水电工程开发、挖石采砂和水质污染等的影响, 该江段鱼类栖息生境发生了显著变化, 调查该江段水质状况可为长江流域资源保护提供科学依据.
周丛藻类Periphytic algal是指浸没在水中各种基质表面的有机体集合[4], 作为水体重要的初级生产者, 它不仅为其他水生生物提供丰富的食物来源[5]和生存环境[6], 也是水体物质和能量循环的重要环节[7].根据周丛藻类生物量、种数及群落结构变化, 能够获取大量与环境变化相关的生物响应信息, 在流速较快的水体中比浮游藻类更能客观地反映水体污染状况[4].已有学者研究过渭河[8]、古夫河[9-10]、洱海[11]、汾河[12]和嘉陵江[13]周丛藻类群落结构与水质状况之间的相互关系, 但有关长江上游保护区江段的相关研究较少[14-15].本文以天然基质周丛藻类为研究对象, 运用藻类多样性指数、污染指数和污染评价值等综合评价宜宾至江津干流江段水质状况, 以期为长江上游水质监测及资源保护提供参考资料.
全文HTML
-
在长江上游宜宾至江津段共布设5个采样点, 从上游到下游依次为高庄桥、江安、羊石、白沙和江津(表 1).基于长江上游水文、气候与环境变化特征, 采样时间设为2013年11月(秋季)、2014年1月(冬季)、4月(春季)和6月(夏季).
-
在每个采样点水下20 cm处, 随机捞取4块形状规则、表面平整的天然石块, 用工具在天然石块上划出3 cm×6 cm的区域后, 清洗区域外围并用蒸馏水冲洗, 注意不要触及区域内部.外围清洗干净后, 用硬毛刷仔细将区域内藻类刷洗到白色瓷盘内, 装入50 mL采样管中, 以15‰鲁哥氏液固定.固定样品在实验室避光静置沉淀24 h, 再浓缩至5 mL用以定性定量观察[16], 取0.1 mL均匀样品于浮游植物计数框内, 在10×40倍显微镜下进行分类鉴定, 多数藻类鉴定到种、变种, 部分鉴定到属, 每个样品需重复计数2次, 2次误差小于15%视为有效, 若大于, 则需要进行第3次计数, 取其平均值.种类鉴定主要参照文献[17-18].
-
本研究采用的生物多样性指数包括Shannon-Wiener多样性指数(H)、Pielou均匀度指数(J)及Margalef多样性指数(d), 相应计算公式参照文献[19].
-
文献[19]对耐受污染的20属藻类分别给予不同的污染指数值.根据水样中出现的周丛藻类, 计算总污染指数.若总污染指数大于20为重污染, 15~19为中污染, 低于15为轻污染.
-
Zelinka等[20]于1961年提出污染评价值(A), 即给予不同生物不同的污染价(Saprobic valency)和污染指示值(individual indicator value).污染价总和为10, 一种生物的指示价在某一污染带分布越集中, 则对该污染带的污染指示作用越大.污染指示值介于1~5, 值越大则指示污染的价值越大.污染评价值计算公式为
式中, ai是i种的污染价; hi是i种的个体数; gi是i种的污染指示值.由公式得到某一采样点对应于不同污染带的A值.A值在某一污染带的值最高, 该采样点就属于该污染带.污染价和污染指示值参考文献[19].
数据分析及处理使用SPSS 19.0和Microsoft excel 2013完成.
1.1. 采样点和采样时间
1.2. 样品采集与鉴定
1.3. 数据处理
1.3.1. 生物多样性指数
1.3.2. 污染指数法
1.3.3. 污染评价值
-
在采集的周丛藻类样品中检出硅藻门Bacillariophyta、蓝藻门Cyanophyta、绿藻门Chlorophyta和裸藻门Euglenophyta共4个门类, 共计31属82种.硅藻门、绿藻门和蓝藻门的周丛藻类占总种类数的98.79%, 其中硅藻门65种(79.27%), 绿藻门8种(9.76%), 蓝藻门8种(9.76%), 裸藻门仅1种(1.22%).由表 2可见, 5个采样点周丛藻类主要以硅藻为优势种, 且一直占据绝对优势, 以直链藻属 Melosira、菱形藻属 Nitzschia、舟形藻属 Navicula 及小环藻属 Cyclotella 等为主, 蓝藻门仅有颤藻属 Oscillatoria.高庄桥和江安的优势种主要是硅藻, 有部分蓝藻, 羊石、白沙和江津的优势种全为硅藻.
-
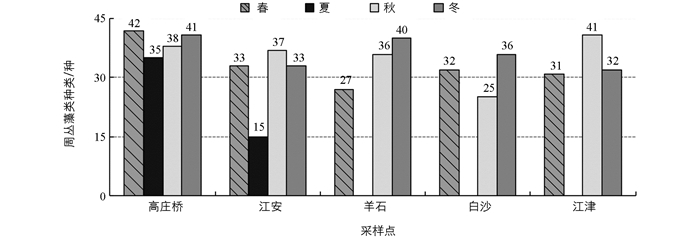
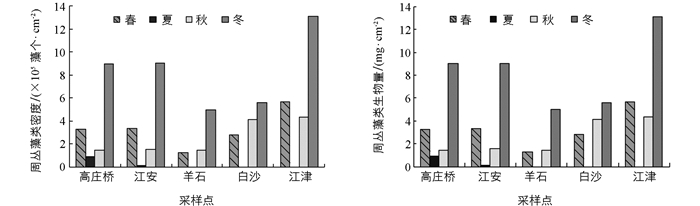
调查江段周丛藻类密度和生物量的时空变化见图 1, 夏季个别采样点因洪水期无法采样.春季、夏季、秋季和冬季长江上游周丛藻类密度均值分别为3.26×105, 0.52×105, 2.58×105和8.34×105个/cm2, 年平均密度为4.23×105个/cm2.由于各采样点水域环境不同, 周丛藻类的分布也存在差异.江津平均密度最大(7.70×105个/cm2), 其次是白沙(4.17×105个/cm2)、高庄桥(3.64×105个/cm2)和江安(3.52×105个/cm2), 羊石平均密度最低(2.56×105个/cm2).
春季、夏季、秋季和冬季长江上游周丛藻类生物量均值分别为1.18, 0.11, 1.06和3.16 mg/cm2, 年平均生物量为1.60 mg/cm2.江津平均生物量最高(3.96 mg/cm2), 其次是白沙(1.66 mg/cm2)、羊石(1.10 mg/cm2)和高庄桥(0.94 mg/cm2), 江安平均生物量最低(0.83 mg/cm2).从总体上看, 周丛藻类密度和生物量均为冬季最高, 夏季最低, 大致呈现出从上游到下游逐渐增大的趋势.
-
调查期间周丛藻类种类组成的季节变化如图 2所示.
在5个采样点中, 上游高庄桥的周丛藻类种类数较丰富, 其他位于下游的采样点周丛藻类种类数较少.周丛藻类种类数不同采样点间没有明显的变化规律.在季节变化上, 周丛藻类的种类数从大到小依次为秋季、冬季、春季、夏季.夏季受洪水的影响, 只有高庄桥和江安采到了样品, 种类数高庄桥大于江安; 冬季和春季4个采样点(羊石例外)呈现出从上游到下游周丛藻类种类数逐渐减少的趋势; 秋季4个采样点(江津例外)呈现出从上游到下游周丛藻类种类数依次减少的趋势.
在水平变化上, 上游高庄桥发现种类最丰富, 有64种, 占总数的78.05%;羊石、江津和江安种类数依次减少, 分别为54种、52种和47种; 白沙种类数最少, 仅有44种, 占总数的53.66%.各采样点均以硅藻门种类数最多, 比例高达82.81%~96.15%.
-
由表 3可知, Shannon-Wiener多样性指数(H)变幅为1.57~4.52, 总平均值为3.33, 季节变化从大到小依次表现为秋季、夏季、冬季、春季, 水平分布从大到小依次表现为高庄桥、羊石、白沙、江安、江津.H显示处于上游的高庄桥、江安、羊石、白沙都是轻污染, 下游的江津为β-中污染.Pielou均匀度指数(J)变幅为0.14~0.50, 总平均值为0.35, 季节变化从大到小依次为夏季、秋季、冬季、春季, 水平分布从大到小依次为高庄桥、羊石、江安、白沙、江津.J值显示上游的高庄桥为β-中污, 江安、羊石、白沙均为α-中污, 下游的江津为重污染.Margalef多样性指数(d)变幅为2.10~3.96, 总平均值为3.31.在季节变化上, d值从大到小依次表现为秋季、冬季、春季、夏季, 水平分布从大到小依次表现为高庄桥、羊石、白沙、江津、江安.d值显示高庄桥、羊石、白沙、江津为中污染, 江安为重污染.H值和J值都呈现出从上游到下游逐渐减小的趋势, 表明从上游到下游水质污染逐渐加重, 而d值的变化趋势不同于H值和J值.
-
从表 4可知, 各采样点的藻类污染指数在11~22之间, 调查期间长江上游水质整体为中污染.其中, 高庄桥水质为重污染, 江安、白沙和江津为中污染, 羊石为轻污染.藻类污染指数的评价结果应该与藻类的丰富度有显著关系.5个采样点全年优势种主要为硅藻门的直链藻属、菱形藻属、舟形藻属和小环藻属.在本次研究中, 污染指数较低的直链藻属、异极藻属、小环藻属、舟形藻属、菱形藻属和针杆藻属在所有采样点均有分布, 而污染指数较高的颤藻属、席藻属、纤维藻属、栅藻属和裸藻属分布并不均匀.
-
本研究共检出25种周丛藻类污染指示种(表 5), 占总种类数的30.5%.在β-寡污带的污染指示种有11种, α-寡污带有21种, β-中污带有24种, α-中污带有21种, 多污带仅1种.周丛藻类污染评价值(A)(表 6)显示, 调查期间5个采样点水质都处于β-中污, 除江津外, 其他采样点均有向α-中污过渡的趋势.综合评价得出, 长江上游采样断面整体为β-中污型水质, 与多样性指数水质评价结果基本一致.
2.1. 周丛藻类的种类组成及优势种
2.2. 周丛藻类的密度和生物量
2.3. 周丛藻类种类组成的水平分布和季节变化
2.4. 水质评价
2.4.1. 基于生物多样性指数的水质评价
2.4.2. 基于周丛藻类污染指数的水质评价
2.4.3. 基于周丛藻类污染评价值的水质评价
-
长江上游宜宾至江津段周丛藻类群落结构呈现出季节和水平分布上的差异.在季节变化上, 周丛藻类物种数、细胞密度和生物量均以温度较低的秋、冬2季最高, 而以温度较高的夏季最低.周丛藻类的生长与物理扰动、水体营养状况、光照、悬浮物、水温及水位变化等密切相关[21].林碧琴等[22]和郑凌凌[23]指出硅藻在温度较低的季节大量繁殖.韦丽丽等[24]和邓洪平等[13]研究发现, 河流流量大、流速快及洪水的冲刷作用不利于周丛藻、硅藻等的附着.长江上游夏季温度较高, 加之汛期流速较快, 可能抑制了藻类光合作用的强度, 从而直接影响藻类的繁殖, 而秋、冬季节温度低, 流速缓, 透明度高, 正好适合周丛藻类的附着与积累.
在水平分布上, 从上游到下游, 周丛藻类群落结构大致呈现出物种丰富度和多样性指数逐渐减小, 细胞密度和生物量逐渐增加的趋势.物种多样性是衡量群落规模和重要性的基础, 也是反映水体营养状况信息的重要参数[25].一般认为, 清洁水体中物种较丰富, 个体数少, 均匀性高, 群落较稳定, 而在污染水体中则相反[26].邓洪平等[13]指出, 在污染水体中, 喜污或耐污的硅藻大量生长繁殖, 并与其他种类争夺养料、空间等, 最终导致总的物种数减少、细胞密度增加、多样性降低.张峥等[27]对辽河流域的调查显示, 下游污染严重的断面着生藻类种类数和生物密度明显小于上游的清洁断面.高庄桥位于长江上游金沙江河段, 岷江汇入点之前, 远离城市, 污染小, 而江安至江津段沿途流经工业化强、人口密集的城区, 工业废水与生活污水排放增多, 虽然该河段汇入了岷江、沱江及部分支流, 对水体中的营养盐和污染物有一定的稀释和缓冲作用, 但河流的自净能力毕竟有限, 故该江段从上到下污染逐渐加重.
-
本研究运用藻类多样性指数、污染指数和污染评价值等对长江上游宜宾至江津干流江段水质进行了综合评价, 几种方法的评价结果存在一定差异, 但整体评价结果基本一致.Shannon-Wiener多样性指数和Pielou均匀度指数表明该水域下游污染大于上游, Pielou均匀度指数显示该水域夏季的污染程度低于其他季节, 为β-中污型, 而Margalef多样性指数显示该水域夏季的污染程度高于其他季节, 为重污染.黄玉瑶[28]、胡鸿钧等[17]指出, Margalef多样性指数未考虑各种生物的分配情况, 容易掩盖不同群落的种类和个体差异, 易受样本大小的影响, 评价的可靠性较低.Shannon-Wiener多样性指数既体现物种数量, 又体现物种个体的分布状况, 因此在评价水体营养状态时更具优越性[29].孙军等[30]研究发现, Pielou均匀度指数是浮游植物群落均匀度测度中一种较好的指数.Margalef多样性指数仅考虑了样本总种类数和总个体数, 而不关注各个种类的污染耐受性及在整个藻类群落中的分布情况.从本研究结果也可以看出, 运用Margalef多样性指数评价长江上游水质状况不如Shannon-Wiener多样性指数和Pielou均匀度指数可靠.
污染指示评价法可以简单、方便、直观地评价水体营养状况[31].在众多的污染指示法中, 文献[32]中提出的藻类污染指数法较为常用, 该方法通过研究适宜在污染水体中生存, 具有污染耐受性和污染特征值, 能够反映水体污染状况的20属藻类来揭示水质状况.周丛藻类污染指数显示, 高庄桥水质为重污染, 江安、白沙和江津为中污染, 羊石为轻污染, 该结果与藻类多样性指数评价结果有所不同.本研究中颤藻属、席藻属、纤维藻属、栅藻属和裸藻属在江安、白沙、江津3个采样点的出现频率和生物量各不相同, 但反映在污染指数评价结果上却是相同的.笔者认为, 藻类污染指数法仅考虑了20属耐受污染藻类是否出现, 而没有结合不同污染带指示种生物量的多少及优势种的指示性等进行综合评价, 因此在客观、准确反映水体受污染状况方面存在一定缺陷.
污染评价值(A)是Zelinka等[20]于1961年提出的一种新的评价方法, 即根据细菌、藻类、原生动物、水生昆虫等19种底生生物来计算A值, 评价结果更具代表性, 已得到广泛应用[33-34].藻类污染评价值给水质评价设置了一个量化标准, 它的计算不仅纳入了藻类污染价和污染指示值2个因素, 还考虑了指示种的种类数和个体数.A值显示, 该水域水质整体为β-中污型, 除江津水质状况集中在α-寡污带至β-中污带外, 其余采样点都有β-中污向α-中污过渡的趋势.这与各采样点指示种丰富度密切相关, 指示寡污带的菱形肋缝藻在江津较多, 指示中污带的梅尼小环藻和谷皮菱形藻在江津较少, 而在高庄桥至白沙段数量明显增多.藻类污染评价值与多样性指数和污染指数的评价结果基本一致, 因此运用于长江上游水质评价是可行的.



 下载:
下载: