-
植物内源激素(plant pytohormones)是植物体内自身合成的、能从产生部位运输到作用部位并在低浓度(小于1μmol/L)下具有生理作用的微量小分子物质, 其在植物发育的多个生理过程和环境刺激反应中发挥着重要作用.传统观点认为植物激素有五大类:生长素(IAA, Indole-3-acetic acid)、细胞分裂素(CKs, Cytokinins)、赤霉素类(GA, Gibberellins)、乙烯(ETH, ethylene)和脱落酸(ABA, abscisic acid).新近的研究将油菜素内酯(BR, brassinosteroid)、茉莉酸(JA, jasmonic acid)、水杨酸(SA, salicylic acid)和独脚金内酯(SLs, strigolactones)等具有生长调节活性的信号分子也作为了植物激素成员[1], 目前的内源激素测定仍以五大类激素为主.
植物激素在植物体内的含量极低, 检测过程中容易受色素、多酚等次生代谢物的干扰.因此, 如何快速、准确、高效地测定植物内源激素含量一直是困扰科学家的重要难题.目前常用的植物激素检测方法有酶联免疫检测法、高效液相色谱法、超高效液相色谱法、超高效液相色谱-质谱法、超高效液相色谱-质谱/质谱法等, 其中酶联免疫检测法具有简单和成本低廉等特点, 但其检测信号灵敏度较低, 重复性较差.色谱与质谱联用技术虽然可以在较短时间内分离鉴定多种植物激素, 但由于前处理技术要求和使用成本高, 未得到广泛运用.而高效液相色谱法具有易操作、灵敏度高和稳定性好等特点, 已成为分析测定植物激素的主要方法之一, 现已成功应用于李[2]、榛子[3]、苹果[4]、芒果[5]、骏枣果实[6]、梨[7]等木本植物的IAA、ABA、ZT和GA3等激素含量测定.曾庆钱等[8]利用高效液相色谱法测定了荔枝根、叶和果实中的IAA、GA3、ABA和ZT(回收率分别为78.52%, 82.36%, 79.83%和78.57%), 保留时间稳定, 试验重现性好.马海燕[9]采用高效液相色谱法测定了葡萄植株生长周期中冬芽、新梢、叶片、果实4个部位的IAA、GA3、ABA 3种内源激素的含量变化过程, 其样品中添加混标的回收率达到98.65%以上.陈建华等[10]运用高效液相色谱方法测定了板栗枝条的IAA、ABA、ZT和GA3 4种内源激素, 同时提取与纯化的过程连续使用3种分离柱的方法, 取得了良好效果.
枇杷(Eriobotrya japonica Lindl.)属于蔷薇科亚热带常绿木本果树, 原产于中国东南部, 目前广泛分布于世界各地包括中国、日本、印度、巴基斯坦、埃及、希腊、以色列、意大利、西班牙和土耳其等[11-14].枇杷果实酸甜可口, 具有丰富的营养物质, 并且具有润喉、止咳、健胃等多种药用价值, 深受消费者喜爱[15].然而, 枇杷的种子数目多, 平均单果含有3~5粒种子, 并且种子较大, 约占果实总重量的20%~30%, 可食率较低.目前, 植物多倍体基因表达研究相当活跃也取得了很大进展.染色体的倍性能改变基因的表达模式, 而基因表达模式的改变和功能的变化最终会导致表型的变化[16].本研究小组自1997年开始率先进行天然三倍体枇杷的选育, 已从筛选得到的三倍体种质资源中优选出大果、无籽、优质新品种3个, 但三倍体枇杷自然结实率非常低, 人为施加适量的外源GA3则可以提高坐果率, 保证其果实生长发育, 提高产量.本研究旨在通过建立高效液相色谱法同时测定枇杷果实发育过程中的10种植物激素的方法, 检测三倍体无籽枇杷果实发育过程中内源激素的含量变化, 为深入解析无籽枇杷坐果的机制提供科学依据.
全文HTML
-
2015年10月在重庆市枇杷工程技术中心种质资源圃对盛花期三倍体枇杷A322株系及二倍体同源株系大五星进行单花处理(每个株系选取3株).选取露白末期的花朵, 去除雄蕊后涂抹浓度为100 mg/L GA3, 以清水(含0.1%吐温-80)和无处理为对照.分别对处理当天和处理后1 d、2 d、3 d、5 d、10 d、15 d、20 d、25 d和30 d不同处理单花进行取样.每个株系采取混合取样, 每个单株取4个不同方位共15~20朵花.验证试验的甘蓝和番茄叶片取自重庆市级高校蔬菜学重点实验室盆栽苗.
-
标准品的配置:配制100 μg/mL ZT、KT、IAA、6-BA、IBA标准母液, 2 000 μg/mL GA3 、SA、BA、IBA、JA标准母液, 所有标样购于sigma-aldrich公司.样品用液氮研磨成细粉, 称取50 mg左右干粉, 加入0.5 mL异丙醇/水/盐酸(V/V/V=2:1:0.002), 4 ℃下100 rpm震荡1 h.加入1 mL二氯甲烷4 ℃震荡1 h.4 ℃ 13 000 g离心5 min, 取下清溶液.经氮气吹干后, 加入1 mL 80%甲醇溶液溶解样品.C18固相萃取小柱(500 mg, 3 mL)用6 mL甲醇活化, 6 mL 80%甲醇平衡后, 将提取的样品过柱纯化, 用1 mL 80%甲醇洗脱, 收集洗脱液.然后氮气吹干, 加入500 μL色谱甲醇溶液溶解, 0.22 μm有机滤膜过滤后注入2 mL棕色上样瓶, 置于-20 ℃冰箱中避光保存备用.
色谱条件:检测仪器为Agilent 1260 LC高效液相色谱仪, C18色谱柱(250 mm×46 mm, 5 μm, Dikma公司产品), G1314B紫外检测器.流动相:甲醇(A):乙腈(B):磷酸缓冲液(C)(pH值为3.0)=20:20:60;等度洗脱; 流速1 mL/min; 柱温35 ℃; 进样量10 μL; 测定时间30 min; 检测波长:IAA、IBA和JA为210 nm; ZT、GA3、KT、SA、6BA、BA、ABA为254 nm.
数据分析:根据植物激素标准品的保留时间对样品中的植物激素定性, 外标曲线计算植物激素的含量.试验数据用Excel和origin 9.0软件进行分析.
1.1. 试验材料
1.2. 试验方法
-
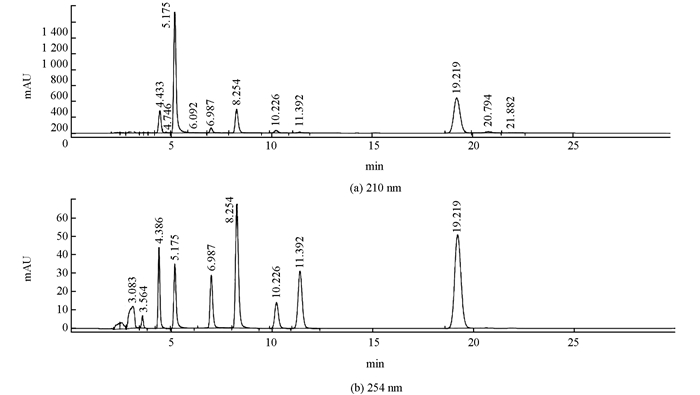
以0.1%甲酸水溶液和0.1%甲酸甲醇溶液为流动相, 参考Pan等的方法[17]进行梯度洗脱, 10种激素不能完全分开, 峰形较差.改变流动相以甲醇(A):乙腈(B):磷酸缓冲液(C)(pH值为3.0)=20:20:60, 进行等度洗脱后基线较好, 10种激素可以完全分开.取10种激素标准品溶液各100 μL配置成混合标样, 进样量为10 μL, 混合标样色谱图如图 1所示.
-
将配制好的混合标样稀释成一系列梯度浓度, 在相同的色谱条件下测定其峰面积, 以浓度x(μg/mL)为横坐标, 色谱峰面积(y)为纵坐标得标准曲线, 并求出相应的线性回归方程及相关系数.结果表明:10种内源植物激素在浓度范围内具有良好的线性关系, 相关系数在0.991 5以上.按3倍信噪比计算得到标准样品中10种植物激素的检出限(表 1), 检出限在0.004~4.92 ng之间, 说明本研究方法对植物激素有较高的检测灵敏度.
-
采用同样的色谱条件对混合标准溶液重复测定3~5次, ZT、GA3、KT、SA、6BA、BA、IAA、ABA、IBA和JA峰面积相对标准偏差分别为1.95%, 2.44%, 1.66%, 1.66%, 3.05%, 0.82%, 0.84%, 1.51%和1.41%, 在0.026%~3.05%之间.结果表明:本研究方法的重复性较好, 其精密度满足分析要求.
-
液氮研磨后称取两份相同质量的样品, 其中一份添加200 μL混合标准溶液, 以不添加混标的样本为对照, 测定样品的回收率, 枇杷中10种激素的回收率测定结果如表 2所示.为了进一步检验本研究建立方法的适用性, 我们以番茄和甘蓝两种植物幼嫩叶片为样本测定了加标回收率, 如表 3所示.结果表明:各种激素的回收率存在差异, 同一激素在不同植物中的回收率也不同.3种植物中, 枇杷幼果中回收率最高的是JA(85.2%); 番茄嫩叶中回收率最低的是BA(62.4%), 甘蓝中回收率最低和最高的分别是ZT和JA, 分别为60.9%和89.5%.整体而言, 番茄和甘蓝中各种激素的回收率高于枇杷.
-
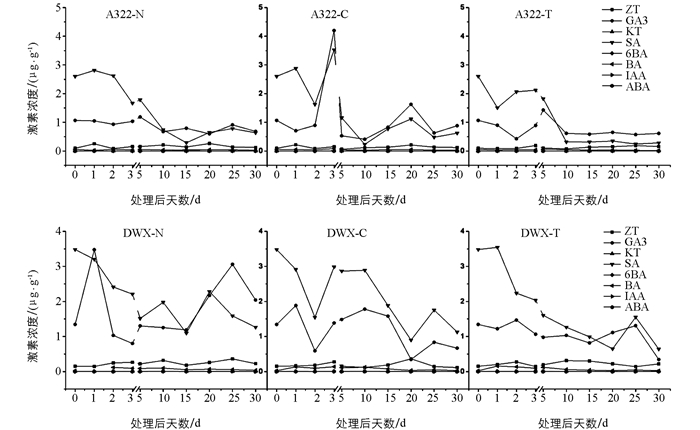
对三倍体A322和二倍体大五星枇杷果实发育早期的激素测定结果表明:SA和GA3的含量相对较高, 二倍体中各激素含量普遍高于三倍体, 且各激素含量的变化趋势在二倍体和三倍体中存在差异.自然条件下, 二倍体枇杷开花当天GA3含量明显增加, 随后迅速降低, 在花后20 d左右又增加, 而同样处理的三倍体中GA3含量一直呈降低趋势.赤霉素处理和二倍体和三倍体中GA3含量变化趋势基本一致, 在开花后一直降低.而清水处理条件下, 三倍体枇杷在开花后第3 d GA3含量骤然上升然后迅速降低, 而二倍体枇杷同时期条件下呈现出先降低后升高, 变化幅度相对较小, 导致这种变化的原因尚未探明(图 2).
2.1. 色谱条件的优化
2.2. 测定方法的线性范围和检出限
2.3. 测定方法的精密度
2.4. 回收率测定
2.5. 枇杷果实发育过程中植物激素的测定
-
样品前处理是激素分析的关键环节之一, 前处理的好坏决定着分析的准确性和精密度.木本植物具有组织多年生、结构复杂、单宁、黄酮醇、香豆酸等次生代谢物多等原因而造成杂质干扰对样品的前处理要求高[18].因此, 针对木本植物组织应采用适合的前处理方法.植物中激素提取最常用的提取剂是80%的甲醇[19-21], 4 ℃黑暗浸提过夜和旋转蒸发浓缩, 分离时水相(含ZT)和有机相(含IAA、ABA和GA3等)的植物激素需要分别进行提取纯化, 整个提取过程复杂且花费时间较长.Pan等[17]采用异丙醇/水/浓盐酸=2/1/0.002(V/V/V)及二氯甲烷在短时间内同时提取了样品中的IAA、CK、ABA、GAs、JA、SA及其甲酯态化合物.近几年参照此法测定植物内源激素的研究较多, 雷静等[22]参照此方法并进行改进, 在短时间内测定了马铃薯中的GA3含量.邓文红等[23]利用该方法测定了菊科植物油蒿叶片的激素含量, 取得了较理想的结果.
本试验参照Pan等[17]的方法测定枇杷内源激素时, 杂质干扰较大, 不能很好地分离各目标物质.因此, 本试验中增加了C18固相萃取小柱纯化处理过程, 但样品过柱后回收率同比降低了20%左右.卢巧梅等[21]采用固相萃取柱对水仙样品中的IAA、ABA和GA3进行了富集纯化, 加标回收率在81.0%~94.0%之间.杨途熙等[19]利用高效液相色谱法同时分离测定了仁用杏花芽中的ZT、GA3、IAA、6-BA、ABA、IBA、秋水仙素和腺素8种植物激素, 但样品未进行纯化处理, 样品加标回收率较高, 在95.4%~103.5%之间.这可能是由于固相萃取小柱除杂的纯化方法的基质效应较大, 纯化过程复杂且激素的损失较大, 而萃取后直接上样分析可以减少激素的损失.此外, 本试验结果表明, 枇杷花和幼果中各激素的加标回收率在58.6%~85.2%之间, 而草本植物番茄和甘蓝叶片中各激素的加标回收率在60.9%~101%之间, 整体较枇杷的回收率高, 其原因可能由于所用组织部位的不同.
-
已报道的高效液相色谱同时检测多种植物激素的含量方法采用的波长为254 nm.陈波浪等[24]和吴红京等[25]选用了254 nm波长同时检测ZT、GA、IAA和ABA几种激素.杨途熙等[19]以254 nm为检测波长同时测定了ZT、GA3、IAA、6-BA、ABA、IBA、秋水仙素和腺素8种植物激素.本试验通过全波长扫描发现IAA和IBA在210 nm和273 nm左右处各有1个吸收峰, 且273 nm处小于210 nm处的吸收峰, 而在254 nm处吸收峰值较小, 因此本试验选取210 nm波长用于IAA和IBA含量的测定, 以提高检测的灵敏度.此外, 植物激素单标检测时发现JA在210 nm处基线较254 nm处平稳, 因此选择210 nm作为JA的检测波长.综合文献报道及全波长扫描结果, 最终选取210 nm和254 nm作为本研究检测10种激素的波长.
-
植物激素的种类和含量变化与果实的发育密切相关.如施加外源性植物激素(GA3、IAA和CKs等)可以诱导果实单性结实[26], 比如柑橘[27]、苹果[28-29]、梨[30]、枇杷[31]、桃子[32]、西瓜[33]、番茄[34-35]和猕猴桃[36]等.前人的研究普遍认为GA3含量较高被认为有助于促进坐果.本试验结果显示, 枇杷果实发育初期, 二倍体枇杷GA3含量高于三倍体同时期, 三倍体枇杷经外源GA3处理后内源GA3含量有所增加, 这与GA促进坐果理论相一致.除了GA3, 在枇杷幼果中还检测到ZT、KT、SA、6-BA、BA、IAA、ABA、IBA和JA 9种植物激素, 说明果实发育是多种激素相互作用的结果.
在果实发育初期除JA和IBA两种激素在部分样本中未检测到外, 其余激素在各个时期的样品中均能检出, 各激素色谱图分离效果较好, 表明本研究建立的方法可用于枇杷等植物激素含量的分离和测定研究.



 下载:
下载: